Актуальность. Эозинофилы играют важную роль в развитии многих патологических состояний и отвечают за иммунный гомеостаз слизистых оболочек дыхательного и желудочно-кишечного трактов [12, 17, 19, 21, 22]. Известно, что при раке наличие и степень проникновения эозинофильных гранулоцитов в малигнизирующуюся ткань способны обеспечить важную прогностическую информацию [1, 2, 15, 20]. Однако остается неясным, связано ли увеличение числа эозинофилов с общей воспалительной клеточной реакцией или представляет собой автономный, противоопухолевый механизм, расшифровка которого может способствовать разработке консервативных методов лечения. Имеющиеся в доступной литературе данные свидетельствуют о том, что инфильтрация эозинофилами опухоли и окружающей её ткани связана с различными гистопатологическими параметрами, а также прогнозирует результаты лечения пациентов с онкологическим диагнозом [16, 23, 34]. Harbaum L., Pollheimer M.J., Kornprat P., Lindtner R.A., Bokemeyer C., Langner C. (2014) считают, что присутствие перитуморальных эозинофилов достоверно ассоциируется с благоприятным исходом [13]. Имеются многочисленные работы по изучению эозинофильной инфильтрации в инвазирующих опухолях, но отсутствуют данные о реакции эозинофилов в слизистых оболочках желудочно-кишечного тракта при формировании полипов и начале их малигнизации [4, 6, 10]. При этом вопросы о роли эозинофилов в индукции и ингибировании онкогенеза на современном этапе противоречивы [18, 27, 30]. Исключительные иммунологические свойства эозинофилов и способность к индукции ремоделирования тканей, что особенно важно при деструкции и нарушении клеточных взаимодействий в системе эпителиально-мезенхимных тканей при канцерогенезе, ставит изучение эозинофильной инфильтрации при малигнизации тканей в авангард по актуальности [3, 28, 31, 34].
Цель. Изучить особенности эозинофилов в составе инфильтрата малигнизирующейся слизистой оболочки ЖКТ человека.
Материалы и методы исследования
В работе изучен 71 биоптат из различных отделов ЖКТ человека, из которых были отобраны образцы, содержащие полипы. Для анализа использовали срезы в области границы здоровой ткани и формирования полипов. Исследование было проведено в соответствии с положениями Хельсинкской декларации (2000) и с разрешением этического комитета ФГАОУ ВПО «Дальневосточный федеральный университет». Забор биоптатов слизистой оболочки различных отделов ЖКТ произведён по клиническим показаниям с письменного информированного согласия пациентов. Весь материал распределили по полу и возрастным группам, а также по наличию полипов в каждой возрастной группе мужчин и женщин (табл. 1). Срезы окрашены классическим методом с применением гематоксилин-эозина. Анализ срезов выполнен на микроскопе Olympus Bx72 c цифровой фотокамерой DPx25 и фирменным программным обеспечением для получения иллюстраций и морфометрии.
Таблица 1
Распределение клинического материала по возрастным группам и наличию полипов в ЖКТ у мужчин и женщин
|
Пол/количество |
Возраст |
||||
|
Возраст |
31–40 |
41–50 |
51–65 |
66–70 |
72–74 |
|
М/53 |
7 |
15 |
15 |
9 |
7 |
|
Количество больных мужчин с полипами |
4 |
6 |
10 |
2 |
5 |
|
Топография полипов |
3 толстый к./1 пищевод. |
3 т.к./3 пищ. |
14 т.к./1 полость рта |
2 т.к. |
4 т.к./1–12 п.к. |
|
В % |
57 % |
40 % |
61 % |
22 % |
71 % |
|
Количество больных мужчин с малигнизацией |
1 |
3 |
2 |
2 |
0 |
|
ж/18 |
2 |
7 |
5 |
4 |
0 |
|
Количество больных женщин с полипами (т.к) |
2 |
7 |
2 |
1 |
0 |
|
В % |
100 % |
100 % |
40 % |
25 % |
0 |
|
Количество больных женщин с малигнизацией |
0 |
0 |
2 |
0 |
0 |
|
Общее количество больных мужчин и женщин |
9 |
22 |
20 |
13 |
7 |
|
Общее количество больных с полипами в возрастных группах |
6 |
13 |
12 |
3 |
5 |
|
В % |
66 % |
53 % |
60 % |
23 % |
71 % |
|
Итого: |
71 |
||||
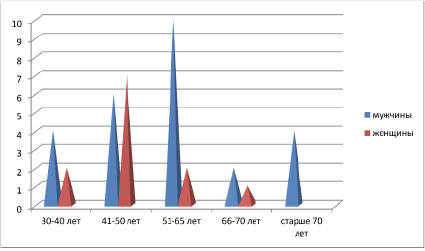
Рис. 1. Соотношение патологии ЖКТ, связанной с полипами, по данным клинического материала у мужчин и женщин
Результаты исследования и их обсуждение
Анализ клинического материала показал, что во всех возрастных группах заболеваемость, связанная с патологией желудочно-кишечного тракта у мужчин выше, чем у женщин. У мужчин количество больных с полипами в группе 31–40 лет – 57 %, 41–50 лет – 40 %, 51–65 лет – 61 %, 66–70 лет – 22 %, 72–74 лет – 71 % (диаграмма 1). У женщин в возрасте до 40 лет в группе обследованных больных в 100 % патология связана с наличием полипов, 41–50 лет – в 100 % найдены полипы, в группе 51–65 лет – в 40 % идентифицируются полипы, в 66–70 лет – в 25 %; женщины с полипами в группе старше 70 лет среди обследованных пациентов отсутствуют. Результаты показали, что полипы были выявлены эндоскопически в основном в толстом кишечнике, как у мужчин, так и у женщин. Малигнизация установлена как при клинической диагностике, так и подтверждена гистологически.
У женщин частота патологии ЖКТ, связанная с полипами, достигает 50 % в возрасте старше 50 лет, у мужчин она встречается в возрасте, как до 50, так и в старших возрастных группах, соответствует 55 % среди всей патологии ЖКТ у мужчин (рис. 1). При этом морфологическая картина полипа характеризуется разрастаниями эпителия с подлежащей соединительной тканью, участками разрушения базальной мембраны в эпителиальной пластинке, инфильтрацией лейкоцитами и локальной повышенной пролиферацией эпителия, метаплазией, эозинофильной инфильтрацией (рис. 2, а–г).
При сохранной базальной мембране и даже при наличии её фрагментов, но с признаками апоптоза в эпителиальной пластинке слизистой оболочки, в структурах собственной пластинки слизистой оболочки идентифицируются единичные эозинофилы (рис. 3, а–е).
При разрушенной базальной мембране эозинофилы вблизи поверхности слизистой оболочки не идентифицируются (рис. 4, а–б).
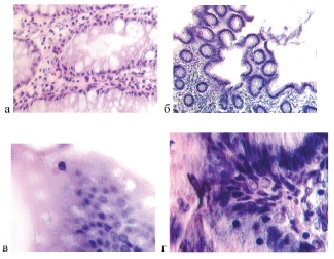
Рис. 2. а, б, в, г – полип желудка по малой кривизне у человека 64 лет. Окр. г/э. Микрофото. Ув. А, б х200; в, г х400
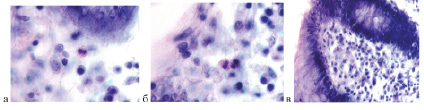
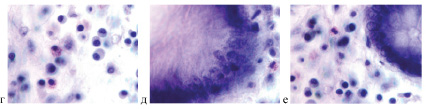
Рис. 3. Слизистая оболочка толстой кишки человека: а, б – в эпителиальной пластинке сохранена базальная мембрана. В собственной пластинке частично сохранена структура соединительной ткани, но большей часть разрушена; в – базальная мембрана частично разрушена. В инфильтрате преобладают клетки, бедные цитоплазмой, с шаровидным ядром; а – эозинфилов до 6 в поле зрения, б, в – эозинофилы отсутствуют. Окраска г/э. Микрофото. а, б, в, г – Ув. х 200; д, е – ув. х800
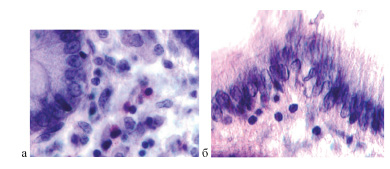
Рис. 4. Инфильтрация стволовыми клетками пространства перед разрушающейся эпителиальной пластинкой. Идентифицируются апоптозирующие эпителиоциты. Эозинофильная инфильтрация отсутствует. Окр. г/э. Микрофото. Ув.х 800
В зоне вокруг полипа эозинофилы представлены различными видами клеток. В первой группе эозинофилы имеют чётко идентифицирующуюся цитолемму, ядра круглой, овальной или неправильной формы (рис. 5, а, б). Другой тип клеток представлен дегранулирующими клетками, имеет ядра из двух или одного фрагментов (рис. 5, в, г, д).
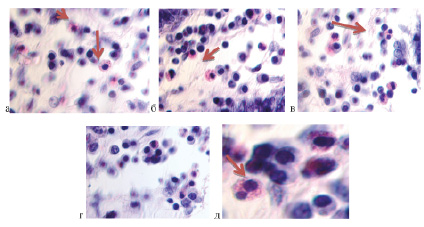
Рис. 5. Слизистая оболочка толстой кишки человека. Эозинофилы дегранулирующие (а) и с чётко идентифицирующейся оболочкой (б, в, г): а – с ядрами из 2-х шаровидных фрагментов, б – с шаровидными и ядрами неправильной формы; д – ядра из двух фрагментов с чётко идентифицирующейся перемычкой. Окраска г/э. Микрофото. Ув.х800
Морфологическими находками являются идентифицирующиеся в апоптозирующей эпителиальной пластинке эозинофилы отростчатой формы с признаками дегрануляции (рис. 6).
В составе инфильтрата эозинофилы группируются вблизи стволовых мигрантов (рис. 7 указаны красными стрелками), вблизи сосудов и внутри сохранившихся кровеносных сосудов (рис. 7, г, д, указаны зелёными стрелками).
В зоне, окружающей дегранулирующие эозинофилы наблюдаются клетки с признаками апоптоза (рис. 8).
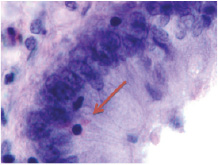
Рис. 6. Клетки инфильтрата в эпителиальной пластинке слизистой оболочки толстой кишки. Среди эпителиоцитов идентифицируются эозинофилы, апоптозирующие клетки. Окр. г/э. Микрофото. Ув.х800
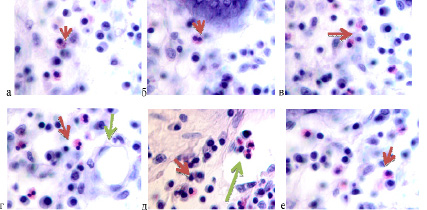
Рис. 7. Клетки инфильтрата в эпителиальной пластинке слизистой оболочки толстой кишки человека 58 лет. Идентифицируются эозинофилы, апоптозирующие клетки. Окр. г/э. Микрофото. Ув.х800
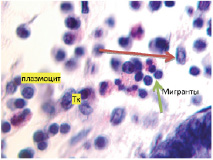
Рис. 8. Клетки инфильтрата в собственной пластинке слизистой оболочки толстой кишки. Идентифицируются эозинофилы, плазмоциты, апоптозирующие и молодые стволовые клетки, а также тучные клетки. Окр. г/э. Микрофото. Ув. х800
Нами отмечено, что при образовании полипа на поверхности слизистой оболочки морфологическая картина изменённой ткани характеризуется исчезновением базальной мембраны, апоптозом эпителиоцитов и миграцией в зону изменённой ткани клеток-мигрантов из крови. Идентифицирующиеся клетки инфильтрата пролиферируют амитозом, могут идентифицироваться как вблизи эпителиальной пластинки, так и на месте разрушенных эпителиоцитов, а также за пределами эпителия на поверхности. Структура собственной пластинки слизистой оболочки не идентифицируется, что может быть связано как с гибелью клеток соединительной ткани, ответственных за выработку межклеточного вещества, так и вуалированием их элементами инфильтрата крови, состоящего из жидкой среды, содержащей мигранты.
При формировании полипов процесс на фоне многолетнего развития заканчивается тотальным апоптозом, разрушением базальной мембраны, полным нарушением реституции. Это свидетельствует об особенностях репаративных свойств в структуре эпителиально-мезенхимных взаимодействий при образовании полипов и их малигнизации.
Нами установлено, что в целом в биопсийных образцах в окружающей полипы ткани эозинофилы идентифицируются в 100 %, а в условиях малигнизации в 90 %, отсутствуя непосредственно в ткани формирующихся опухолей. Но стоит обратить внимание на патологические формы эозинофилов, которые не встречаются в норме ни в периферической крови, ни в тканях. Обычный нейтрофил имеет ядро, состоящее из 2-х сегментов, в наших исследованиях эозинофильная популяция представлена клетками с шаровидными, иногда эксцентричными ядрами. Второй фенотип эозинофилов имел ядра из двух сегментов, но также шаровидной формы, в то время как в норме сегменты ядер эозинофильных гранулоцитов имеют небольшую ширину 12–20 мкм и длину до 7 мкм. Это может являться отражением не только количественного, но и качественного изменения синтеза белков и функции в целом. Caruso R.A., Branca G., Fedele F. et al. считают эозинофильную инфильтрацию ассоциированной со стромой опухоли при карциноме желудка [5]. Но эти данные об участии эозинофилов в разрушении структур нормальной ткани и синтезе стромальных элементов опухоли требуют дополнительных исследований.
Полученные нами результаты также не полностью согласуются с данными Harbaum L., Pollheimer M.J., Kornprat P., Lindtner R.A., Bokemeyer C., Langner C. (2014), представивших данные по эозинофильной инфильтрации в тканях при раке в I стадии в 21 %, на II этапе в 32 %, III этапе в 33 %, IV стадии в 14 % без указания локализации эозинофильной инфильтрации [13]. По нашему мнению, cогласующемуся с мнением других авторов, привлечение эозинофилов может быть связано с сигнальными молекулами апоптозирующего эпителия, в условиях его отсутствия и заполнения дефекта стволовыми клетками-мигрантами эозинофильная инфильтрация прекращается [7, 24]. Harbaum L, (2014) были обнаружены специфические эозинофильные гранулы, свободно располагающиеся в строме опухоли или в цитоплазме некоторых опухолевых клеток, а также получены косвенные доказательства фагоцитоза эозинофилами апоптических опухолевых клеток [13]. Мы наблюдали эозинофилы только на ранних этапах малигнизации, в период, когда начинается разрушение базальной мембраны, апоптоз эпителиоцитов. В период деструктуризации собственной соединительнотканной пластинки слизистой оболочки идентифицировались дегранулирующие эозинофилы, рядом с которыми располагались апоптозирующие клетки мигранты или апоптозирующие эпителиоциты. Andersen C.L., Siersma V.D., Hasselbalch H.C. (2014) предлагают считать эозинофилию одним из ранних признаков онкогенеза на основании выявленного ими увеличения в 2 раза заболеваний гемобластозами на фоне эозинофилии [3]. Другими авторами в экспериментах на животных установлено, что эозинофилы являются участниками опухолевого процесса, снижая туморогенез [10, 16].
По нашему мнению, эозинофилы могут быть информативными для определения стадии онкопроцесса и его обратимости.
Дополнительным подтверждением роли эозинофилов в канцерогенезе является взаимодействие эозинофилов с дендритными клетками, миграция и созревание которых осуществляется через посредство специфических белков, вырабатываемых эозинофилами, и которые, по нашим данным, при малигнизации мигрируют из эпителиальных пластинок в соединительную ткань, изменяя антигенпредставление и снижая барьерные свойства покровного эпителия [9]. Эозинофилы секретируют фактор роста нервов (NGF), что приобретает особое значение в условиях деструктуризации соединительной ткани собственной пластинки слизистой оболочки, а также цитокинов, влияющих на активацию и выживание тучных клеток, ответственных либо за фиброз, либо за разрушение собственной пластинки. Общепринято, что эозинофилы имеют уникальный режим регуляции в сравнении с другими лейкоцитами [32].
В организме человека эозинофилия часто наблюдается после иммунотерапии с Ил-2, Ил-4, ГМ-КСФ [29]. В опухоли эозинофилы появляются в результате некроза. Также известно, что некоторые опухолевые клетки вырабатывают Ил-5, IL-3, eotaxin-1 и вызывают активацию регулируемых хемокинов (TARC или CCL17), которые могут коллективно действовать на дифференциацию и миграцию эозинофилов [26]. Результаты опытов по выращиванию культуры опухолевых клеток в условиях воздействия макрофагов, эозинофилов и стволовых клеток крови показали их ингибирующее действие на раковые клетки [25]. Но существуют также данные, доказывающие отрицательную роль и макрофагов, и эозинофилов, способствующих деструкции ткани в условиях малигнизации, или, наоборот, вызывающих её фиброз [3, 20]. Мы считаем, что стволовые клетки крови в условиях культуры могут составлять элементарную конкуренцию раковым клеткам.
Заключение
На основе анализа клинического материала и высоких показателей патологии ЖКТ, связанной с полипами, в возрастных группах женщин старше 50 лет, можно предположить, что изменения гормонального фона пациентов в данной возрастной группе могут играть важную роль в регуляции не только пролиферативной активности эпителия ЖКТ, но и влиять на способность эпителиоцитов к физиологической и репаративной реституции [32]. Эозинофильная инфильтрация в слизистую оболочку ЖКТ в норме и при патологии отражает не только состояние иммунного гомеостаза, но и является показателем адаптации структур организма к условиям снижения выработки глюкокортикоидов [27]. Эозинофилы имеют ряд иммуномодулирующих факторов, которые освобождаются после активации клеток, в том числе свыше 35 цитокинов, факторов роста и хемокинов [7]. В отличие от T и B клеток, эозинофилы способны к немедленной реализации цитокинов в ответ на стимуляцию в течение нескольких минут. В то время как некоторые цитокины хранятся в виде сформированных в гранулы посредников кристаллоидных и секреторных пузырьков, эозинофилы способны немедленно синтезировать и секретировать эти иммунологические факторы [25]. Некоторые из молекулярных механизмов, которые координируют заключительную секрецию цитокинов, участвуют в синтезе мембраны, снабженной чувствительными рецепторными ловушками. Эти внутриклеточные рецепторы регулируют выпуск гранул и пузырьков, содержащих цитокины и хемокины.
Davoine F, Lacy P. (2014) при исследованиях на человеке и животных получены новые данные об активном участии эозинофилов в физиологической и репаративной регенерации в качестве источников синтеза иммуномодулирующих и ремоделирующих ткани факторов [7].
Полученные данные открывают перспективы разработки новой стратегии коррекции малигнизации с использованием секреторной активности эозинофилов с помощью индукции увеличения количества необходимых фенотипов эозинофилов.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г. и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.); государственного задания по теме «Разработка современных средств доставки лекарственных веществ на основе технологий стволовых клеток и наноструктурированных морских биополимеров», № проекта: 413.



