Строение р53, его гомологи и изоформы
Супрессор опухолевого роста p53 играет решающую роль в поддержании генетической стабильности клетки и предотвращении развития злокачественных опухолей. Для осуществления этой функции р53 участвует со множестве клеточных реакций, модулируя репарацию и выживаемость клеток, а также апоптоз. В конце девяностых годов были отрыты два родственных белка р53: p63 и p73, которые являются структурными, биологическими и биохимическими гомологами р53. Также были выделены двенадцать изоформ р53, шесть изоформ р63 и четырнадцать изоформ р73.
Белок р53 кодируется геном TP53, расположенным на 17p13.1 хромосоме человека. Канонический белок p53 (p53α) представляет собой наиболее распространенную изоформу, кодируемую TP53. Другие изоформы p53 являются результатом альтернативного сплайсинга, действия альтернативных промоторов и альтернативой инициации трансляции. ТР53 содержит проксимальный промотор , который контролирует экспрессию p53 (p53α, – β, и – γ) и Δ40p53 (α, β, γ) и внутренний промотор, регулирующий экспрессию Δ133p53 (α, β, γ) и Δ160p53 (α, β, γ).
p53α, – β, – γ
Изоформы р53 p53α, – β, – γ могут быть получены в результате классического или альтернативного сплайсинга гена ТР 53. p53α сохраняет олигомеризационный домен, способный связываться с лигазой MDM2 и, таким образом, регулировать стабилизацию р53. p53β может влиять на транскрипционную активность р53 в отношении промоторов р21 и BAX, в то время как p53γ – только в отношении BAX. p53γ, кроме того, обладает цитотоксической активностью [14].
∆40p53α, ∆40p53β, ∆40p53γ
Изоформы ∆40p53 (p47) образуются в результате альтернативного сплайсинга 2-го интрона и/или альтернативной инициации трансляции. Известно, что ∆40p53α обладает доминантно-негативным влиянием в отношении р53, ингибируя его транскрипционную активность, а также ослабляет р53-опосредованное подавление роста клеток. Также ∆40p53α влияет на убиквитацию и внутриклеточную локализацию р53 [8].
∆133p53 и ∆160p53
Изоформы ∆133p53 и ∆160p53 образуются путем альтернативной иницации трансляции с помощью внутреннего промотера ТР53. ∆133p53α препятствует регулируемому р53 репликативному старению, остановке клеточного цикла клетки в фазе G1 и апоптозу, а также вызывает миграцию эндотелиоцитов, формирование кровеносных сосудов и образование метастазов путем регуляции ангиогенеза независимо от р53, таким образом, принимая активную роль в развитии и прогрессии опухоли [3]. Роль ∆133p53β и ∆133p53γ, экспрессирующихся в неизмененных тканях человека в настоящее время до конца не известна.
В целом, изоформы p53 участвуют в ответе клетки на стресс как опосредованно путем регуляции транскрипционной активности белков семейства р53 , так и напрямую путем связывания с генными промоторами, участвующими в апоптозе (BAX) и остановке клеточного цикла (p21 и miR34a). Таким образом, они могут ингибировать или усиливать опухоль-супрессорную активность р53. Кроме того, полагают, что изоформы р53 имеют также и многочисленные р53-независимые функции [12].
Выявление изоформ р53 с помощью различных антител
В настоящее время существует большое количество антител к р53, которые ранее можно было разделить по их специфичности на три большие группы – предназначенные для выявления только дикого, типа р53 (пример: клон PAb1620), для выявления как дикого так и мутантного типов р53 (пример: клоны DO-1, DO-7), и для выявления только мутантного р53 (пример: клон PAb240). Однако в последнее десятилетие были выявлены 12 изоформ р53 и, как оказалось, не все антитела, даже принадлежащие к одной из трех перечисленных групп обладают одинаковой способностью выявлять экспрессию тех или иных изоформ. В таблице представлены данные в отношении клонов р53 из наиболее распространенной группы антител, предназначенных для выявления как дикого, так и мутантного типов р53.
Как видно из таблицы, некоторые из антител к р53 являются тропными сразу к нескольким изоформам р53, в то время как другие – лишь в отношении одной из изоформ. Антитела DO-1 и DO-7, которые имеют одинаковый эпитоп, специфичны только в отношении P53α, P53β и P53γ. Антитела 1801 позволяют выявить экспрессию всех изоформ кроме Δ133 P53 (α,β и γ), в то время как антитела DO-12 являются пантропными в связи с эпитопом, локализованным на ДНК-связывающем домене, и позволяют выявлять все изоформы р53. Антитела BP53.10, 421 и ICA-9 специфичны в отношении изоформ P53α, Δ40 P53α и Δ133 P53α из-за эпитопа, локализованного на С-концевом домене белка р53. Антитела CM-1 и SAPU (оба клона были синтезированы против изоформы P53α) также могут выявлять все изоформы р53, однако CM-1 плохо реагирует в отношении Δ133 P53β и Δ133 P53 γ. Антитела SAPU имеют дополнительный эпитоп на ДНК-связывающем домене, что позволяет им эффективно выявлять все изоформы р53. Однако, поскольку изоформы р53 не содержат всех эпитопов антител CM-1 и SAPU, выявление относительной экспрессии изоформ р53 с использованием данных клонов представляется затруднительным и данная оценка могла бы быть произведена только с помощью клона DO-12. Также с целью научного изучения экспрессии изоформ р53 были синтезированы антитела к β изоформам р53, Δ40 P53 и Δ133 P53, так как не одно из доступных коммерческих антител не позволяет выявлять каждую из изоформ р53 по отдельности [20].
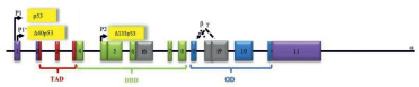
Строение р53. Обозначены проксимальные промотеры Р и Р’ (ответсвтенны за экспрессию, внутренний промотор Р2, домен, активирующий транскрипцию TAD, ДНК-связывающий домен DBD, домен, отвечающий за олигомеризацию OD (адаптировано по Pflaum J. и соавт. [15]
Выявление изоформ р53 с помощью различных клонов антител к р53
|
Моноклональные антитела |
Поликлональные антитела к |
||||||||||
|
DO-1 |
DO-7 |
PAb 1801 |
DO-12 |
BP 53.10 |
PAb 421 |
ICA-9 |
KJC8 |
MAP4.9 |
CM-1 |
SAPU |
|
|
P53α |
++ |
++ |
+ |
+ |
+ |
+ |
+ |
– |
– |
++ |
++ |
|
P53β |
++ |
++ |
+ |
+ |
– |
– |
– |
+ |
– |
++ |
++ |
|
P53γ |
++ |
++ |
+ |
+ |
– |
– |
– |
– |
– |
++ |
++ |
|
Δ40 P53α |
– |
– |
+ |
+ |
+ |
+ |
+ |
– |
– |
++ |
++ |
|
Δ40 P53 β |
– |
– |
+ |
+ |
– |
– |
– |
+ |
– |
+ |
++ |
|
Δ40 P53 γ |
– |
– |
+ |
+ |
– |
– |
– |
– |
– |
+ |
++ |
|
Δ133 P53α |
– |
– |
– |
+ |
+ |
+ |
+ |
– |
+ |
+ |
+ |
|
Δ133 P53 β |
– |
– |
– |
+ |
– |
– |
– |
+ |
+ |
+/– |
+ |
|
Δ133 P53 γ |
– |
– |
_ |
+ |
– |
– |
– |
– |
+ |
+/– |
+ |
Примечание. ++ : выраженная экспрессия, +: умеренная экспрессия, +/– :слабая экспрессия, –: нет экспрессии (оценка методом Western Blot) (адаптировано по Khoury M.P. и соавт. [12]).
Изоформы р53 в злокачественных опухолях
Несмотря на то, не во всех разновидностях рака мутация гена ТР 53 является часто встречающейся, известно, что инактивация сигнального пути р53 может происходить в разных опухолях различными путями. В последние годы, учитывая тот факт, что экспрессия изоформ р53 в опухолях отличается от неизменных клеток, изучение роли в канцерогенезе является определяющей.
Накоплены определенные данные, касающиеся экспрессии изоформ р53 в различных опухолях. Так, в молочной железе отмечено, что в то время как в нормальной ткани молочной железы экспрессируются p53α, p53β, и p53γ, в 60 % опухолей молочной железы отмечается потеря экспрессии 53β и p53γ, а в 40 % из них – гиперэкспрессия изоформы [4]. В отношении меланомы было показано, что изоформы p53βand Δ40p53 экспрессируются в опухолевых клетках, но не в меланоцитах или фибробластах [2]. В почечно-клеточной карциноме отмечается гиперэкспрессия изоформ p53β и Δ133p53 по сравнению с нормальными клетками [19]. Также показано, что отличная от неизменных клеток экспрессия изоформ р53 отмечается в холангиокарциномах, глиобластомах, опухолях головы и шеи, раке толстой кишки, яичников и легких [10, 21]. Было показано, что изоформы р53 обладают способностью переключать активность р53 между действием, направленным на выживаемость клетки и направленным на запрограммированную гибель клетки. Таким образом, в условиях их изменённой экспрессии они могут выступать фактором, способствующим развитию и прогрессии опухоли, а также препятствовать развитию чувствительности опухоли к химиотерапии.
Важным аспектом является выявление связи между профайлингом экспрессии изоформ р53 и прогрессией опухоли, а также между клиническим ответом на терапию и прогнозом заболевания. В отличие от p53β, который способствует репликативному старению, ∆133p53α вызывает пролиферацию клеток и препятствует их старению. В результате Fujita и соавт. описали так называемую инверсию соотношения p53β/∆133p53 (снижение экспрессии p53β и сопутствующее увлечении экспрессии ∆133p53α), которая участвует в прогрессии колоректальной аденомы в карциному [7]. В почечноклеточной карциноме гиперэкспрессия p53β в опухоли связана со стадией опухоли и является хорошим методом предиктором опухолевой прогрессии [19]. Было показано, что патологическая экспрессия p53β и ∆133p53 имеет место в муцинозных карциномах яичника. Кроме того, экспрессия ∆40p53α в карциномах яичника с диким типом р53 связана с более высоким процентом безрецидивной выживаемости пациенток [9].
Важно отметить, что в серозных карциномах яичника при III-IV стадии заболевания и наличии мутации в гене TP53 эксперссия ∆133p53α связана с более высоким уровнем выживаемости без признаков заболевания и общей выживаемости, в то время как при III-IV стадиях заболевания без мутации TP53 (дикий тип) отмечается лишь более высокая выживаемость без признаков заболевания [11]. Таким образом, можно предположить, что мутации в гене ТР53 могут влиять на прогностическую ценность изоформ р53. Кроме того, экспрессия p53δ связана с низким ответом на лечение и плохим прогнозом заболевания [10]. Поскольку изоформы р53 влияют на опухоль-супрессорную активность р53, предполагают, что их гиперэкспрессия или потеря экспрессии играет определённую роль в канцирогенезе. Однако в некоторых случаях они могут играть и ингибирующую функцию при таких мутациях ТР53 с приобретением новой функции (gain of function mutation). Примером такого механизма может служить гиперэкспрессия ∆133p53 при карциномах яичника с мутациями в гене ТР53 или гиперэкспрессия p53γ в карциномах молочной железы с мутацией ТР53, что приводит к ослаблению негативного влияния мутации ТР 53 [4, 11].
Клиническое значение активности изоформ р53 при злокачественных опухолях
В настоящее время в разработке находится новая терапевтическая стратегия, направленная на реактивацию р53 в раковых клетках путем активизации мутантного белка р53 или путем ингибирования супрессоров р53, таких как MDM2 [17]. Кроме того, учитывая, что изменение экспрессии изоформ р53 связано с развитием и прогрессией злокачественных опухолей, можно предположить, что профайлинг экспрессии этих изоформ может стать эффективным опухолевым маркером и мишенью таргетной терапии рака. В настоящее время хорошо известны, различные стрессовые воздействия на клетку, так как повреждения ДНК приводят к изменению процесса мРНК-сплайсинга [6]. В некоторых исследованиях было показано, что экспрессию изоформ р53 можно модулировать In vivo с помощью химиотерапии [1, 2]. Некоторые регуляторы экспрессии p53 изоформ уже известны, например дискерин и аннексин A2 [13, 18]. Схемы лечения, направленные на модуляцию этих факторов и, следовательно, на экспрессию изоформ р53, могут снизить негативное влияние повышенного соотношения Δ133p53α/p53β для того, чтобы остановить распространение и прогрессирование рака. Кроме того, экспрессию изоформ р53 можно регулировать путем влияния на деградацию соответствующих белков. Вся схема убиквитации изоформ р53 в настоящее время не известна, однако уже было показано, что изформы р53 по-разному реагируют с основной E3-лигазой р53, MDM2 [5]. Так, антагонист MDM2 нутлин-3а (nutlin-3а) стабилизирует p53α и сенсибилизирует клетки к химиотерапии [16].
Заключение
С момента открытия р53 необходимость расширения знаний об этом белке постоянно увеличивалась, учитывая, прежде всего, его важную роль в процессе карциногенеза. Белок p53 участвует во многих физиологических процессах, однако наиболее изученным является его опухоль-супрессорная функция. Кроме того, p53 объединяет множество клеточных сигналов от поврежденных субклеточных органелл, а также межклеточных контактов, внеклеточного матрикса, гормонов и цитокинов. На основании этих сигналов р53 регулирует такие процессы в клетке, как выживаемость, старение, дифференцировку, миграцию клеток и запрограммированную гибель клеток. На основании многочисленных исследований было выявлено, что ген TP53 кодирует несколько изоформ p53, которые взаимодействуют с p53 и модулируют его активность в отношении стимуляции выживаемости или гибели клеток. Учитывая тот факт, что изоформы p53 играют фундаментальную роль в регулировании сигнального пути p53, их экспрессия часто нарушена в злокачественных клетках. В связи с этим была выдвинута гипотеза о том, что дикий тип р53 может выступать в качестве супрессора опухолевого роста или протоонкогена в зависимости от профайлинга экспрессии изоформ р53. В некоторых видах рака измененная экспрессия изоформ p53 коррелирует с клиническими проявлениями, рецидивированием рака и/или общей выживаемостью. Кроме того, некоторые изоформы р53, как полагают, могут выступать в качестве потенциальных маркеров для терапии рака. Тем не менее, изформы p53 нельзя разделить на онкогенные или опухоль-супрессорные классы, так как их биологическая активность и, следовательно, их прогностическое значение связаны с типом тканей. В то же время было высказано предположение, что некоторые изоформы p53 могут стать успешными объектами таргетной терапии рака, как, например, при тройном негативном раке молочной железы. Чтобы достичь успехов в разработке такой терапии, необходимо более глубокое понимание процессов регуляции экспрессии и реализации эффектов изоформ р53, а также их действия в зависимости от типа ткани и дикого или мутантного типа р53 в тех или иных опухолевых клетках.



