К настоящему времени рак желудка занимает пятое место среди онкологической заболеваемости и ежегодно поражает около 1 миллиона человек [4]. Кроме того, характеризуется плохим прогнозом: 5 летняя выживаемость обычно не превышает 20 %. Безусловно, своевременность выявления данного заболевания играет существенную роль в формировании прогноза.
Трансформация клеток в раковые и опухолевая прогрессия связаны с накоплением изменений в геноме, возникающих в результате нарушения его нормального функционирования под действием наследуемых и приобретенных мутаций. При разных гистологических типах рака желудка показан целый ряд нарушений генов, которые могут считаться потенциальными молекулярными маркерами, тем более, что некоторые нарушения этих генов могут выявляться уже на ранних стадиях желудочного онкогенеза [1].
GSTP1 кодирует глутатион-S-трансферазу пи, один из ферментов второй фазы системы детоксикации гидрофобных и электрофильных ксенобиотиков и канцерогенов, который осуществляет их превращение из активных метаболитов в нетоксичные водорастворимые компоненты и предотвращает, таким образом, повреждение ДНК [3]. Клиническая роль изменений GSTP1 при раке до сих пор неясна, в литературе имеются данные о снижении его экспрессии при плоскоклеточном раке полости рта и данные об увеличении количества копий этого гена в клеточных линиях рака головы и шеи [5].
NFKB1 кодирует транскрипционный фактор NF-κB1 (ядерный фактор «каппа-би») – универсальный фактор транскрипции, контролирующий экспрессию генов иммунного ответа, апоптоза и клеточного цикла. Транскрипционный фактор NF-κB1 может активироваться активными формами кислорода и УФ излучением. В норме активность сигнального пути NF-κB в клетке находится под строгим контролем, однако мутации различных генов могут стать причиной его конститутивной активации. Это имеет место при лимфомах разного происхождения, множественной миеломе и раке [8].
HV2 – локус D-петли митохондриальной ДНК (мтДНК) относится к регуляторным не кодирующим элементам и обладает высокой мутабельностью. Мутации в этой области наблюдаются при различных онкологических заболеваниях. Делеции в определенных участках мтДНК наблюдаются при раке почки [7].
Изменение числа копий гена является одним из основных механизмов контроля раковой клеткой ключевых для выживания и малигнизации экспрессии генов. Копийность генов или вариация числа копий генов (сopy number variation, CNV) – вид генетического полиморфизма, результатом которого может явиться снижение или повышение числа копий определенного гена, и, следовательно, пониженная или повышенная экспрессия продукта гена – белка или не кодирующей РНК [6].
Идентификация генов, которые изменяют копийность, очень важна, потому что эти гены могут представлять инициаторную точку генетических изменений.
Цель исследования. Изучить изменения относительной копийности генов GSTP1, NFKB1 и HV2 при разных гистологических типах рака желудка.
Материалы и методы исследования
Изучены образцы тканей (опухолевые и условно здоровые), которые были получены в процессе хирургического вмешательства в Ростовском научно-исследовательском онкологическом институте с 2013 по 2014 гг., у 29 пациентов с различным гистологическим типом рака желудка: аденокарцинома G1-G2 (15 пациентов), G3 (5 пациентов), перстневидноклеточный рак (5 пациентов) и смешанного типа (аденокарцинома G3 + перстневидноклеточный рак) (4 пациента). Все пациенты, вошедшие в данное исследование, имели ECOG статус от 0 до 2. для верификации образцов тканей проводилось стандартное патолого-морфологическое исследование с окрашиванием фиксированных срезов гематоксилин-эозином. Биоптаты тканей классифицировали на две группы: опухолевые (малигнизированные) и контрольные (немалигнизированные) образцы.
Геномную ДНК экстрагировали из свежезамороженных операционных биоптатов тканей желудка с использованием лизирующего SDS-содержащего буфера в присутствии протеиназы-К и последующей фенол-хлороформной экстракцией [2]. Концентрацию полученных препаратов ДНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant-iT™ dsDNA High-Sensitivity (HS) Assay Kit (Invitrogen, США). для проведения Real-Time qPCR концентрацию образцов ДНК нормализовывали до величины 2 нг/мкл.
Определение относительной копийности генетических локусов методом Real-Time qPCR, заключается в одновременной амплификации гена-мишени и референтного гена в опытной и контрольной пробах [10]. Вывод об изменении дозы гена делается на основании соотношения сигналов, продуцируемых амплификатами изучаемой и референсной последовательностей. Прямые и обратные праймеры были разработаны с использованием референтных последовательностей ДНК NCBI GenBank (таблица). Каждые 25 мкл ПЦР-смеси содержали 10 нг геномной ДНК, 0.2mM dNTP’s, по 100 нМ прямого и обратного праймеров для референтного гена (RNaseP) или гена-мишени, 2.5 mM MgCl2, ПЦР-буфер, 0.05u/µl ДНК-полимераза Thermus aquaticus («Синтол», Россия), краситель SYBR®Green I (Invitrogen, США). Амплификация каждой пробы осуществлялась в трех повторениях.
Количественная RT–PCR амплификация проводилась с использованием термоциклера Bio-Rad CFX96 (Bio-Rad, USA) в соответствии с инструкциями производителя по следующей программе: 95°C 3 мин., и 40 циклов при 95°C 10 сек, 58°C 30 секунд (чтение оптического сигнала красителя FAM для красителя SYBR-Green) и 72°C 15 секунд. Первичные данные RT–qPCR получали с использованием программного обеспечения Bio-Rad CFX Manager (ver. 2.1). Генетический локус B2M использовали в качестве референтного для нормализации полученных показателей количественной RT–qPCR.
Панель праймеров для определения относительной копийности генов
|
№ |
Наименование |
№№ NCBI GenBank |
Хромосомная локализация |
|
1 |
HV2_Hum34 |
NC_012920.1 |
mitochondrion |
|
2 |
B2M |
NM_004048.2 |
15q21-q22.2 |
|
3 |
GSTP1 |
NM_000852.3 |
11q13 |
|
4 |
NFKB1 |
NM_003998.3 |
4q24 |
Усредненные данные по каждому генетическому локусу нормировались по усредненному показателю референтного гена B2M для получения величины ΔCt (ΔCt=Ct(исследуемого гена) – Ct(B2M)). Относительную копийность генетического локуса (RQ) рассчитывали по формуле 2-ΔCt. Далее вычисляли медиану RQоп опухолевых образцов и медиану RQк контрольных для каждого генетического локуса и рассчитывали соотношение относительной копийности генов в опухолевой ткани по отношению к нормальной ткани: RQоп / RQк.
Результаты исследования и их обсуждение
Хотя гистологическая классификация рака желудка в определённой степени условна, особенно с учётом частой встречаемости смешанных форм рака, она, безусловно, отражает многообразие молекулярного патогенеза данного заболевания. Полученные нами данные также свидетельствуют о том, что изменение относительной копийности гена GSTP1 в опухолях разных гистологических типов желудка происходит неодинаково (рисунок).
При аденокарциномах желудка разной стадии дифференцировки (G1-3) относительная копийность гена Gstp1 достоверно не изменяется по сравнению с условно здоровой тканью. Однако имеется незначительная тенденция к снижению копийности на 15 и 16 % соответственно в опухолевых тканях пациентов с аденокарциномой G3 и аденокарциномой G1-2 по сравнению с условно здоровой тканью. Таким образом, у пациентов с аденокарциномой G3 и аденокарциномой G1-2 копийность Gstp1 находится на одном уровне.
У пациентов с перстневидноклеточным и смешанным раком (аденокарцинома G3 + перстневидноклеточный рак) обнаружено достоверное увеличение относительной копийности Gstp1 на 21 % и 18 % (p<0,01) соответственно. Можно предложить, что такое изменение копийности данного гена присуще исключительно перстневидноклеточному раку желудка, и потому может служить биомаркером перстневидноклеточного рака или присутствия перстневидноклеточного компонента в аденокарциноме.
В ходе нашего исследования обнаружено достоверное снижение копийности гена транскрипционного фактора NFKB1 у пациентов с аденокарциномой G3 и перстневидноклеточным раком желудка на 18 % и 4 % соответственно (p<0.05). При этом наблюдается тенденция к повышению копийности этого гена у пациентов со смешанным типом рака на 18 % и тенденция к снижению копийности на 26 % у пациентов с аденокарциномой желудка G1-2.
Корреляционный анализ изменения относительной копийности генов GSTP1 и NFKB1 у пациентов с разными гистологическими типами рака желудка показал наличие положительной корреляционной связи между этими изменениями (r=0,837), таким образом, характер изменения копийности этих генов имеет схожие направленность и модальность при рассмотренных гистологических типах рака желудка, за исключением перстневидноклеточного рака.
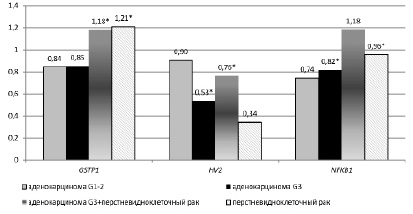
Изменение копийности гена GSTP1, NFKB1 и HV2 при разных гистологических типах рака (* – достоверные отличия, p<0.05)
NF-kB белки играют центральную роль в клеточном ответе на повреждение ДНК. Было показано, что P50/NF-κB1 необходим для цитотоксичности в ответ на повреждение ДНК. Анализ злокачественных опухолей человека, показал, что экспрессия мРНК NFKB1 подавляется в гематологических опухолях по сравнению с контрольными образцами. Эти данные свидетельствуют о том, что NFKB1 является специфическим супрессором опухолей и предотвращает развитие гематологических злокачественных опухолей в условиях алкилирующего повреждения ДНК [9]. Согласно данным литературы, GSTP1 может иметь решающее значение в регуляции активации нескольких каскадов стресс-киназ, включая и IKK-NFКB сигнальный путь [9]. Вероятно, этим можно объяснить обнаруженную нами связь между изменениями относительной копийности генов GSTP1 и NFKB1.
Также нами показано достоверное снижение относительной копийности гипервариабельного участка 2 (HV2) митохондриальной ДНК у пациентов с аденокарциномой желудка стадии G3 и у пациентов со смешанным типом рака (аденокарцинома G3 + перстневидноклеточный рак) на 47 % и 24 % соответственно (p<0.05). У пациентов с аденокарциномой G1-2 и с перстневидноклеточным раком наблюдалась лишь тенденция к снижению копийности HV2 на 10 % и 66 % соответственно. Корреляционный анализ изменений относительной копийности HV2 и гена GSTP1 у пациентов с разными гистологическими типами рака желудка показал наличие слабой отрицательной корреляционной связи между этими изменениями (r=-0,437), таким образом, характер изменения копийности этих генетических локусов носит разнонаправленный характер.
Обнаруженное снижение относительной копийности HV2 у пациентов с аденокарциномой стадии G3 и у пациентов со смешанным типом рака находит подтверждение в данных литературы [7]. Изучение мутаций в контрольной области мтДНК в опухолях желудка показало, что 48 % опухолей имеют опухолеспецифические мутации мтДНК [7]. Эти изменения митохондриальных генов, характерные для раковых клеток, инактивируют энергетический метаболизм митохондрий (окислительное фосфорилирование), и изменяют состояние биоэнергетики, переводя клетки в режим преимущественного использования гликолиза (анаэробный режим) для энергетических и анаболических целей, что объясняет так называемый эффект Варбурга [7]. Количество копий мтДНК в клетке может служить индикатором интенсивности процессов окислительного фосфорилирования в силу своей пластичности. Полученные нами данные хорошо подтверждают факт угнетения процессов окислительного фосфорилирования в малигнизированных тканях желудка, оцениваемое по уменьшению относительной копийности митохондриальной ДНК (локус HV2). Наиболее выражены процессы уменьшения относительной копийности мтДНК (угнетения окислительного фосфорилирования) в тканях опухолей с аденокарциномой G3 и перстневидноклеточным раком желудка.
Выводы
Таким образом, анализ наших данных показал возможность использования гена GSTP1 в качестве биомаркера перстневидноклеточного рака или присутствия перстневидноклеточного компонента в аденокарциноме желудка, а также наличие корреляционных связей в изменениях относительной копийности генов GSTP1, NFKB1 и гипервариабельного участка 2 (HV2) митохондриальной ДНК.



