Хронический остеомиелит остается одной из сложных и актуальных проблем гнойной хирургии [4]. В успешном лечении остеомиелита наряду с традиционными хирургическими методами немаловажную роль играет своевременная микробиологическая диагностика, позволяющая выявить возбудителя инфекции. Наиболее частыми возбудителями хронического остеомиелита являются грамположительные кокки рода Staphylococcus spp. с преобладанием штаммов S. aureus, и грамотрицательные микроорганизмы: Escherichia coli, Enterobacter cloacae, Pseudomonas aeruginosa и др. [5, 6]. В последние годы наблюдается тенденция к повышению удельного веса ассоциаций микроорганизмов, вызывающих инфекционный процесс при остеомиелите. Совместное развитие микроорганизмов в микс-популяции может приводить к усилению патогенного потенциала, ассоциированного с персистентными свойствами бактерий [2]. Комплекс биологических свойств бактерий-ассоциантов определяет их способность к образованию биопленки, в составе которой микроорганизмы намного устойчивее к антимикробным препаратам и факторам иммунной защиты макроорганизма [7, 9]. Изучение этиологической роли микробных сообществ, их биопленкообразующей способности имеет большое практическое значение для оценки эффективности проводимой антибиотикотерапии, поиска новых путей диагностики и подавления роста биопленок.
Цель исследования. Изучить адгезивный потенциал клинически значимых штаммов микроорганизмов, выделенных у больных хроническим посттравматическим остеомиелитом, и оценить биопленкообразующую способность монокультур микроорганизмов и их ассоциаций, полученных in vitro.
Материалы и методы исследования
Исследованы 93 клинических штаммов бактерий, принадлежащих к 6 таксонам (Staphylococcus aureus – 30, Staphylococcus epidermidis – 18 Enterococcus sp. – 18, Pseudomonas aeruginosa – 11, Klebsiella pneumonia. – 10, Serratia marcescens – 6), выделенных из свищей в дооперационном периоде и из очага воспаления во время операции у 64 пациентов с хроническим остеомиелитом длинных трубчатых костей. Изучена биопленкообразующая способность монокультур и их ассоциаций, полученных in vitro (S. aureus + P. aeruginosa – 6; S. aureus + Kl. pneumonia – 5; S. aureus +S. marcescens – 6; S. aureus + S. epidermidis – 2; S. aureus+ Enterococcus sp. – 2).
Выделение и идентификацию исследуемых штаммов проводили общепринятыми методами [1].
Адгезивную активность штаммов изучали на модели эритроцитов человека А (ІI) Rh+ по методике В.И. Брилиса [1]. При оценке адгезивных свойств использовали индекс адгезивности микроорганизмов (ИАМ). Исследование проводили под световым микроскопом, учитывая в общей сложности не менее 50 эритроцитов. Микроорганизмы считали неадгезивными при ИАМ – до 1,75; низкоадгезивными – от 1,76 до 2,5; среднеадгезивными – от 2,51 до 4,0; высокоадгезивными – ≥4,1.
Способность к образованию биопленки клиническими штаммами на поверхности 96-луночных полистироловых планшетов проводили по методу G.OʼToole и R. Kolter [8]. По уровню адсорбции красителя этанолом, измеренному в единицах оптической плотности (OD630) на фотометре ELx808 (BioTek, США) при длине волны 630 нм оценивали активность формирования биопленки. Для интерпретации полученных данных определяли способность штаммами формировать биопленки в соответствии с критериями, разработанными Stepanovic S. et al. [10]: при значениях OD630 ниже 0,090 – считали, что штаммы не обладали способностью к образованию биопленки; при 0,090<OD630≤0,180 – штаммы обладали слабой; при 0,180<OD630≤0,360 – средней; при OD630˃0,360 – высокой способностью к образованию биопленки. Ассоциации микроорганизмов in vitro получали путем смешивания суточных культур штаммов в соотношении 1:1 в лунках планшетов.
Статистическую обработку результатов проводили с помощью программного обеспечения анализа данных AtteStat, версия 13.0 [3]. Значимость различий между группами проверяли с помощью непараметрических критериев Вилкоксона и Манна-Уитни. Различия между группами наблюдений считали статистически значимыми при Р< 0,05.
Результаты исследования и их обсуждение
Проведенное исследование показало, что распределение по степени адгезивности неодинаково для рассматриваемых групп микроорганизмов. Так, в группе грамположительных бактерий ИАМ изменялся от 1,92 ± 0,18 ед. у штаммов Enterococcus sp. до 2,20 ± 0,12 ед. у штаммов S. aureus. Среднеадгезивными свойствами обладали 23 % штаммов грамположительных микроорганизмов. Высокоадгезивных штаммов выявлено не было.
Все штаммы грамотрицательных микроорганизмов обладали адгезивной способностью. Большую часть грамотрицательных бактерий составили среднеадгезивные штаммы (70 % штаммов Kl. pneumonia, 46 % штаммов Ps. aeruginosa, 50 % штаммов S. marcescens). ИАМ изменялся от 2,74 ± 0,19 ед. у штаммов Ps. aeruginosa до 3,45 ± 0,24 ед. у штаммов Kl. pneumonia. В группе грамотрицательных микроорганизмов 20 % штаммов Kl. pneumonia, 18 % штаммов P. aeruginosa, 33 % штаммов S. marcescens обладали высокоадгезивными свойствами (таблица).
По данным фотометрического анализа наиболее активно биопленку на поверхности 96-луночного полистиролового планшета формировали грамотрицательные микроорганизмы, о чем свидетельствуют средние значения OD630 (рисунок).
Штаммы грамположительных микроорганизмов характеризовались низкой биопленкообразующей способностью, что согласуется с данными их адгезивной активности.
Адгезивная способность клинически значимых штаммов бактерий, выделенных у больных хроническим посттравматическим остеомиелитом
|
Штаммы |
НеАШ, % |
НАШ, % |
САШ, % |
ВАШ, % |
ИАМ, ед. |
|
S. aureus (n=30) |
19 |
52 |
29 |
- |
2,20 ±0,12 |
|
S. epidermidis (n= 18) |
24 |
52 |
24 |
- |
1,97±0,23 |
|
Enterococcus sp. (n=18) |
28 |
56 |
17 |
- |
1,92±0,18 |
|
Kl. pneumonia (n=10) |
- |
10 |
70 |
20 |
3,45±0,24 |
|
P. aeruginosa (n=11) |
- |
36 |
46 |
18 |
2,74±0,19 |
|
S. marcescens (n=6 ) |
- |
17 |
50 |
33 |
3,45±0,28 |
Примечание. НеАШ – не адгезивные штаммы; НАШ – низкоадгезивные штаммы; СШ – среднеадгезивные штаммы; ВАШ – высокоадгезивные штаммы; ИАМ – индекс адгезивности микроорганизмов.
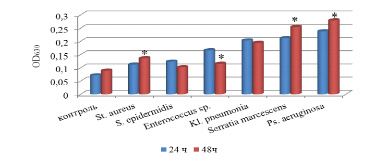
Рис. 1. Биопленкообразующая способность клинически значимых штаммов микроорганизмов, выделенных у больных хроническим посттравматическим остеомиелитом. Примечание. * – уровень значимости различий по сравнению с 24 ч (р˂0,05)
Через 48 ч наблюдали активный рост биопленок, образованных штаммами S. aureus, P. aeruginosa, S. marcescens по сравнению со значениями, полученными через 24 ч.
Биопленкообразующая способность штаммов Enterococcus sp. через 48 ч. была в 1,4 раза ниже суточных результатов.
Ассоциации микроорганизмов S. aureus + P. aeruginosa и S. aureus + S. marcescens обладали средней биопленкообразующей способностью, S. aureus + Kl. pneumonia – слабым биопленкообразованием. Микс – культуры грамположительных микроорганизмов (S. aureus + S. epidermidis, S. aureus + Enterococcus sp.) не формировали биопленки на поверхности 96-и луночных планшетах (рис. 2).
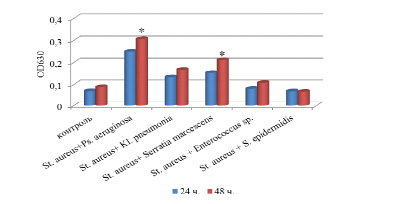
Рис. 2. Биопленкообразующая способность микс – культур микроорганизмов полученных in vitro через 24ч /48 ч. Примечание. * – уровень значимости различий по сравнению с 24 ч. (р˂0,05)
Уровень биопленкообразования микс-культур микроорганизмов через 48 ч. эксперимента был выше по сравнению с результатами на первые сутки, однако значения оптической плотности, в большинстве случаев, не превышали уровни биопленкообразования монокультур исследуемых штаммов. Биопленкообразующая способность ассоциаций микроорганизмов S. aureus + P. aeruginosa через 48 ч. была в 1,2 раза выше по сравнению с уровнем биопленкообразования монокультур штаммов P. aeruginosa. Рост биопленок, образованных ассоциациями микроорганизмов: S. aureus + Kl. pneumonia, S. aureus + S. marcescens был незначительным по сравнению с биопленкообразующей способностью монокультур штаммов Kl. pneumonia, S. marcescens соответственно.
Высокая биопленкообразующая способность ассоциации микроорганизмов: S. aureus + P. aeruginosa по сравнению с чистыми культурами исследуемых штаммов объясняется взаимоотношениями, характер которых зависит от физиологических особенностей и потребностей совместно развивающихся микробов [10].
Заключение
Таким образом, у больных с хроническим остеомиелитом среди грамотрицательных микроорганизмов чаще встречаются средне- и высокоадгезивные штаммы, а в группе грамположительных микроорганизмов – низкоадгезивные штаммы. Штаммы P. aeruginosa, Kl. pneumonia, S. marcescens активнее формируют биопленку на поверхности 96-и луночных планшетах в отличие от штаммов S. aureus, S. epidermidis, Enterococcus sp., что согласуется с данными адгезивной активности исследуемых культур. Проведенное исследование показало, что межмикробные взаимоотношения в ассоциациях микроорганизмов в зависимости от индивидуальных свойств каждого ассоцианта могут быть направлены как на стимуляцию роста биопленки, так и на его ослабление. Со временем свойства образующих ассоциации штаммов могут изменяться, соответственно, будет изменяться и способность микс-культуры к образованию биопленки.
[1] Выполнено м.н.с. Л.В. Розовой и Н.В. Годовых.



