В настоящее время в связи с интенсивным развитием фармацевтической индустрии разработка новых форм лекарственных средств приобретает огромное значение. Мировые тренды использования лекарственных средств показывают постепенно происходящую замену устаревших препаратов на более эффективные и безопасные лекарственные средства новых поколений. Фарминдустрия сегодня и в будущем большие перспективы связывает с капсулированием лекарственных средств эффективными рецепторами, которые позволяют получать твёрдые лекарственные формы из жидких, способствуют стабилизации активных веществ к действию света и тепла, увеличивают растворимость препарата, улучшают его биодоступность, маскируют нежелательные запахи и вкус [6]. Капсулирование фармпрепаратов позволяет получать лекарства пролонгированного, программированного и трансдермального воздействия и увеличивает возможность целенаправленного транспорта лекарства в организме непосредственно к месту его воздействия. В этой связи получение супрамолекулярных нанокапсулированных форм фармацевтически активного цитафата (О,О-диметил-N-цитизинилфосфат) с β-циклодекстрином (β-ЦД) и установление их структуры является актуальной задачей современной химии и медицины.
Цель исследования
ЯМР-спектроскопическое изучение супрамолекулярного нанокомплекса цитафата с β-циклодекстрином.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С цитафата, β-ЦД и их супрамолекулярного комплекса снимали в ДМСО-d6 на спектрометре JNN-ECA 400 (400 и 100 МГц на ядрах 1Н и 13С) компании «Jeol» производства Японии. Химические сдвиги измерены относительно сигналов остаточных протонов или атомов углерода дейтерированного диметилсульфоксида.
Результаты исследования и их обсуждение
Одним из основных методов исследования супрамолекулярных комплексов включения в настоящее время является спектроскопия ЯМР [2, 3]. Данный метод был использован нами для изучения лекарственной формы фармацевтически активного цитафата с β-ЦД (рис. 1).
Среди известных в настоящее время для фармпрепаратов капсулирующих рецепторов β-ЦД (рис. 2) [5] отличается рядом замечательных свойств, обусловленных его структурой. β-ЦД является циклическим олигосахаридом, состоящий из семи звеньев D-глюкопиранозы. Молекула β-ЦД имеет форму усечённого конуса, во внутренней гидрофобной связывающей поверхности которого размещены протоны Н-3 и Н-5, а на внешней – Н-2 и Н-4. Важнейшей чертой β-ЦД является способность его к гидрофобному связыванию молекулы гостя в своей полости в водной среде.
Исследование методом спектроскопии ЯМР супрамолекулярных нанокомплексов включения цитафата с β-ЦД основано на определение разницы в значениях химических сдвигов 1Н и 13С субстратов и рецептора в свободном состоянии и в составе комплексов в результате межмолекулярного взаимодействия. По величине химсдвигов внутренних или внешних протонов β-ЦД можно выявить образование соответственно внутренних или внешних комплексов. Изменение химических сдвигов 1Н и 13С в спектрах субстрата позволяет определить направление вхождения последнего в полость β-ЦД [1, 4].
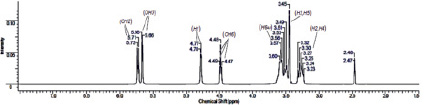
Как было отмечено ранее, изучение протонных спектров объектов исследования позволит выявить разницу в значениях химических сдвигов ядер 1Н, и тем самым сделать выводы о существовании комплекса и взаимодействующих атомах его составных частей. Для ПМР спектра β-ЦД (рис. 3, а) характерно проявление шести групп сигналов в области 3,23–3,32; 3,45–3,60; 4,47–4,49; 4,77–4,78; 5,66; 5,71–5,73 м.д. Наиболее низкопольный дублетный сигнал в диапазоне 5,71–5,73 м.д. с расщеплением 4 Гц принадлежит протону гидроксильной группы при атоме С-2. Также в области слабого поля резонирует протон ОН-группы соседнего атома (ОН-3), находящийся во внутренней полости молекулы β-ЦД (δ = 5,66 м.д., дублет). Дублетный сигнал в области 4,77–4,78 м.д. соответствует протону Н-1. Расположение указанного протона в более слабом поле по сравнению с протонами других СН-групп обусловлено влиянием со стороны атома кислорода. Гидроксильная группа ОН-6 резонирует, расщепляясь на триплет с центром 4,48 м.д. В области сильного поля (3,49–3,60 м.д.) наблюдается накопление сигналов Н-6 а, b метиленовой группы. Высокоинтенсивный сигнал при 3,45 м.д. соответствует протонам Н-3 и Н-5 гдюкопиранозного звена. В диапазоне от 3,23 до 3,32 м.д. проявляются метиновые протоны Н-2 и Н-4.
По результатам химические сдвиги ядер 1Н и 13С ЯМР-спектров цитафата и β-ЦД вне комплекса и в его составе (таблица) можно отметить, что все протоны глюкопиранозного звена β-ЦД в составе комплекса смещаются в сторону более слабого поля по сравнению с аналогичными протонами индивидуального комплексообразователя. Следует отметить, что наибольшая разница в значениях химического сдвига (∆δ(1Н) = 0,13–0,15 м.д.) свойственна протонам внутренней полости торообразной молекулы Н-3 и Н-5 вследствие взаимодействия указанных протонов с полярным лигандом и образованием внутреннего нанокомплекса.
Химические сдвиги (м.д.) ядер 1Н и 13С ЯМР-спектров цитафата и β-ЦД вне комплекса и в его составе


Рис. 1. Структурная формула цитафата

Рис. 2. Структурная формула β-ЦД
|
№ |
Группа |
В свободном состоянии (δ0) |
В составе комплекса (δ) |
∆δ(δ–δ0) |
|||
|
СНх |
δ(1Н) |
δ(13С) |
δ(1Н) |
δ(13С) |
∆δ(1Н) |
∆δ(13С) |
|
|
цитафат |
|||||||
|
2 |
>С=О |
– |
162,75 |
– |
162,80 |
– |
0,05 |
|
3 |
=СН- |
6,19 |
116,19 |
6,20 |
116,18 |
0,01 |
– 0,01 |
|
4 |
=СН- |
7,31 |
139,44 |
7,32 |
139,52 |
0,01 |
0,08 |
|
5 |
=СН- |
6,12 |
104,94 |
6,13 |
105,07 |
0,01 |
0,13 |
|
6 |
>С= |
– |
151,17 |
– |
151,17 |
– |
0 |
|
7 |
>СН- |
2,96 |
34,09 |
2,93 |
34,00 |
– 0,03 |
– 0,09 |
|
8 |
-СН2- |
1,84 |
25,16 |
1,84 |
25,14 |
0 |
– 0,02 |
|
9 |
>СН- |
2,34 |
26,83 |
2,34 |
26,79 |
0 |
– 0,04 |
|
10 |
-СН2- |
3,70 |
49,46 |
3,70 |
49,48 |
0 |
0,02 |
|
11 |
-СН2- |
3,01 |
51,03 |
3,02 |
51,02 |
0,01 |
0,01 |
|
13 |
-СН2- |
2,99 |
52,16 |
2,99 |
52,15 |
0 |
– 0,01 |
|
14 |
О-СН3 |
3,29 |
52,71 |
3,28 |
52,75 |
– 0,01 |
0,04 |
|
15 |
О-СН3 |
3,17 |
52,54 |
3,16 |
52,57 |
– 0,01 |
0,03 |
|
β-циклодекстрин |
|||||||
|
1 |
>СН- |
4,77 |
102,43 |
4,79 |
102,49 |
0,02 |
0,06 |
|
2 |
>СН- |
3,27 |
72,87 |
3,28 |
72,97 |
0,01 |
0,10 |
|
3 |
>СН- |
3,45 |
73,54 |
3,60 |
73,60 |
0,15 |
0,06 |
|
4 |
>СН- |
3,30 |
82,00 |
3,34 |
82,11 |
0,04 |
0,11 |
|
5 |
>СН- |
3,45 |
72,52 |
3,58 |
72,59 |
0,13 |
0,07 |
|
6 |
-СН2- |
3,57 |
60,40 |
3,62 |
60,50 |
0,05 |
0,10 |
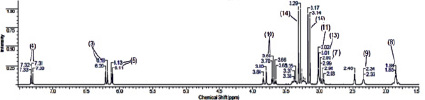
В области слабого поля ПМР спектра цитафата (рис. 3, б) отмечено проявление сигналов метиновых групп α-пиридинового ядра: δ(Н-5) = 6,11–6,13 м.д., дублет; δ(Н-3) = 6,18–6,20 м.д., дублет; δ(Н-4) = 7,30–7,33 м.д., триплет. Ввиду несимметричности протонов при атоме С-10, наблюдаются сигналы аксиального и экваториального атомов в области 3,63–3,84 м.д., причем сигнал На смещен в более сильное поле. Высокоинтенсивные сигналы при 3,14–3,29 м.д. являются следствием резонирования неэквивалентных протонов метокси-групп у атома фосфора. Четыре протона метиленовых групп, связанных с NH-группой, и метиновая группа при атоме С-7 дают сигналы в диапазоне от 2,93 до 3,02 м.д., расщепляясь под влиянием соседних атомов на триплеты и мультиплет соответственно. Сигналы сильнопольной части спектра (δ = 1,84 м.д., δ = 2,34 м.д.) соответствуют протонам Н-8 и Н-9.
Анализ спектров DEPT и 13С (таблица), а также двумерных спектров COSY (1Н-1Н) и HMQC (1Н-13С) (рис. 4) подтвердил наличие корреляций, свойственных структуре молекулы цитафата.
а)
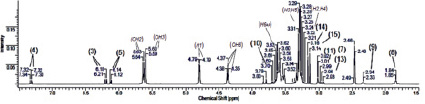
б)
в)
Рис. 3. ЯМР 1Н спектры β-ЦД (а), цитафата (б) и их комплекса включения (в)
а) б)
Рис. 4. Корреляции COSY (а) и HMQC (б) в молекуле цитафата
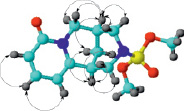
По данным таблицы видно, что происходит смещение сигналов Н-3, Н-4, Н-5 и Н-7 молекулы субстрата при комплексообразовании в результате взаимовлияния протонов β-ЦД. Аналогичная картина наблюдается и для атомов углерода β-пиридонового кольца. Учитывая эти результаты ЯМР-исследования, а также данные о размерах молекул цитафата и β-ЦД (рис. 1, 2), можно предположить о вхождении субстрата в полость рецептора a-пиридоновым фрагментом молекулы с образованием инклюзионного комплекса состава 1:1 (рис. 5).
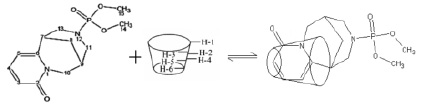
Рис. 5. Схематическое представление комплексообразования цитафата с β-ЦД
Выводы
Изучены и подробно интерпретированы одномерные (1Н и 13С) и двумерные (COSY, HMQC) спектры ЯМР цитафата (О,О-диметил-N-цитизинилфосфат), β-циклодекстрина и их супрамолекулярных комплексов. По изменениям значений химических сдвигов ядер 1Н и 13С цитафата и β-циклодекстрина установлено вхождение субстрата в полость рецептора a-пиридоновым фрагментом молекулы с образованием инклюзионного комплекса состава 1:1.



