Комбинации незаменимых и заменимых аминокислот используются в медицине и фармации в виде растворов для парентерального питания. Основным требованием, предъявляемым к современным растворам аминокислот, является обязательное содержание восьми незаменимых аминокислот (валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин), шести аминокислот, синтезируемых в организме из углеводов (аланин, глицин, серин, пролин, глутаминовая и аспарагиновая кислоты) и 4-х аминокислот, которые синтезируются в организме в незначительном количестве (аргинин, гистидин, тирозин, цистеин). При этом осмолярность раствора для парентерального питания должна соответствовать уровню осмолярности плазмы. В связи с этим целью данного исследования стало изучение взаимного влияния низкомолекулярных аминокислот на примере глицина и β-аланина на коллигативные свойства и показатель преломления водных растворов.
Материалы и методы исследования
В качестве объекта исследования использовали водные растворы аминокислот глицина и β-аланина. Определение температуры замерзания проводили на автоматическом криоскопическом осмометре ОМТ-5-02. Предварительно прибор калибровали с помощью серии растворов рабочих стандартных образцов натрия хлорида. Испытуемые растворы лецитина соевого различной концентрации помещали в кювету прибора, погружали в термостат с контролируемой температурой и замораживали. Осмолярность раствора автоматически определяется по фиксированной температуре замерзания.
Определение показателя преломления растворов аминокислот проводили на рефрактометре ИРФ 454Б2М.
Результаты исследования и их обсуждение
Аминокислоты с низкой молекулярной массой, такие как глицин и β-аланин, хорошо растворимы в воде, и коллигативные свойства растворов аминокислот в соответствии с теорией определяются общим количеством частиц в растворе. К коллигативным свойствам, т.е. к свойствам, зависящим от общего числа частиц в растворе, относятся понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем и осмотическое давление растворов [6].
Криоскопический метод – метод замораживания – дает возможность оценить изменение температуры замерзания раствора по сравнению с чистым растворителем и эффективную осмотическую концентрацию растворенного вещества, а также рассчитать осмотическое давление раствора. Это позволяет охарактеризовать свойства растворов веществ с точки зрения их совместного присутствия, что крайне важно для растворов, применяемых для парентерального введения в медицине [1–3]. Как показано на рис. 1, увеличение концентрации глицина или β-аланина в растворе до 10 % приводит к линейному понижению температуры замерзания раствора. Уравнения линейной аппроксимации имеют вид: Δtзам = (–1,15 ± 0,02)∙CАЛА для β-аланина и Δtзам = (–1,03 ± 0,01)∙CГЛИ для глицина с коэффициентами корреляции –0,998. Свободные члены уравнений линейной регрессии близки к нулю, поскольку по результатам статистической обработки абсолютные значения указанных параметров малы, и ошибки их определения сопоставимы с величинами коэффициентов.
Молекулы аминокислот, исходя из их строения, могут проявлять свойства как кислот, так и оснований [4]. Проявление кислотных свойств обусловлено наличием карбоксильной группы, при диссоциации которой в раствор выделяются протоны. Проявление основных свойств обусловлено наличием аминогруппы, при протонировании которой в растворе появляются гидроксид-ионы:
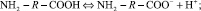
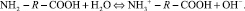
Возможен перескок протона от карбоксильной группы к аминогруппе и появление цвиттер-иона в соответствии с уравнением
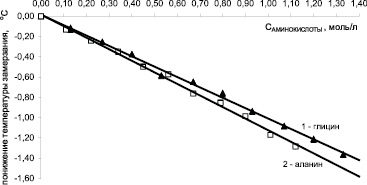
Рис. 1. Понижение температуры замерзания водных растворов глицина и β-аланина
Сила молекул аминокислот как кислот и как оснований характеризуется константами диссоциации. Для глицина: Kа = 1,3∙10–10; Kв = 2,26∙10–12. Для β-аланина: Kа = 5,79∙10–11; Kв = 3,56∙10–11. Значения констант диссоциации очень малы, поэтому можно допустить, что диссоциация карбоксильной группы и/или протонирование аминогруппы в водных растворах протекает крайне незначительно. Реакция образования цвиттер-иона не сопровождается увеличением числа частиц. Если изменения общего числа частиц в растворе не происходит, эффективная осмотическая концентрация частиц, выраженная в единицах молярности (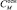 ), должна совпасть с аналитической (рассчитанной) молярной концентрацией аминокислот (CАМИНОК-ТЫ). Как показывают расчеты с использованием критерия Фишера, гипотеза о том, что величины
), должна совпасть с аналитической (рассчитанной) молярной концентрацией аминокислот (CАМИНОК-ТЫ). Как показывают расчеты с использованием критерия Фишера, гипотеза о том, что величины 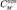 и CАМИНОК-ТЫ значимо не отличаются друг от друга на всем изученном диапазоне концентраций, может быть принята на уровне значимости 0,005 [5]. Значит, увеличения числа частиц в растворе не произошло, и в дальнейшем не нужно учитывать процессы, изменяющие число частиц (диссоциацию, протонирование или образование ионных ассоциатов).
и CАМИНОК-ТЫ значимо не отличаются друг от друга на всем изученном диапазоне концентраций, может быть принята на уровне значимости 0,005 [5]. Значит, увеличения числа частиц в растворе не произошло, и в дальнейшем не нужно учитывать процессы, изменяющие число частиц (диссоциацию, протонирование или образование ионных ассоциатов).
В общем случае осмотическое давление линейно зависит от аналитической концентрации аминокислот в растворе в соответствии с законом Вант – Гоффа: 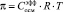 (рис. 2). β-аланин является осмотически более активным, чем глицин. 1 моль/л β-аланина увеличивает осмотическое давление раствора примерно на 3100 Па, тогда как для глицина этот показатель составляет величину порядка 2750.
(рис. 2). β-аланин является осмотически более активным, чем глицин. 1 моль/л β-аланина увеличивает осмотическое давление раствора примерно на 3100 Па, тогда как для глицина этот показатель составляет величину порядка 2750.
Результаты рефрактометрии водных растворов глицина и β-аланина представлены на рис. 3. Присутствие низкомолекулярных аминокислот линейного строения в растворе приводит к линейному увеличению показателя преломления раствора с ростом концентрации аминокислоты. Уравнения регрессии имеют вид n = 1,3330 + 0,0170∙CАЛА – для β-аланина и n = 1,3331 + 0,0155∙CГЛИ – для глицина с коэффициентами корреляции 0,998. Влияние β-аланина на показатель преломления раствора сильнее, чем глицина, т.е. β-аланин рефрактометрически более активен по сравнению с глицином.
Чтобы оценить влияние добавок одной аминокислоты на коллигативные и рефрактометрические свойства другой, были проанализированы понижение температуры замерзания, осмотическое давление и показатель преломления растворов глицина в присутствии фоновых добавок β-аланина (1, 3, 5 %) и эти же параметры растворов β-аланина в присутствии фоновых добавок глицина (1, 3, 5 %). Исходя из понятия коллигативных свойств растворов, добавление одной аминокислоты к раствору другой аминокислоты должно привести к сдвигу линии температур замерзания вниз, линии осмотического давления вверх. Причем величина сдвига и тангенс угла наклона линий должны определенным образом соотноситься с величиной добавки и природой добавленной аминокислоты. Экспериментальные данные, иллюстрирующие коллигативные свойства водных растворов β-аланина с добавками глицина и водных растворов глицина с добавками β-аланина, представлены в табл. 1 и 2.
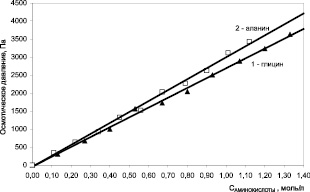
Рис. 2. Зависимость осмотического давления водного раствора от концентрации глицина и β-аланина
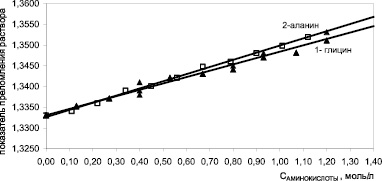
Рис. 3. Зависимость показателя преломления водного раствора от концентрации глицина и β-аланина
Таблица 1
Уравнения регрессии концентрационных зависимостей свойств водных растворов β-аланина с добавками глицина
|
Изучаемый объект |
Уравнение регрессии вида Y = a + b∙X для изменения температуры замерзания, осмотического давления и показателя преломления от концентрации аланина |
Коэффициент корреляции R |
Ошибки определения коэффициентов a и b |
|
Водные растворы аланина |
Δtзам = 0,03 – 1,15∙CАЛА |
–0,998 |
Δa = 0,01; Δb = 0,02 |
|
π = –70 + 3050∙CАЛА |
0,998 |
Δa = 50; Δb = 70 |
|
|
n = 1,3330 + 0,0170∙CАЛА |
0,998 |
Δa = 0,0001; Δb = 0,0002 |
|
|
Водные растворы аланина с фоном 1 % глицина |
Δtзам = –0,09 – 1,19∙CАЛА |
–0,998 |
Δa = 0,01; Δb = 0,02 |
|
π = 200 + 3200∙CАЛА |
0,998 |
Δa = 50; Δb = 80 |
|
|
n = 1,3349 + 0,0161∙CАЛА |
0,997 |
Δa = 0,0001; Δb = 0,0002 |
|
|
Водные растворы аланина с фоном 3 % глицина |
Δtзам = –0,37 – 1,20∙CАЛА |
–0,998 |
Δa = 0,01; Δb = 0,02 |
|
π = 950 + 3300∙CАЛА |
0,998 |
Δa = 50; Δb = 100 |
|
|
n = 1,3374 + 0,0175∙CАЛА |
0,997 |
Δa = 0,0001; Δb = 0,0003 |
|
|
Водные растворы аланина фоном 5 % глицина |
Δtзам = –0,70 – 1,23∙CАЛА |
–0,998 |
Δa = 0,01; Δb = 0,02 |
|
π = 1850 + 3100∙CАЛА |
0,998 |
Δa = 50; Δb = 120 |
|
|
n = 1,3430 + 0,0160∙CАЛА |
0,998 |
Δa = 0,0001; Δb = 0,0002 |
По полученным данным можно сформулировать следующие закономерности. Для смесей низкомолекулярных аминокислот в водном растворе соблюдается линейность концентрационных зависимостей коллигативных свойств и показателя преломления с коэффициентами корреляции не ниже 0,998 и 0,997 соответственно. Сопоставимые величины абсолютной ошибки определения свободного члена в уравнениях регрессии со значением свободного члена свидетельствуют о близости данного коэффициента к нулю.
Статистически с использованием критерия Фишера доказано, что величина смещения характеристик коллигативных свойств и показателя преломления по оси ординат и изменение тангенса угла наклона прямых для серии растворов β-аланина с добавками глицина незначимо отличается от аналогичных характеристик для серии растворов глицина с добавками β-аланина. Гипотеза об однородности результатов измерений может быть принята по критерию Фишера на уровне значимости критерия 0,05 (рассчитанные значения критерия Фишера составляют 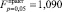 – для сдвига линии по оси температур;
– для сдвига линии по оси температур; 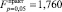 – для тангенса угла наклона линии к оси температур;
– для тангенса угла наклона линии к оси температур; 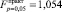 – для сдвига линии по оси осмотического давления;
– для сдвига линии по оси осмотического давления; 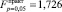 – для сдвига линии по оси показателя преломления; табличное значение критерия Фишера
– для сдвига линии по оси показателя преломления; табличное значение критерия Фишера  ). Если в растворе присутствуют обе аминокислоты – глицин и β-аланин – то каждый 1 % добавки аминокислоты к раствору приводит к сдвигу температуры замерзания вниз по оси температур на величину 0,13 ± 0,01 °С и увеличению по модулю тангенса угла наклона линии к оси концентраций на 0,024 ± 0,008 град∙л/моль. Соответственно сдвиги по оси осмотического давления и показателя преломления на каждый 1 % добавки низкомолекулярных аминокислот к раствору составляют 330 ± 30 Па и 0,0020 ± 0,0003.
). Если в растворе присутствуют обе аминокислоты – глицин и β-аланин – то каждый 1 % добавки аминокислоты к раствору приводит к сдвигу температуры замерзания вниз по оси температур на величину 0,13 ± 0,01 °С и увеличению по модулю тангенса угла наклона линии к оси концентраций на 0,024 ± 0,008 град∙л/моль. Соответственно сдвиги по оси осмотического давления и показателя преломления на каждый 1 % добавки низкомолекулярных аминокислот к раствору составляют 330 ± 30 Па и 0,0020 ± 0,0003.
В серии растворов β-аланина с добавками глицина добавки глицина, как менее активного в осмотическом отношении компонента, не приводят к существенному изменению тангенса угла наклона линий осмотического давления к оси концентраций, который составляет 3200 ± 200 Па·л/моль. В серии растворов глицина с добавками β-аланина ситуация обратная. Каждый 1 % добавки аланина, как более активного в осмотическом отношении компонента, обеспечивает увеличение по модулю тангенса угла наклона к оси концентраций линии осмотического давления на 70 ± 10 Па·л/моль. Добавки низкомолекулярных аминокислот линейного строения практически не приводят к изменению тангенса угла наклона линии показателя преломления к оси концентраций, который составляет 0,0155 ± 0,0006 для серии растворов глицина с добавками аланина и 0,0170 ± 0,0010 для серии растворов аланина с добавками глицина.
Таблица 2
Уравнения регрессии концентрационных зависимостей свойств водных растворов глицина с добавками β-аланина
|
Изучаемый объект |
Уравнение регрессии вида Y = a + b∙X для изменения температуры замерзания, эффективной осмотической концентрации, осмотического давления и показателя преломления от концентрации глицина |
Коэффициент корреляции R |
Ошибки определения коэффициентов a и b |
|
Водные растворы глицина |
Δtзам = 0,02 – 1,03∙CГЛИ |
–0,998 |
Δa = 0,01; Δb = 0,01 |
|
π = –60 + 2750∙CГЛИ |
0,998 |
Δa = 45; Δb = 50 |
|
|
n = 1,3331 + 0,0155∙CГЛИ |
0,998 |
Δa = 0,0002; Δb = 0,0002 |
|
|
Водные растворы глицина с фоном 1 % аланина |
Δtзам = –0,08 – 1,02∙CГЛИ |
–0,998 |
Δa = 0,01; Δb = 0,01 |
|
π = 160 + 2800∙CГЛИ |
0,999 |
Δa = 40; Δb = 50 |
|
|
n = 1,3342 + 0,0152∙CГЛИ |
0,997 |
Δa = 0,0001; Δb = 0,0002 |
|
|
Водные растворы глицина с фоном 3 % аланина |
Δtзам = –0,34 – 1,10∙CГЛИ |
–0,999 |
Δa = 0,02; Δb = 0,01 |
|
π = 870 + 2950∙CГЛИ |
0,998 |
Δa = 40; Δb = 70 |
|
|
n = 1,3381 + 0,0151∙CГЛИ |
0,998 |
Δa = 0,0001; Δb = 0,0002 |
|
|
Водные растворы глицина с фоном 5 % аланина |
Δtзам = –0,57 – 1,17∙CГЛИ |
–0,998 |
Δa = 0,01; Δb = 0,02 |
|
π = 1490 + 3100∙CГЛИ |
0,998 |
Δa = 60; Δb = 140 |
|
|
n = 1,3422 + 0,0160∙CГЛИ |
0,998 |
Δa = 0,0001; Δb = 0,0003 |
Выводы
1. Среди низкомолекулярных аминокислот линейного строения β-аланин является более активным осмотически и рефрактометрически по сравнению с глицином.
2. Совместное присутствие глицина и β-аланина в водном растворе приводит к некоторому выравниванию хода линейных концентрационных зависимостей осмотического давления и показателя преломления, что может быть непротиворечиво объяснено именно с позиций проявления коллигативных свойств, когда нивелируются физико-химические особенности каждого из компонентов, а свойства растворов определяются общим количеством частиц.



