В настоящее время с каждым годом увеличивается количество и тяжесть травм, врожденных и приобретенных дефектов костей. Лечение этих заболеваний связано с регенерацией костной ткани и является длительным и дорогостоящим процессом [1, 6, 9]. Ускорение сращения переломов костей и возмещения костных дефектов является актуальной задачей современной медицины [2, 10, 3]. Одним из перспективных направлений в управлении регенеративными процессами при переломе длинных трубчатых костей является использование низкомолекулярных белковых факторов [7, 8].
Цель исследования: изучить изменения некоторых биохимических показателей в сыворотке крови крыс при локальном введении костных белков в зону перелома на различных этапах эксперимента.
Материалы и методы исследования
Биохимические исследования проведены на 42 крысах линии Вистар в возрасте 6 месяцев. Экспериментальные животные были поделены на 3 группы. Первая (n = 18) – контрольная группа, без применения белкового препарата, вторая (n = 18) – опытная группа с введением в зону перелома белкового препарата, третья (n = 6) – интактные животные. Животным контрольной и опытных групп моделировали перелом большеберцовой кости с сохранением целостности малоберцовой кости. Перелом фиксировали четырьмя консольными спицами, проведенными по две дистальнее и проксимальнее места перелома. Концы спиц армировали медной проволокой и придавали жесткость конструкции термопластичной акриловой пастой. Содержание, оперативное вмешательство и вывод из опыта проводили на различных этапах эксперимента: 7, 14, 21 и 28 сутки после операции. Эвтаназию мелких лабораторных животных проводили под рометар-золетиловым наркозом декапитацией. Все экспериментальные исследования проводили, руководствуясь требованиями, изложенными в «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (1986 г.), с соблюдением этических норм и гуманного отношения к объектам изучения [5]. На седьмые сутки после операции в зону перелома животным контрольной группы вводили 0,2 мл раствор хлористого натрия в концентрации 0,9 %. Опытной группе животных в зону перелома вводили 0,2 мл раствора белков, не имеющих сродства к ионообменникам, в дозе 10 мг/кг веса.
Объектом исследования служила сыворотка крови, которую получали центрифугированием цельной крови при 3000 об./мин.
Остеорепаративные процессы в ходе эксперимента оценивали по уровню активности сывороточных ферментов: общей щелочной фосфатазы (ОЩФ) и тартратрезистентного изофермента кислой фосфатазы (ТрКФ). В сыворотке крови крыс оценивали минеральный обмен по содержанию кальция и неорганического фосфата. Состояние энергетического обмена оценивали по содержанию в сыворотке крови молочной кислоты (МК), пирувата (ПВК), общего белка (ОБ).
Исследования сыворотки крови проводили с использованием автоматического биохимического анализатора HITACHI 902 (США), анализатора Stat Fax® 1904 Plus (США) и наборов фирмы «Vital Diagnostics» (Россия).
Для исследования использовали экстракт низкомолекулярных костных белков, выделенных следующим образом. Кортикальную кость диафиза бедренной кости быков замораживали при –70°С и очищали от надкостницы и костного мозга, измельчали под прессом в среде жидкого азота. Для выделения белков использовали фракцию размером менее 1 мм. Навеску кости заливали 0,1 н. раствором хлороводородной кислоты, вводя в раствор 20 мг йодоуксусной кислоты для блокирования активности протеолитических ферментов, и деминерализовали при температуре 4 °С до постоянного значения рН среды. Затем полученный раствор центрифугировали и диализовали против дистиллированной воды до отсутствия в противодиализате хлорид-ионов. Для диализа использовали диализный мешок с двумя мембранами CelluSep. Для хроматографической очистки получаемой фракции использовали систему ВЭЖХ Simadzu с препаративными колонками для гельпроникающей хроматографии Sodex Protein KW-2002.5. Далее полученную смесь белков последовательно очищали на ионообменных колонках Shodex IEC-SP-2825 и IEC QA-2825 в трисовом буфере и градиенте концентрации натрия хлорида 0 → 50 мМ. При этом собирали фракцию, не имеющую сродства к ионообменникам. Полученную фракцию так же диализовали против дистиллированной воды и лиофильно высушивали. Лиофильно высушенные белки герметично упаковывали в стеклянные флаконы и перед введением экспериментальным животным стерилизовали потоком быстрых электронов дозой 18 + 5 кГр на ускорителе ЛУЭ-8-5М.
В используемой фракции определяли количество некоторых клеточных цитокинов наборами реагентов фирмы INVITROGEN, иммунологическим методом на приборе Termo scientific (США). Биохимические показатели полученной фракции представлены: белок по Лоури 7,01 мг %, коллаген по оксипролину 71,73 мг %, уроновые кислоты 0,04 мг %, сиаловые кислоты 0,015 мг %, IGF-1 0,6 мг %, EGF 49,4 мг %. Таким образом, полученная фракция содержит в своем составе преимущественно низкомолекулярные дериваты коллагена и неколлагеновых белков костной ткани.
Результаты эксперимента обрабатывались методами непараметрической статистики, для описания данных использовались медиана, 25-й...75-й перцентили [4]. Для оценки достоверности различий между выборками применяли непарный критерий Вилкоксона при уровне значимости p < 0,01.
Результаты исследования и их обсуждение
Для оценки остеорепаративных процессов в зоне перелома мы рассчитывали индекс фосфатаз ИФ = ЩФ/ТрКФ, показывающий соотношение остеосинтетической и остеолитической фазы репаративного остеогенеза. Полученные нами данные биохимического исследования активности фосфатаз указывают на то, что при введении в зону перелома крыс белкового препарата, не сорбирующегося на ионообменниках, ИФ в сыворотке крови контрольной группы был достоверно ниже экспериментальной при уровне значимости р < 0,01 (рис. 1).
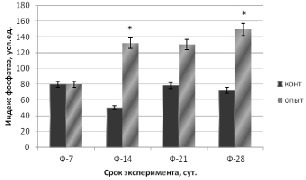
Рис. 1. Изменение индекса фосфатаз в сыворотке крови крыс. Примечание. Конт. – контрольная группа; опыт – опытная группа; * – достоверные различия контрольной и опытной группы на одном сроке эксперимента при уровне значимости p < 0,01
Это обстоятельство указывает на преобладание процессов костеобразования над процессами резорбции, протекающими в костной ткани при сращении перелома.
Проведя анализ уровня электролитов в сыворотке крови крыс, авторами выявили статистически значимое отличие концентрации кальция и отношения Ca/РО4 между контрольной и опытной группами. При применении белкового препарата наблюдалось стойкое повышение концентрации неорганического фосфата, концентрация кальция оставалась практически на одном уровне (рис. 2).
Из полученных данных видно, что индекс Са/РО4 в сыворотке крови контрольной группы оставался высоким на всех сроках эксперимента, в то время как в опытной группе происходило снижение этого отношения. Снижение исследуемого индекса происходило за счет уменьшения количества кальция в сыворотке крови при практически неизменном количестве фосфата. Снижение концентрации кальция в сыворотке крови на этапах эксперимента у животных опытной группы связано с его накоплением в зоне перелома.
По изменению в сыворотке крови концентрации продуктов обмена углеводов: молочной (МК) и пировиноградной кислот (ПВК) авторы судили об интенсивности углеводного обмена. В ходе эксперимента происходило накопление данных метаболитов и достигало максимума на 28 сутки периода фиксации, как в опытной, так и в контрольной группе. Этот факт свидетельствует об увеличении интенсивности углеводного обмена в тканях при травме (рис. 3).
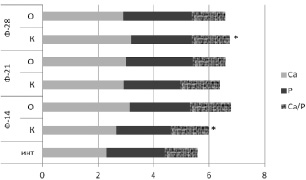
Рис. 2. Изменение содержания электролитов в сыворотке крови крыс в ходе эксперимента. Примечание. К – контрольная группа; О – опытная группа; Инт. – интактные животные; * – достоверные различия контрольной и опытной группы при уровне значимости p < 0,01
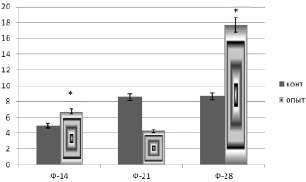
Рис. 3. Изменение содержания МК/ПВК в сыворотке крови крыс в ходе эксперимента. Примечание. * – достоверные различия контрольной и опытной группы при уровне значимости p < 0,01
Выводы
1. В опытной группе изменение активности фосфатаз сыворотки крови при локальном введении костных белков в зону перелома указывает на преобладание процессов костеобразования над процессами резорбции по сравнению с контрольной группой при p < 0,01.
2. Накопление МК и ПВК свидетельствует об интенсивности энергообмена в тканях при травме. Активные биохимические процессы энергообеспечения способствуют более интенсивному восстановительному процессу.
3. Локальное введение костных белков в зону перелома у животных опытной группы приводит к снижению концентрации кальция в сыворотке крови на этапах эксперимента и активному накоплению его в зоне перелома.



