Использование современных высокотехнологичных методов в такой сложной области ортопедии, как спинальная хирургия, позволило значительно увеличить возможности оказания помощи больным с деформациями позвоночника. Совершенствование методов коррекции и стабилизации позвоночника и используемого при этом инструментария направлено на снижение риска неблагоприятных воздействий на спинной мозг. Параллельно интенсивно развиваются технологии интраоперационного контроля за состоянием различных систем организма пациента с целью своевременного выявления возможных негативных реакций на хирургическую агрессию. К ним, в частности, относится интраоперационный нейрофизиологический мониторинг [2]. Данный метод широко применяется в практической медицине и возведен в ранг протокольного исследования при хирургической коррекции деформаций позвоночника. В зависимости от целей и финансовых возможностей клинических учреждений существующий приборный парк технических средств нейромониторинга позволяет выбрать систему с широким диапазоном возможностей либо прибор с узко заданной схемой функционирования. Однако в Российской Федерации процесс распространения данной технологии идёт медленными темпами. Остаются не оптимизированными отдельные технические вопросы и возможности интерпретации получаемой в ходе оперативного вмешательства информации о текущем состоянии тестируемых нервных структур.
Несмотря на то, что использование соматосенсорных вызванных потенциалов (ССВП) стало «золотым стандартом» нейромониторинга [9], в литературе отмечаются случаи отсутствия реакции ССВП на хирургическую агрессию, вызвавшую в послеоперационном периоде нарушение моторных функций нижних или верхних конечностей пациента [8]. Данную проблему удалось успешно решить, используя в качестве инструмента контроля проводниковой функции пирамидного тракта моторные вызванные ответы (МВО), получаемые при транскраниальной электростимуляции корковых проекционных зон мышц верхних и нижних конечностей. Тем не менее значительная вариабельность изменений МВО в ходе выполнения оперативного вмешательства затрудняет выработку единого мнения относительно сигнальных значений наблюдаемых явлений [10]. Соответственно, остаётся нерешённой проблема ложноположительных реакций. С учётом вышеизложенного целью настоящей работы является систематизация вариантов интраоперационного изменения МВО, основанная на их взаимосвязи со степенью риска развития неврологических осложнений.
Материалы и методы исследования
Анализируемая выборка состояла из 81 больного (36 мужского, 45 женского пола), в возрасте 1,2–33 лет (13,9 ± 0,8 лет) с деформациями позвоночника разной этиологии. Из них идиопатический сколиоз был у 31 пациента, деформации позвоночника врождённого генеза – у 36 пациента, нейромышечный и нейрогенный сколиоз – у 14 пациентов. Величина деформации варьировала от 20° до 105° по сколиотическому компоненту и от 15° до 134° – по кифотическому. Всем пациентам была произведена инструментальная коррекция деформации с последующей фиксацией грудного / грудопоясничного отдела позвоночника с использованием различных вариантов погружных систем транспедикулярной фиксации. Исходя из цели данной работы, мы не сочли целесообразным представлять более подробное описание использованных вариантов оперативного вмешательства и особенностей анестезиологического обеспечения. Они широко освещены в ранее опубликованных нами работах [3–6].
В предоперационном периоде вероятность получения пригодных для нейромониторинга МВО оценивалась по наличию определенного минимума средней амплитуды произвольной биоэлектрической активности мышц-индикаторов. У пациентов старше пяти лет это происходило в процессе электромиографического (ЭМГ) обследования с использованием цифровой ЭМГ-системы «Viking-IV» (Nicolet Biomedical, США). В отношении выбранных для контроля мышц применялся тест «максимальное произвольное напряжение» [1]. У детей младше пяти лет возможность произвольной активации мышц конечностей оценивалась клинически. Контрольное ЭМГ-обследование, в зависимости от состояния пациента, выполнялось через 1–2 недели после оперативного вмешательства.
Интраоперационный нейромониторинг осуществлялся с помощью системы «ISIS IOM» (Inomed Medizintechnik GmbH, Германия).
МВО получали посредством транскраниальной электростимуляции коры головного мозга с помощью разовых субдермальных стерильных спиралевидных электродов, установленных на скальпе в проекции корковых представительств мышц-индикаторов, что соответствовало отведениям С3–С4 по международной системе отведения ЭЭГ (10–20). В качестве мышц-индикаторов использовались m. tibialis anterior, m. gastrocnemius lateralis. МВО регистрировали монополярно (отведение типа «belly-tendon») с помощью разовых стерильных игольчатых электродов. Стимуляция осуществлялась сериями из пяти разнополярных стимулов, длительностью 1 мс, межстимульным интервалом 4 мс, с частотой 1 Гц и интенсивностью порядка 150 мА.
Первое тестирование (регистрация т.н. «базовых» МВО) проводилось через 40–60 минут после введения миорелаксанта, используемого при вводном наркозе. Последующие тестирования проводились после выполнения имплантации опорных элементов конструкции и на этапах корригирующих маневров. Продолжительность мониторинга варьировала от 1 часа 03 мин до 9 час 00 мин (средняя длительность 3,9 ± 0,2 часа).
В процессе каждой посылки стимулирующих воздействий оценивалось отсутствие / наличие и характер реакции со стороны моторных трактов спинного мозга в ответ на хирургические манипуляции.
Текущим реактивным изменениям формы и параметров МВО в момент тестирования присваивался ранг в соответствии с разработанной нами шкалой (табл. 1).
На основании совокупности изменений ранговой оценки МВО всех мышц-индикаторов на протяжении всего оперативного вмешательства выявленному типу реакции моторной системы на коррекцию деформации присваивался соответствующий балл (табл. 2). Определялась частота встречаемости (ν) выделенных типов реакции по формуле
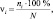
где ni – число наблюдений i-го типа реакции; N – общее количество наблюдений в анализируемой выборке.
Результаты исследования и их обсуждение
Характеристики исходных (базовых) МВО, получаемых до начала хирургического вмешательства, варьировали в широких пределах, что было обусловлено особенностями функционального статуса пирамидной системы пациента. В одном случае ответы были получены только монолатерально, ещё у трёх больных исходных МВО получить не удалось.
Обобщая текущие изменения значений ранговой оценки МВО в процессе оперативного вмешательства (табл. 1), мы выделили пять устойчивых комбинаций рангов, которые, по нашему мнению, соответствуют основным типам реакции моторной системы пациента на оперативную коррекцию деформаций позвоночника. Они представлены в табл. 2.
Выделенные типы реакции отражают уровень риска развития неврологических осложнений (и соответствующего снижения моторных функций) в результате хирургического воздействия.
Как видно из табл. 2, использование современных технологий оперативной коррекции деформаций позвоночника сопровождается минимальным риском развития неврологических осложнений, за исключением небольшого числа случаев (в пределах 10 %), в которых повышенная опасность повреждения моторных трактов обусловлена особенностями патологии.
При выявлении IV и V типов реакции, благодаря своевременно принятым мерам (введению гормональных, вазоактивных препаратов, снижению уровня дистракционных усилий, пролонгированной тракции), в большинстве наблюдений моторные функции пациента сохранились на уровне, соответствующем дооперационному. В трёх случаях, после выявления реакции V типа, пациентам были проведены повторные оперативные вмешательства (перепроведение винтов, сброс дистракционных усилий).
Таблица 1
Ранговая оценка реакции параметров моторных вызванных ответов (МВО) на текущее оперативное воздействие
|
Оценка |
Электрофизиологический феномен |
|
0 |
Сохранение на момент тестирования формы и амплитудно-временных параметров МВО близкими к исходным |
|
1 |
Повышение амплитуды МВО относительно исходного уровня, зачастую сопровождаемое появлением дополнительных фаз |
|
2 |
Умеренное снижение амплитуды МВО, не сопровождаемое существенным изменением его формы |
|
3 |
Нестабильность амплитудно-временных характеристик и формы (значительные колебания количества и выраженности фаз) ответа |
|
4а |
Значительное снижение амплитуды МВО (более чем на 50 % от исходного уровня), сопровождаемое колебаниями его латентности и обеднением (редукцией) формы с последующим восстановлением характеристик МВО, близких к исходному |
|
4б |
Значительное снижение амплитуды МВО (более, чем на 50 % от исходного уровня), сопровождаемое колебаниями его латентности и обеднением формы с последующим сохранением угнетённых ответов и/или дальнейшем угнетении МВО вплоть до полного исчезновения |
|
5 |
Полное исчезновение ответа (длительностью не более 15 минут) с последующим восстановлением до уровня, близкого к исходному |
|
6 |
Полное исчезновение ответа с последующим частичным восстановлением |
|
7 |
Полное исчезновение МВО без признаков его восстановления к моменту завершения хирургического вмешательства |
Таблица 2
Типы реакции моторной системы больных на оперативную коррекцию деформации позвоночника
|
Тип |
Комбинации рангов |
Частота встречаемости |
Характеристика риска |
|
I |
0, 1, 2 |
36,7 % |
Благоприятное течение |
|
II |
0, 1, 2, 3, 4а |
20,3 % |
Благоприятное течение |
|
III |
0, 1, 2, 3, 4а, 5 |
17,7 % |
Низкий риск |
|
IV |
0, 1, 2, 3, 4б, 5, 6 |
16,5 % |
Средний риск |
|
V |
0, 1, 2, 3, 4б, 5, 6, 7 |
8,9 % |
Высокий риск |
Наряду с реализацией текущего контроля, предложенная нами шкала типов реактивности моторной системы интересна ещё и тем, что отражает действие физиологических механизмов, обеспечивающих функцию пирамидных трактов в условиях экстремального воздействия. К этим механизмам относятся, прежде всего, неспецифические регуляторные системы ЦНС, обеспечивающие баланс между активацией и торможением корковых и проводниковых элементов пирамидного тракта. Тем самым они интегрируют действие факторов анестезии и эффектов разнообразной интенсивной интероцептивной (в том числе и ноцицептивной) афферентации из зоны оперативного вмешательства.
Другим важным компонентом, предположительно определяющим тип реакций моторных структур ЦНС на хирургическую агрессию, является состояние интрамедуллярной сосудистой системы. Резкое сужение и перепады давления в интрамедуллярных артериях могут быть причиной транзиторных интраоперационно индуцированных ишемических атак, приводящих к появлению эффекта нестабильности и временному снижению МВО.
Исходя из вышесказанного, негативные изменения МВО, не связанные с непосредственными действиями хирурга и трактуемые как ложноположительные реакции, обусловлены угнетением возбудимости моторной коры и флуктуациями возбудимости волокон кортикоспинального тракта, спинальных корешков и периферических нервов. В первом случае ведущую роль играет воздействие наркоза, особенно у детей с повышенной чувствительностью к пропофолу. В этом случае необходимо контролировать его концентрацию в крови таким образом, чтобы она не превышала 0,6–0,8 нг/мл [7]. Эффективным способом контроля повышенной чувствительности к пропофолу у детей может служить использование дополнительных отведений МВО от мышц верхних конечностей (mm. thenar, mm. hypothenar).
Устойчивое снижение возбудимости вследствие гипертермии проводниковых элементов пирамидного тракта, корешков спинного мозга и нервных стволов может возникать при длительном использовании электрокоагулятора в монополярном режиме, при рассечении тканей в непосредственной близости от подлежащих нервных структур. С этим явлением связывается временное угнетение МВО на начальных этапах оперативного вмешательства – при выполнении доступа к скелету позвоночника. В подобной ситуации дополнительным способом интраоперационного контроля проводниковых структур спинного мозга может служить термография кожных покровов нижних конечностей: интраоперационное снижение возбудимости пре- и постганглионарных структур симпатической нервной системы, связанное с развитием гипертермических блоков, приводит к заметному увеличению кожной температуры [2].
Трансформация МВО при II–IV типах реакции обусловлена не столько непосредственным воздействием на нервную ткань, сколько активностью вышеперечисленных физиологических механизмов. Это позволяет считать, что наблюдаемый при нейрофизиологическом тестировании тип реакции моторной системы отражает состояние механизмов адаптации и связан с реабилитационным потенциалом пациента. Динамика характеристик моторных ответов, регистрируемых во время проведения оперативного вмешательства, даёт важную информацию о состоянии общих неспецифических регуляторных систем организма. Выделяемый нами тип реакции позволяет эту информацию формализовать. В дальнейшем необходимо определить возможность и способы её использования в качестве вспомогательного инструмента при выработке тактики послеоперационного ведения больного, в частности – для повышения эффективности соответствующих реабилитационных мероприятий. Если коррекция деформации позвоночника проводится в несколько этапов, безусловно, тип реакции, выявленный при первом вмешательстве, должен учитываться и при последующих. Повторение эпизодов негативных изменений характеристик МВО, если хирург достаточно информирован о возможности их возникновения у данного пациента и при наличии высокого уровня взаимодействия в тандеме «хирург – нейрофизиолог», не вызовет излишнего эмоционального напряжения в хирургической бригаде и не спровоцирует применение избыточных интраоперационных реабилитационных мероприятий.
Заключение
Таким образом, использование технологии регистрации МВО в процессе оперативной коррекции деформаций позвоночника является высокоэффективным инструментом профилактики развития интраоперационных неврологических осложнений. Нами произведена систематизация выявленных электрофизиологических феноменов, на основании чего были выделены основные типы реакции моторной системы на оперативное вмешательство. Предложенная схема шкалирования типов реакции моторной системы (табл. 2) отражает не только степень риска развития неврологических осложнений, но также и диапазон функционирования адаптивных физиологических механизмов, обеспечивающих компенсацию избыточной нагрузки на нервные и гуморальные регуляторные системы в условиях хирургической агрессии. В перспективе данная информация может быть использована в качестве вспомогательного инструмента при выработке тактики послеоперационного ведения больного и разработке комплекса соответствующих реабилитационных мероприятий.



