Отсутствие эффективных методов лечения при поражениях головного мозга венозного характера побуждает искать новые терапевтические подходы, направленные на стимуляцию процессов репарации нервной ткани. Особая роль в этом направлении отводится клеточным технологиям. Долгое время считалось, что центральная нервная система (ЦНС) не способна к репарации. Однако экспериментальные исследования последних лет показали, что процессы репарации могут наблюдаться и в поврежденной ткани ЦНС, причем эти процессы во многом обусловлены образованием новых сосудов, генерацией новых нервных клеток и в значительной степени – реорганизацией нейронной сети (нейропластичность) [8]. Более того, многочисленные экспериментальные исследования показали эффективность клеточной терапии при коррекции неврологических нарушений в моделях повреждения головного мозга сосудистого генеза [1, 3, 4, 6].
Среди различных типов клеток наибольшее внимание в последнее время привлекают мезенхимальные стромальные клетки (МСК), способные стимулировать ангиогенез, активировать нейральные стволовые клетки, оказывать нейротрофическую поддержку и модулировать процессы воспаления [2, 5, 7, 9, 10, 11].
Цель исследования – в рамках разработанной оригинальной модели нарушений церебрального венозного кровообращения у экспериментальных животных дать сравнительную характеристику патогистологических изменений головного мозга в группах после трансплантации мезенхимальных стромальных клеток и с самопроизвольным восстановлением.
Материалы и методы исследования
Для исследований в работе было использовано 40 белых крыс породы Wistar. Экспериментальные животные с поражением головного мозга (ПГМ) в соответствии с целями и задачами исследований были распределены по группам и сериям (табл. 1). Возраст животных составлял 3–4 месяца, масса тела – 210–220 граммов.
Содержание подопытных животных и экспериментальные работы с ними проводились в полном соответствии с «Европейской конвенцией по защите позвоночных животных, используемых для научных целей», и приказом Министерства здравоохранения СССР № 755 от 12 августа 1977 г.
В динамике наряду с регистрацией неврологического статуса выполнялись и морфологические исследования ткани головного мозга.
Исследование влияния мезенхимальных стволовых стромальных клеток (МСК) на восстановление функции головного мозга в разработанной модели очагового церебрального поражения, индуцированного нарушением венозного кровотока, было проведено на 24-х животных. МСК (в количестве 2∙106 клеток/животное) вводили двумя способами – внутривенно (в хвостовую вену) или непосредственно в область повреждения через установленный катетер и в двух временных режимах – на 1-е и 7-е сутки после моделирования очагового поражения головного мозга.
Таблица 1
Распределение экспериментальных животных по сериям и группам
|
Группа |
Серия |
Кол-во животных |
Тип хирургического вмешательства |
Клеточная терапия |
Время введения клеток |
Путь введения клеток |
|
Контрольная |
1 |
8 |
трепанация + моделирование ПГМ |
– |
– |
– |
|
2 |
8 |
трепанация + моделирование ПГМ + установка катетера |
– |
– |
– |
|
|
Исследуемая |
3 |
6 |
трепанация + моделирование ПГМ |
+ |
1 сутки |
в/в |
|
4 |
6 |
трепанация + моделирование ПГМ |
+ |
7 сутки |
в/в |
|
|
5 |
6 |
трепанация + моделирование ПГМ + установка катетера |
+ |
1 сутки |
местно |
|
|
6 |
6 |
трепанация + моделирование ПГМ + установка катетера |
+ |
7 сутки |
местно |
МСК получали из суспензии клеток костного мозга, аспирированных из бедренных костей животных, при культивировании прилипающей фракции в питательной среде DMEM (Sigma), содержащей 15 % эмбриональной телячьей сыворотки (ICN), при 37 °С в атмосфере 5 % СО2 до получения конфлюентного слоя. Пассирование МСК осуществляли с использованием 0,25 % раствора трипсина и 0,02 % раствора ЭДТА. МСК, использованные для введения животным, соответствовали Минимальным критериям, разработанным Комитетом по стволовым клеткам Международного общества клеточной терапии (Dominici, 2006). Жизнеспособность вводимых клеток, определяемая по окраске трипановым синим, во всех экспериментах превышала 93 %.
Морфологические исследования были произведены на препаратах продольных срезов участка повреждения головного мозга с захватом пограничной зоны повреждения толщиной 5–7 мкм. Для изучения морфоцитоархитектоники срезы окрашивали гематоксилином Майера и эозином и заключали в канадский бальзам. Оценку гистологических препаратов производили методом световой микроскопии под увеличением (100–300).
Согласно данным литературы, механизмы действия трансплантируемых МСК связывают в первую очередь с их паракринными эффектами, направленными на стимуляцию ангио- и нейрогенеза, предупреждение гибели нервных клеток и подавление воспаления [8]. Поэтому морфологические исследования были нацелены на анализ показателей, прямо или косвенно характеризующих эти процессы. В частности, оценивалась объемная плотность формирующихся кровеносных капилляров – как характеристика ангиогенеза, соотношение площади среза кровеносных капилляров к площади среза вен – как косвенный признак деструктивного отека и проницаемости сосудов. При исследовании цитоархитектоники производили подсчет волокнистых астроцитов, фибробластов и макрофагов, характеризующих воспалительный и репаративный процессы.
Для проведения иммуноморфологического исследования использовали методические рекомендации фирмы-производителя («Abcam», Англия). Перед проведением иммуногистохимического исследования приготовленные срезы депарафинизировали и производили демаскировку антигенов тканей в PT Link модуле (Dako, Дания) в цитратном буфере (pH 6,0), блокировали эндогенную пероксидазу 3 %-ным раствором Н2О2, проводили протеиновый блок сывороткой. Далее инкубировали полученные срезы с первичными антителами (клон Vim, DAKO Дания). Для иммунного окрашивания использовали полимерную систему детекции с пероксидазной меткой Novolink Polymer («Novocastra», Великобритания). Последним этапом докрашивали ядра клеток гематоксилином. Микроскопическую картину поврежденного участка и приграничной области головного мозга оценивали на 1-е, 7-е, 14-е и 21-е сутки после моделирования ПГМ.
Результаты исследований и их обсуждение
Патологические изменения головного мозга на 1-е сутки исследования
Макроскопически: у всех животных контрольной группы, на которых отрабатывался способ очагового повреждения головного мозга венозного характера, после выполнения коагуляции верхнего сагиттального синуса (ВСС) с последующей коагуляцией корковых вен в левой теменно- височной области в первые сутки с момента постановки эксперимента определялся очаг венозного стаза, который характеризовался отеком мозга в левой теменно-височной области (размерами 1,0×1,0×1,0 см) и пролабированием мозгового вещества в трепанационное отверстие.
Микроскопически: в контрольной группе животных визуализировался очаг, центр которого представлял зону полного разрушения ткани с формированием дезинтеграции и морфологическими изменениями клеток нейронов и глии. Очаг повреждения был представлен выраженной перифокальной лимфоидно-лейкоцитарной инфильтрацией (рис. 1, а). Тяжелые структурные изменения в микроциркуляторном русле проявлялись в виде деформации капилляров, набухания эндотелия, расширения его базальных слоев, приводящих к повышенной сосудистой проницаемости, диапедезными кровоизлияниями в веществе мозга и перифокальной зоне (рис. 1, б).
В перифокальной зоне наблюдался выраженный отек мозга и дистрофические изменения нейронов по ишемическому типу, клетки-тени, пикноморфные и гиперхромные нейроны (рис. 2).
Таким образом, некротическая стадия инфаркта мозга – это стадия аутолиза с характерными, типичными признаками некроза.
Патологические изменения головного мозга на 7-е сутки исследования
Макроскопически: у животных контрольной группы в месте нанесения повреждения головного мозга мозговая ткань характеризовалась дряблой консистенцией в очаге некроза. Вещество мозга было набухшим, бледным, границы инфаркта визуализировались нечетко и плохо контурировались, дефект ткани составлял около 0,9×1,0×0,9 см. Сохранялось умеренное пролабирование мозгового вещества.
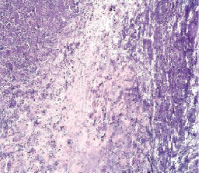
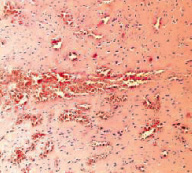
а б
Рис. 1. Контрольная группа. 1-е сутки наблюдения: а – очаг повреждения мозговой ткани с выраженной перифокальной лимфоидно-лейкоцитарной инфильтрацией. Увеличение 200; б – множественные диапедезные кровоизлияния в перифокальной зоне очага повреждения. Увеличение 100. Окраска гематоксилином и эозином
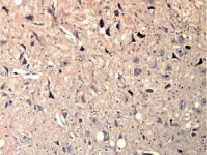
Рис. 2. Перифокальная зона очага повреждения. Выраженный отек, тяжелые дегенеративно-дистрофические изменения нейронов по ишемическому типу. Окраска гематоксилином и эозином. Увеличение 300
Микроскопически: в пограничной и перифокальной зонах очага повреждения наблюдалась пролиферация глиальных клеток на границе с инфарктом. В зоне повреждения выявлено большое количество гемосидерофагов, зернистые шары (рис. 3). Выявлены скопления гиперплазированных глиальных клеток в пограничной и перифокальной зонах. В демаркационной зоне на границе с инфарктом увеличено число и плотность клеток глии (рис. 4). Процессы альтерации в этом периоде преобладали над репаративными изменениями. Гипоксическое состояние приводило к дезинтеграции, отеку и набуханию нервной ткани.
Патологические изменения головного мозга на 14-е сутки исследования
Макроскопически: на 14-е сутки в зоне дефекта ткани мозга наблюдалось формирование ликворной кисты размерами 0,4×0,9×1,0 см, были визуализированы единичные очаги некроза по периферии очага повреждения.
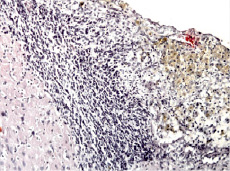
Рис. 3. Пролиферация клеток глии. Лейкоцитарная инфильтрация в перифокальной зоне очага повреждения. Гемосидерофаги в центральной зоне. Окраска гематоксилином и эозином. Увеличение 200
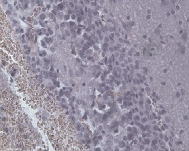
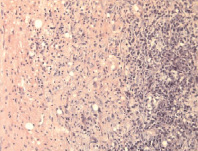
а б
Рис. 4. Очаги повреждения: а – гиперплазированные глиальные клетки в перифокальной и пограничной зонах; б – клетки глии в демаркационной зоне. Окраска гематоксилином и эозином. Увеличение 200
Микроскопически: в очаге деструкции ткани головного мозга наблюдалось нарастание репаративных изменений, дальнейшая резорбция некроза и активация макрофагальной функции (рис. 5).
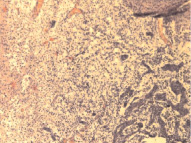
В дальнейшем имели место пролиферация кровеносных сосудов и формирование петель из новообразованных сосудов, которые особенно отчетливо выявлялись к 14-м суткам (рис. 6).
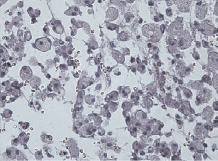
Рис. 5. Макрофагальная резорбция некротизированной нервной ткани. Окраска гематоксилином и эозином. Увеличение 200
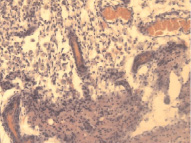
а б
Рис. 6. Контрольная группа. 14-е сутки: а – врастание сосудистых петель в очаг повреждения; б – петли новообразованных сосудов пограничной зоны, врастающих в очаг повреждения. Окраска гематоксилином и эозином. Увеличение 200
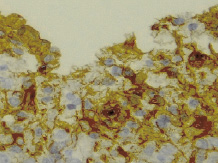
Рис. 7. Образование мелких кистовидных полостей в веществе мозга. Иммуногистохимическая реакция. Увеличение 300
На этом фоне в зоне повреждения происходили начальные процессы кистозной дегенерации ткани мозга (рис. 7).
Патологические изменения головного мозга на 21-е сутки исследования
Макроскопически: участков некроза не обнаружено, признаков воспаления не выявлено. В зоне сохраняющегося дефекта ткани мозга имелась кистозная полость (размерами 0,7×0,8×1,0 см), содержащая ксантохромный ликвор.
Микроскопически: на 21-е сутки зона некроза была замещена рубцовой тканью cо значительной кистозной дегенерацией мозгового вещества (рис. 8).

Рис. 8. Формирование кист разных размеров в зоне очага повреждения Окраска гематоксилином и эозином. Увеличение 300
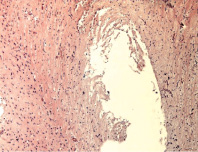
Рис. 9. Формирование глиомезенхимального рубца в зоне очага повреждения. Окраска гематоксилином и эозином. Увеличение 200
На 21-е сутки отмечено уменьшение интенсивности отека вещества мозга. В незначительном количестве были выявлены клетки, измененные по ишемическому типу, геморрагический компонент минимального уровня был представлен геморрагиями из мелких артерий, вен и капилляров, как диапедезными, так и в результате разрывов их стенок. Определялся гиломезензхимальный рубец с формирование кист разного размера (рис. 9).
Таким образом, экспериментальное повреждение головного мозга путем искусственного нарушения венозного кровотока характеризуется развитием зоны некроза (инфаркта). Морфологические особенности повреждения мозговой ткани в различных участках позволяли идентифицировать все три формы инфаркта, включая белый, красный или смешанный. В последующем идет резорбция некротических масс с формированием, начиная с 14-х суток с момента повреждения, глиального рубца и кистозной дегенерацией этой зоны. Характерной особенностью данной модели является развитие отека и выраженные нарушения микрогемоциркуляции с развитием тромбозов, стаза в сосудах и кровоизлияниями разной степени выраженности, что свидетельствует о сложности патогенеза инфаркта в модели очаговых повреждений головного мозга, вызванного нарушением венозного кровотока.
Влияние МСК на характер морфологических изменений в модели очагового повреждения головного мозга, индуцированного нарушением венозного кровотока
Для оценки возможного уровня позитивного влияния механизма МСК на восстановление неврологического дефицита при модельных нарушениях венозного кровотока проведен сравнительный анализ морфологических изменений поврежденного головного мозга с самопроизвольным его восстановлением (контроль) и с восстановлением, обусловленным трансплантацией МСК (исследуемая группа).
Изменения головного мозга на 7-е сутки исследования
Макроскопически: отмечается незначительное пролабирование мозгового вещества в трепанационный дефект.
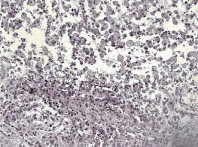
Микроскопически: в очаге повреждения наблюдается макрофагальная реакция с элиминацией продуктов распада, пролиферация фибробластов, формирование рыхлой соединительной ткани, увеличение астроцитарной глии, внедрение сосудов из демаркационной зоны (рис. 10).
Объемная плотность кровеносных капилляров в площади среза в группе с внутривенным введением МСК на 1-е сутки с момента поражения мозга составляла 24,50 ± 2,70 и достоверно превышала таковую у крыс контрольной группы серии № 1 (16,30 ± 1,40). Объемная плотность кровеносных капилляров в группе с местным введением клеток в очаг поражения мозга на 1-е сутки составляла 19,50 ± 0,30 и также превышала соответствующий показатель в группе контроля. При этом анализируемые данные в группе с внутривенным введением МСК были достоверно выше (p < 0,05), чем при локальном введении клеток в эти же сроки.
Отношение площади среза кровеносных капилляров к площади среза вен (индекс К/В) в группе контроля серии № 1 составило 0,72 ± 0,19, тогда как в группе серии № 3 с внутривенным введением МСК на 1-е сутки данный показатель был практически в 2,5 раза выше и составлял 1,78 ± 0,67 (p < 0,05). В то же время введение МСК в зону повреждения головного мозга у животных исследовательской группы серии № 5 не приводило к возрастанию индекса К/В: данный показатель оставался на уровне контрольной группы – 0,66 ± 0,19.
Абсолютное и относительное количества клеточных элементов демаркационной зоны (на границе с инфарктом) при разных способах введения МСК в группе исследования № 3 серии с внутривенным введением МСК на 1-е сутки характеризовалась достоверно большим содержанием волокнистых астроцитов и фибробластов. В той же группе крыс серии № 5 с местным введением МСК на 1-е сутки показатели по содержанию других клеточных популяций не отличались от контрольной группы животных.
Таким образом, внутривенное введение МСК на 1-е сутки после постановки эксперимента повышало интенсивность ангиогенеза, снижало выраженность отека мозга, способствовало более активному формированию рубца и оказывало цитопротективный эффект на 7-е сутки. Аналогичные эффекты при локальном введении МСК на 1-е сутки проявлялись с меньшей степенью выраженности, либо не регистрировались вообще, что могло быть обусловлено, по нашему мнению, повреждающим действием катетера.
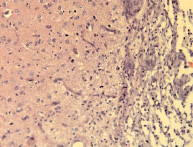
а б
Рис. 10. Макрофагальная реакция и начало организации зоны повреждения: а – элиминация продуктов распада макрофагами; б – формирование рыхлой соединительной ткани с пролиферацией сосудов. Окрашено гематоксилином и эозином. Увеличение 200
Изменения головного мозга на 14-е сутки исследования
Макроскопически: на 14-е сутки в области поврежденного головного мозга сформировалась кистозная полость размерами 0,4×0,7×0,9 см, заполненная ликвором, участки некроза не определялись.
Микроскопически: на 14-е сутки в зоне повреждения наблюдалось формирование кистозной полости, ограниченной нежным глиомезенхимальным пролифератом (рис. 11).
Патологические изменения головного мозга в контрольной группе характеризовались дальнейшей резорбцией некроза и нарастанием репаративных изменений с пролиферацией глиальных элементов, разрастанием фибробластов, интенсивной продукцией аргирофильной волокнистости и нарастанием численной плотности волокнистых астроцитов. Объемная плотность капилляров в зоне среза в этой группе составила 16,90 ± 1,50. В то же время аналогичный показатель в 3-й серии исследовательской группы был достоверно выше – 21,60 ± 0,90 (p < 0,05). У животных с внутривенным и местным введением МСК на 7-е сутки (серии № 4 и 6) этот показатель составлял 19,40 ± 1,70 и 17,60 ± 1,90 соответственно; в серии № 5 с введением МСК в зону повреждения на 1-е сутки плотность кровеносных капилляров была равной 16,90 ± 2,30 (рис. 12).
Отношение площади среза капилляров к площади среза вен в контрольной группе составило 0,76 ± 0,04. В группе исследования в сериях № 3 и 4 индекс К/В был выше – 1,20 ± 0,05 и 1,20 ± 0,10 соответственно. В группах серии № 5 и 6 данный показатель составлял соответственно 0,78 ± 0,04 и 0,67 ± 0,03, незначительно отличаясь от уровня в контрольной группе (p < 0,05).
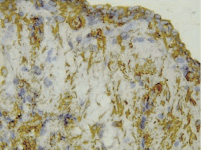
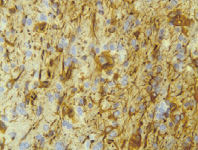
а б
Рис. 11. Организация очага повреждения в группе исследования, серии № 3: а – формирующаяся стенка дна кистозной полости, отграничивающаяся нежной глиомезенхимальной капсулой; б – глиомезенхимальная капсула на границе с очагом повреждения. Иммуногистохимическая реакция. Увеличение 200
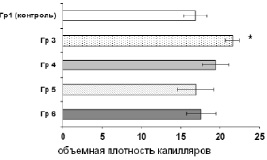
Рис. 12. Интенсивность ангиогенеза в группах с трансплантацией МСК и у животных контрольной группы на 14-е сутки. Представлены средние значения и ошибка среднего показателя объемной плотности кровеносных сосудов. * – P < 0,05 – различие между группами достоверно
Абсолютное и относительное содержание различных клеток на границе с инфарктом на 14-е сутки после внутривенного введения МСК как на 1-е, так и на 7-е сутки ассоциировалось с большим относительным содержанием в периинфарктной зоне волокнистых астроцитов и фибробластов. При локальном введении МСК эти эффекты были минимальны.
Изменения головного мозга на 21-е сутки исследования
Макроскопически: кровоизлияний в полость и признаков воспаления выявлено не было. Умеренно пролабирующая кистозная полость размерами 0,3×0,7×0,8 см прозрачная, имеется четкая граница между зонами интактного и поврежденного головного мозга.
Микроскопически: в зоне повреждения сформировался компактный глиомезодермальный рубец с небольшим количеством кист (рис. 13).
На этой стадии исследования было отмечено уменьшение плотности капиллярных сосудов как в контрольной группе (14,96 ± 2,54), так и группах с трансплантацией МСК. Так данный показатель в 3, 4, 5 и 6-й исследовательских группах составил соответственно 11,40 ± 2,10; 13,90 ± 1,20; 16,80 ± 2,50 и 14,20 ± 3,30. Напротив, индекс соотношения площади среза капилляров к площади среза вен в контрольной группе по сравнению с предшествующим периодом несколько возрос, что свидетельствует о дальнейшем уменьшении отека. При этом существенных различий в индексе К/В между контрольной группой и группой с трансплантацией МСК не наблюдалось. Так, индекс К/В в серии № 3 составлял 0,98 ± 0,20, в серии № 4 – 1,10 ± 1,10, в серии № 5 – 1,30 ± 1,10 и в серии № 6 – 1,20 ± 0,80.
Данные, характеризующие клеточный состав в зоне организации, представлены в табл. 2.
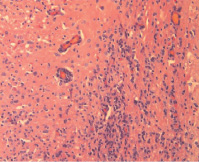
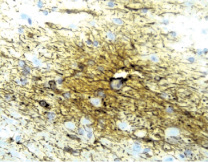
а б
Рис. 13. Морфологические изменения зоны повреждения на 21-е сутки: а – глиомезодермальный рубец компактного типа. Окраска гематоксилином и эозином. Увеличение 200; б – образование рубца на месте очага повреждения. Иммуногистохимическая реакция. Увеличение 200
Таблица 2
Клеточный состав зоны организации повреждения мозга на 21-е сутки
|
Исследуемый параметр |
Контрольная группа |
В/в ведение МСК 1-е сут (гр. 3) |
Местное введение МСК (1-е сут (гр. 5) |
В/в введение МСК 7-е сут. (гр. 4) |
Местное введение МСК 7-е сут (гр. 6) |
|
Волокнистые астроциты |
25,11 ± 0,35 |
35,11 ± 1,69 |
22,33 ± 1,57 |
29,43 ± 1,97 |
24,93 ± 3,18 |
|
Фибробласты |
19,22 ± 1,38 |
28,50 ± 1,25 |
17,92 ± 2,56 |
23,50 ± 1,36 |
18,02 ± 1,25 |
|
Макрофаги |
4,22 ± 1,82 |
1,21 ± 1,74* |
5,86 ± 1,66 |
2,11 ± 1,97* |
4,19 ± 2,68 |
Примечание. * – отличие величин значений между группами достоверно.
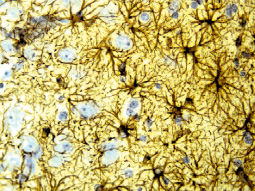
Рис. 14. Группа исследования, серия № 3. Пролиферация астроглии в перифокальной зоне очага. Иммуногистохимическая реакция. Увеличение 200
Глиомезодермальный рубец состоял из волокнистых астроцитов (рис. 14) и фибробластов. Количество макрофагов снижено.
Введение МСК на 1-е сутки приводит к более эффективному очищению очага повреждения и формированию компактного глиомезенхимального рубца с менее выраженной кистозной дегенерацией к 21-м суткам. Зона повреждения замещена глиомезенхимальными структурами. При местном введении МСК подобных проявлений не было выявлено. Таким образом, исследование цитоархитектоники головного мозга у животных с внутривенной трансплантацией МСК свидетельствует о меньшей интенсивности воспалительного процесса и более эффективной репарации к 21-м суткам.
Выводы
1. Морфологическим субстратом церебрального повреждения венозного характера в остром периоде является зона некроза головного мозга, который развивается на фоне выраженного отека и нарушения микроциркуляции в венозном русле по смешанному типу (стазы, тромбозы, кровоизлияния). Впоследствии эта зона подвергается рубцовому замещению с кистозной дегенерацией.
2. Морфологические изменения головного мозга у животных с внутривенной трансплантацией мезенхимальных стромальных клеток по сравнению с контрольной группой характеризуются более выраженной активацией ангиогенеза, меньшей выраженностью отека, быстрой санацией участков мозга с формированием глиомезодермального рубца.



