Жирное масло семян бурачника лекарственного (Borago officinalis L.) семейства бурачниковые (Boraginaceae Juss.) является богатым и перспективным источником ω-6 полиненасыщенной эссенциальной γ-линоленовой кислоты. С целью получения масла данный вид широко культивируется в странах Западной Европы, Азии, Северной Америки и является фармакопейным во многих странах. В России бурачник лекарственный применяется только в народной медицине. С целью сохранения запасов данного ценного растения в дикорастущей флоре нами проведена интродукция бурачника лекарственного в условиях ботанического сада Пятигорского медико-фармацевтического института (ПМФИ) [5]. Установлено, что масло, полученное из семян интродуцированных растений, содержит от 18,1 до 19,8 % γ-линоленовой кислоты в зависимости от способа выделения, является малотоксичным и не обладает местнораздражающим действием [3, 8]. Известно, что для обеспечения качества лекарственных средств решающее значение имеют стандарты GMP и GLP, одним из основных параметров которых является микробиологическая чистота. Аэробные бактерии, в том числе Escherichia coli, Staphylococcus aureus, Salmonella galenarum, дрожжевые и плесневые грибы – возможные контаминанты лекарственных средств, которые регламентируются современными фармакопеями (ГФ ХII изд., ЕФ 6.0) [6]. Также несомненный интерес представляет исследование фармакологической и антимикробной активности.
Целью настоящего исследования явилось изучение микробиологической чистоты, антимикробной активности и ранозаживляющего действия масла семян бурачника лекарственного, интродуцированного в ботаническом саду ПМФИ.
Микробиологические исследования жирного масла проводили по методике ОФС 42-0067-07 «Микробиологическая чистота» ГФ XII [2]. Предварительно методом диффузии в агар определили антимикробную активность масла по отношению к тест-штаммам Staphylococcus aureus (209); Staphylococcus aureus (Макаров); Staphylococcus aureus (Type); Staphylococcus epidermidis Wood-46; Escherichia coli 675; Escherichia coli 055; Salmonella galenarum; Bacillus subtilis L2; Bacillus anthracoides – 1; Bacillus anthracoides – 96; Proteus vulgaris. Суточные микробные культуры с мясопептонного агара смывали 2–3 мл физраствора и готовили взвесь, содержащую 500 млн микробных клеток в 1 мл по стандарту мутности. Затем 2 мл взвеси помещали в чашку Петри, равномерно распределяли по поверхности, а излишки взвеси удаляли. Стерильным сверлом делали в каждой чашке 2 лунки диаметром 6 мм. Поскольку масло плохо диффундирует в агар, готовили разведения масла в димексиде 1:1 и 1:10. Предварительно было установлено, что димексид не обладает антибактериальной активностью. После подсушивания в каждую лунку вносили исследуемые разведения масла бурачника лекарственного. Под крышку чашки Петри помещали стерильный фильтр во избежание попадания конденсата на лунки. Все чашки Петри ставили строго горизонтально для получения круглых зон угнетения роста микроорганизмов.
Антимикробную активность оценивали по диаметру зон задержки роста тест-штаммов: менее 10 мм – отсутствие антибактериальной активности, 10 мм – умеренная антибактериальная активность, больше 10 мм – высокая активность.
Определение микробной обсемененности проводили в соответствии с требованиями ГФ XII, предъявляемыми к субстанциям природного происхождения по показателю «Микробиологическая чистота». Испытание включало количественное определение жизнеспособных бактерий и грибов, а также выявление определенных видов микроорганизмов, наличие которых недопустимо в субстанциях для производства нестерильных лекарственных препаратов, относящихся к категории 2 (3). Для устранения антимикробного действия масла использовали метод разведений. Установлено, что масло в разведении 1:10 не обладает антибактериальной активностью по отношению к исследуемым тест-штаммам микроорганизмов.
Согласно требованиям ГФ XII посев масла в димексиде 1:10 производили на среды № 1, 2, 3 и 8. Посевы на средах № 1 (для выращивания аэробных бактерий), 3 (для обогащения энтеробактерий) и 8 (для выращивания бактерий) инкубировали в термостате при температуре 32,5 ± 2,5 °С в течение 48 ч (среды № 3, 8) и 5 суток (среда № 1). Посевы на среде № 2 (для выращивания грибов) инкубировали при температуре 22,5 ± 2,5 °С в течение 5 суток. Оценку результатов проводили по наличию и количеству выросших колоний.
Экспериментальные исследования ранозаживляющей активности проводили на белых крысах – самцах линии Wistar с массой тела 260–300 г.
Животные были получены из вивария ПМФИ, где находились в стандартных условиях в соответствии с правилами, утвержденными МЗ СССР 06.07.1986 г., по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) и Директивой Совета ЕС от 24.11.1986 г. по вопросам защиты животных, используемых для экспериментальных и других научных целей (86/609/ЕЕС). Животные находились в пластмассовых клетках группами по 8 особей при смешанном освещении в условиях свободного доступа к воде и корму.
Работа с экспериментальными животными соответствовала приказу МЗ РФ № 267 от 19.06.03 г. «Правила проведения работ с использованием экспериментальных животных» и Национальному стандарту РФ ГОСТ Р 53434 – 2009 «Принципы надлежащей лабораторной практики».
Кожную линейную рану воспроизводили под хлоралгидратным наркозом (300 мг/кг) путем удаления в области спины животного кожно-фасциального лоскута на предварительно выстриженных участках. Животных разделили на группы по 8 крыс в каждой, раневая поверхность оставалась открытой в течение всего эксперимента [1, 7].
У животных контрольной группы наблюдали естественное заживление ран. В опытной группе применяли жирное масло семян бурачника лекарственного. В качестве препарата сравнения использовали облепиховое масло производства ООО НПФ «Алтайский букет». Лечение ран начинали на следующие сутки после моделирования раневого процесса. Препараты наносили в виде аппликаций ежедневно, один раз в день.
Динамику скорости заживления ран определяли по методу Л.Н. Поповой с использованием целлофана, на котором каждые 2 дня обрисовывались контуры раневого дефекта [1, 7].
Ранозаживляющие свойства оценивали по характеру и степени выраженности воспалительной реакции в ране и окружающих тканях, проводили планиметрию ран, регистрировали сроки появления грануляций и начала эпителизации.
Критерием окончания лечения во всех случаях являлась полная эпителизация раневой поверхности. Полученные результаты объективного исследования сравнивали по группам.
Статистическая обработка экспериментальных данных проведена общепринятым методом с использованием программы Excel.
Результаты исследования и их обсуждение
Как следует из данных табл. 1, масло семян бурачника лекарственного проявляет умеренную антимикробную активность по отношению к «грам+» и спорообразующим микроорганизмам (штаммам стафилококков и бацилл); высокую антимикробную активность – по отношению к Bacillus anthracoides-96 и Staphylococcus epidermidis Wood-46 и не проявляет активность в отношении «грам–» штаммов.
Как следует из данных табл. 2, масло семян бурачника лекарственного по микробиологической чистоте соответствует рекомендуемым нормам.
При изучении ранозаживляющей активности у животных всех групп в течение всего эксперимента не выявлено нарушений интегральных показателей: общего состояния, поведения, приема пищи и воды, экскреции, а также не выявлено различий этих показателей между группами.
Таблица 1
Антимикробная активноcть жирного масла семян бурачника лекарственного (разведение 1:1 в димексиде)
|
Штамм микроорганизмов |
Зона задержки роста, мм |
|
Staphylococcus aureus 209-Р |
11 |
|
Staphylococcus aureus (Макаров) |
11 |
|
Staphylococcus aureus «Туре» |
12 |
|
Staphylococcus epidermidis Wood-46 |
17 |
|
Escherichia coli 675 |
– |
|
Escherichia coli 0-55 |
– |
|
Salmonella galenarum |
– |
|
Bacillus subtilis L2 |
12 |
|
Bacillus anthracoides-1 |
11 |
|
Bacillus anthracoides-96 |
18 |
|
Proteus vulgaris |
– |
Динамика сокращения площади раневой поверхности у животных всех групп приведена в табл. 3.
Укорочение срока заживления ран в % рассчитывали по формуле
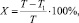
где Т – время заживления ран в контрольной группе в днях; Т1 – время заживления леченых ран в днях.
Укорочение срока заживления ран у животных, леченных маслом бурачника, относительно контрольной группы, составило 47,1 %; относительно препарата сравнения – 24,0 %.
Таблица 2
Результаты определения микробной обсемененности масла семян бурачника лекарственного (разведение 1:10 в димексиде)
|
№ п/п |
Показатели |
Рекомендуемые нормы |
Результат определения |
|
1 |
Общее число аэробных бактерий и грибов (суммарно) |
Не более 102 в 1 г или в 1 мл |
0,4∙102 |
|
2 |
Энтеробактерий |
Отсутствие в 1 г или в 1 мл |
Не обнаружено |
|
3 |
Pseudomonas aeruginosa |
Отсутствие в 1 г или в 1 мл |
Не обнаружено |
|
4 |
Staphylococcus aureus |
Отсутствие в 1 г или в 1 мл |
Не обнаружено |
Таблица 3
Влияние жирного масла семян бурачника лекарственного на динамику изменения площади линейных ран у белых крыс, М ± m, ∆ %
|
Сутки опыта |
Контрольная группа |
Масло бурачника |
Масло облепихи |
|
1-е |
6,44 ± 0,32 |
5,03 ± 0,30 |
6,08 ± 0,30 |
|
3-и |
4,37 ± 0,25 |
4,18 ± 0,26 |
5,10 ± 0,46 |
|
–32,14 % |
–16,90 % |
–16,12 % |
|
|
5-е |
3,93 ± 0,36 |
3,38 ± 0,16 |
4,25 ± 0,61 |
|
–38,97 % |
–32,80 % |
–30,10 % |
|
|
7-е |
3,66 ± 0,37 |
2,68 ± 0,14х# |
3,89 ± 0,51 |
|
–43,17 % |
–46,72 % |
–36,02 % |
|
|
9-е |
3,59 ± 0,34 |
1,65 ± 0,18х# |
3,35 ± 0,51 |
|
–44,25 % |
–67,20 % |
–44,90 % |
|
|
11-е |
3,53 ± 0,31 |
0,93 ± 0,13х# |
2,43 ± 0,37 |
|
–45,19 % |
–81,51 % |
–60,00 % |
|
|
13-е |
3,29 ± 0,18 |
0,60 ± 0,08х# |
1,15 ± 0,06х |
|
–48,91 % |
–88,07 % |
–81,09 % |
|
|
15-е |
2,73 ± 0,15 |
0,28 ± 0,03х# |
0,88 ± 0,08х |
|
–57,61 % |
–94,43 % |
–85,53 % |
|
|
17-е |
2,10 ± 0,05 |
0 ± 0 |
0,43 ± 0,05х |
|
–67,39 % |
–92,93 % |
||
|
19-е |
1,32 ± 0,07 |
0,10 ± 0,01х |
|
|
–79,50 % |
–98,36 % |
||
|
21-е |
0,67 ± 0,03 |
0 ± 0 |
|
|
–89,60 % |
|||
|
23-е |
0,12 ± 0,01 |
||
|
–98,14 % |
|||
|
25-е |
0 ± 0 |
||
Примечания:
х – изменения достоверны относительно контроля, р ≤ 0,05;
# – изменения достоверны относительно препарата сравнения, р ≤ 0,05;
∆ % – изменение площади линейных ран относительно их величины в первые сутки.
В первые сутки после начала лечения в контрольной группе животных визуально регистрировали гиперемию перифокальной зоны, края ран были умеренно инфильтрированы, отечны, раневая поверхность покрыта фибринозной пленкой; отмечали умеренное выделение серозного экссудата. В последующие сроки (на 4–6-е сутки) инфильтрация, отечность краев раны и экссудация сохранялись на том же уровне. На 17–19 сутки наблюдали отчетливую тенденцию к снижению воспалительной реакции. Полное заживление ран наступало на 25-е сутки.
В группе животных, которых лечили маслом бурачника, в первые сутки после начала лечения обнаружили слабовыраженную инфильтрацию, умеренную отечность краев ран, выделение скудного серозного экссудата. Обращал на себя внимание выраженный темп снижения воспалительных симптомов, к 5-м суткам отмечено полное купирование воспалительного синдрома. На 13-е сутки у всех крыс, которых лечили маслом бурачника лекарственного, отмечали отторжение корочек, на их месте сухую, розовую, нежную ткань, без следов кровотечения, полностью восстановившуюся к 17-му дню наблюдений.
Эффект масла бурачника реализуется в основном на 2 фазе раневого процесса, отмечается быстрое уменьшение площади раневой поверхности с 9-х суток. При использовании масла облепихи отмечалась относительно равномерная динамика уменьшения размеров раневого дефекта на протяжении всего периода наблюдения.
Заключение
Установлено, что масло семян бурачника лекарственного, интродуцированного в ботаническом саду Пятигорского медико-фармацевтического института, по микробиологической чистоте соответствует нормам, рекомендуемым ГФ ХII, обладает высокой антибактериальной активностью в отношении Staphylococcus aureus «Туре», Staphylococcus epidermidis Wood-46, Bacillus anthracoides-96 и ранозаживляющей активностью (укоряет срок заживления ран на 47,1 % относительно контроля и на 24,0 % – относительно препарата сравнения).



