Природные и синтетические цеолиты представляют класс каркасных алюмосиликатов щелочных и щелочноземельных металлов со связанной водой. Структура цеолитов состоит из системы связанных пор и каналов, что обеспечивает подвижность внекаркасных катионов и воды. Эти свойства цеолитов обусловили их широкое использование в качестве сорбентов.
С целью уменьшения негативного влияния горнорудной промышленности на окружающую среду активно изучаются свойства цеолитсодержащих пород (ЦСП) для очистки дренажных вод [3, 7, 10].
Клиноптилолитовые туфы являются одними из широко распространённых в природе ЦСП. Крупнейшее в России месторождение этого типа – Шивыртуйское – находится в Забайкалье [6]. Вулканогенно-осадочные туфы этого месторождения представляют диагенетическую ассоциацию клиноптилолита (до 90 %) и монтмориллонита (до 20 %) с небольшими количествами кварца, полевых шпатов, карбонатов. Свойства шивыртуйских пород описаны во многих работах [2, 4, 6, 7]. Главные минералы – цеолиты и смектиты характеризуются скрытокристаллическим строением, частично рентгеноаморфны.
Ранее было показано, что основными обменными ионами шивыртуйских пород при взаимодействии с водами карьера олово-полиметаллического месторождения Шерловая Гора являются катионы натрия [7]. Одним из элементов загрязнителей водотоков на территории остановленного рудника Шерловая Гора является цинк. Концентрация его, например, во временных дождевых водоёмах достигает нескольких граммов в литре.
Для улучшения сорбционных свойств алюмосиликатов часто используют различные способы их подготовки. Условно их можно разделить на физические и химические по методам воздействия. Например, для увеличения сорбционной ёмкости к газам используют нагревание цеолитов с целью удаления связанной воды. Широко применяются методы механического измельчения, воздействия электромагнитных полей и др. Химические методы модификации представляют замену катионов в результате ионного обмена [3]. Часто сорбенты обменивают ионами натрия, например, для повышения селективности к ионам аммония в сточных водах [8].
Целью настоящей работы является сравнение ионообменных свойств природного сорбента ЦСП Шивыртуйского месторождения (Ш) и натрий модифицированной его формы (Na-Ш) к катионам цинка в водных растворах.
Материалы и методы исследования
ЦСП, отобранные из карьера Шивыртуйского месторождения измельчались и просеивались. Кристаллическую структуру компонентов пород определяли методом порошковой дифрактометрии на дифрактометре Дрон-3 (CuKα – излучение) в АЦ ИЗК СО РАН г. Иркутск (аналитик Т.С. Филева). Для определения фаз глинистых минералов ориентированные образцы суспензий осаждались на стеклянную подложку и высушивались при комнатной температуре (ВС), также образец был насыщен этиленгликолем (ЭГ) и прокалён до 550 °С (Т). На дифрактограмме (рис. 1) цифрами отмечены пики клиноптилолита, структурно не совершенного монтмориллонита, кварца и полевых шпатов.
В экспериментах использовался класс размерностью – 1 + 0,5 мм. Предварительно образцы отмывали дистиллированной водой с отделением взвеси и высушивали при температуре 25 °C.
Модификацию сорбента катионами натрия осуществляли в растворе NaCl с концентрацией 10 г/л. Взаимодействие проводили в химических стаканах при соотношении 2 г сорбента и 100 мл раствора при перемешивании в течение 24 и 72 часов (T = 25 °C). Далее твёрдые фазы отмывали дистиллированной водой до отсутствия реакции на хлорид-ионы с нитратом серебра. Полученные образцы Na-Ш-24 и Na-Ш-72 высушивали при температуре 25 °C.
Сорбцию катионов цинка образцами Ш, Na-Ш-24, Na-Ш-72 проводили в химических стаканах в подкисленных HCl (pH = 4) растворах ZnCl2 с концентрацией 2 г/л при соотношениях 2 г сорбента на 100 мл раствора в течение 48 часов при 25 °C. Полученные образцы отмывались дистиллированной водой до отсутствия реакции на хлорид-ионы.
Химический состав сорбентов (табл. 1, 2) определяли в аккредитованной лаборатории ЗАО «СЖС Восток лимитед» (г. Чита) методом масс-спектрометрии c индуктивно связанной плазмой на спектрометре Perkin Elmer NexION 300D (США), путем плавки с пероксидом Na. Содержание натрия определяли методом ICP на атомно-эмиссионном спектрометре с индуктивно связанной плазмой Perkin Elmer Optima 5300DV (США), с разложением проб в смеси кислот (HCl, HF, HNO3, HClO4).
Количество воды в сорбентах (табл. 1, 2) определяли методом синхронного термического анализа на приборе STA 449 F1 Jupiter фирмы NETZSCH (Германия).
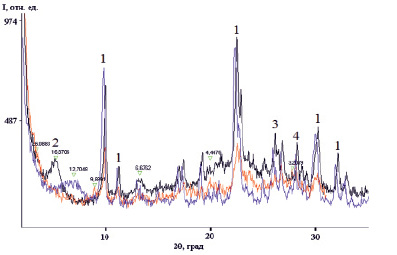
Рис. 1. Рентгеновская дифрактограмма Шивыртуйской ЦСП (Ш) в разных условиях подготовки ориентированного образца: синий – высушенный (ВС), черный с этиленгликолем (ЭГ), красный – прокалённый до 550 °C (Т). Пики 1 – клиноптилолит; 2 – смектит; 3 – кварц; 4 – полевой шпат. На рисунке приведены значения основных базальных расстояний монтмориллонита и гидрослюды [13]
Таблица 1
Химический состав сорбентов после Na-модификации
|
Компоненты, % |
SiO2 |
Al2O3 |
CaO |
MgO |
Na2O |
K2O |
H2O |
Zn, г/т |
|
Ш |
64,21 |
13,79 |
2,54 |
0,93 |
1,28 |
3,86 |
11,54 |
53 |
|
Na-Ш-24 |
64,00 |
13,03 |
1,68 |
0,96 |
1,73 |
3,37 |
10,55 |
53 |
|
Na-Ш-72 |
63,80 |
13,03 |
1,40 |
0,95 |
1,85 |
3,25 |
10,68 |
56 |
Таблица 2
Химический состав сорбентов после взаимодействия с раствором хлорида цинка
|
Компоненты, % |
SiO2 |
Al2O3 |
CaO |
MgO |
Na2O |
K2O |
H2O |
Zn, г/т |
|
Ш-Zn |
63,40 |
14,20 |
2,24 |
0,98 |
0,88 |
3,74 |
11,03 |
3510 |
|
Na-Ш-24-Zn |
63,80 |
14,30 |
1,82 |
0,98 |
1,27 |
3,50 |
10,91 |
6400 |
|
Na-Ш-72-Zn |
64,01 |
13,49 |
1,4 |
0,93 |
1,55 |
3,25 |
10,85 |
9150 |
Таблица 3
Количество E (мг-экв/г) обменных катионов сорбентов
|
Образцы сорбентов |
Eel |
E = ∑ Eel |
||||
|
Ca |
Mg |
Na |
K |
Zn |
||
|
Ш |
0,91 |
0,46 |
0,41 |
0,82 |
0,00 |
2,60 |
|
Na-Ш-24 |
0,60 |
0,48 |
0,56 |
0,72 |
0,00 |
2,36 |
|
Na-Ш-72 |
0,50 |
0,47 |
0,60 |
0,69 |
0,00 |
2,26 |
|
Ш-Zn |
0,80 |
0,49 |
0,28 |
0,79 |
0,11 |
2,47 |
|
Na-Ш-24-Zn |
0,65 |
0,49 |
0,41 |
0,74 |
0,20 |
2,49 |
|
Na-Ш-72-Zn |
0,50 |
0,46 |
0,50 |
0,70 |
0,28 |
2,44 |
Результаты исследования и их обсуждение
Теоретическая сорбционная ёмкость или полная ионообменная ёмкость цеолитов определяется как сумма мг-экв внекаркасных катионов (Ca, Mg, K, Na), приходящаяся на один грамм цеолита [2]. Её величину можно рассчитать по заряду алюмосиликатного каркаса:
E = Al*1000/Mr (мг-экв/г), (1)
где Mr – молекулярная масса (г), Al – коэффициент алюминия в стехиометрической формуле цеолита.
По данным табл .1, стехиометрическую формулу Ш в унифицированной для природных цеолитов форме [1] можно записать:
Ca0.034Mg0.017K0.061Na0.031(H2O)0.498 [Al0.202Si0.800O2]. (2)
По данным табл. 1–2, рассчитаем значения E (1) для обменных катионов сорбентов (табл. 3). Рассмотрим изменение содержаний внекаркасных катионов сорбента (Ш) при взаимодействии с раствором NaCl (рис. 2). Из рисунка можно видеть, что катионы кальция и калия из твёрдых фаз обмениваются на катионы натрия из раствора.
Содержание цинка в образцах сорбентов до взаимодействия с раствором цинка меньше кларка земной коры 80 г/т. Взаимодействие пород с раствором хлорида цинка характеризуется различной ионообменной активностью (рис. 3, 4). Для образца (Ш) сорбция цинка сопряжена с уменьшением внекаркасных катионов натрия, кальция и калия (рис. 3). Модифицированные натрием образцы в аналогичных условиях поглощают в два (рис. 4) и в три раза (рис. 5) больше цинка по сравнению с Ш. Обмен катионов цинка при этом в образцах Na-Ш-24 и Na-Ш-72 происходит только с натрием. Незначительные увеличения количеств Ca, Mg, K при сорбции цинка (рис. 4, 5) находятся в пределах ошибок методов аналитических определений элементов и округлений при формульных пересчётах.
Для формулы (2) теоретическая сорбционная ёмкость по (1) E = 2,70 (мг-экв/г) получается немного больше, чем для минерала клиноптилолита – Na3K3[Al6Si30O72]·24H2O, K = 2,16 (мг-экв/г). Формула (2) отличается от клиноптилолита отношением Al/Si, равным соответственно 0,25 и 0,20. Повышенное содержание Al для (2) можно связать с присутствием монтмориллонита – (Na,Ca)xAl2-x(Fe(II),Mg)xSi4O10(OH)2·nH2O, значение Al/Si которого выше, чем у клиноптилолита.
Из рис. 2–4 можно видеть, что катионы магния практически не участвуют в процессах ионного обмена. Предположим, что всё количество магния находится в октаэдрических слоях монтмориллонита [5]. В таком случае можно определить долю смектита по результатам силикатного анализа. Например, для сорбента Ш и формулы монтмориллонита Na0.3Ca0.35AlMgSi4O10(OH)2·3H2O содержание глины в породе составляет 9,9 % по массе.
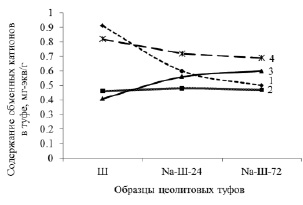
Рис. 2. Замещение обменных катионов при Na-модификации. 1 – Ca; 2 – Mg; 3 – Na; 4 – K
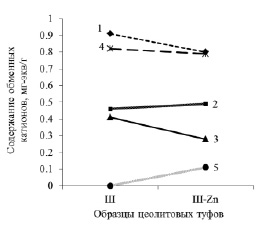
Рис. 3. Замещение обменных катионов при сорбции цинка. 1 – Ca; 2 – Mg; 3 – Na; 4 – K; 5 – Zn
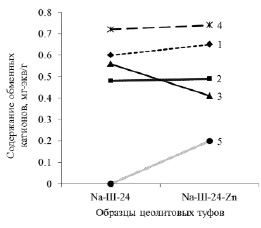
Рис. 4. Замещение обменных катионов при сорбции цинка. 1 – Ca; 2 – Mg; 3 – Na; 4 – K; 5 – Zn
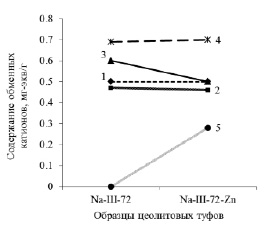
Рис. 5. Замещение обменных катионов при сорбции цинка. 1 – Ca; 2 – Mg; 3 – Na; 4 – K; 5 – Zn
Поглотительные свойства клиноптилолита и монтмориллонита сопоставимы с теоретическими и экспериментальными результатами работ [3, 9].
Сравнительный анализ экспериментальных изотерм сорбции клиноптилолитов, по данным разных авторов, приведённых в работе [8], показывает, что в среднем значения предельной сорбции цеолитов на половину ниже их теоретических ёмкостей, максимальным её величинам отвечают коммерческие образцы сорбентов. Сорбционная ёмкость шивыртуйских пород, экспериментально определённая в работе [2], составляет 1,83 (мг-экв/г).
Из табл. 2 видно, что максимальное количество цинка – около 9 мг на грамм сорбента характерно для образца Na-Ш-72.
Заключение
Модификация натрием природного цеолитового туфа приводит к увеличению его сорбционной активности к ионам цинка из водных растворов. Взаимодействие сорбентов в водных растворах хлорида натрия приводит к замещению кальция и калия в твёрдых фазах на натрий, что увеличивает поглотительную активность туфов к ионам цинка в несколько раз. При этом катионы натрия модифицированных сорбентов представляют основные обменные с цинком ионы. Экспериментально показано, что в одинаковых условиях сорбция цинка из растворов пропорциональна содержанию натрия в сорбенте. Участие катионов кальция и калия модифицированных туфов в ионном обмене незначительно. Индифферентность катионов магния в процессах сорбции позволяет предположить его нахождение в октаэдрических слоях смектитовых минералов, что дает возможность оценить содержание глинистых минералов в цеолитовом туфе по данным химического анализа.
Исследования поддержаны РФФИ и правительством Забайкальского края (проект № 14-05-98012 р_сибирь_а).



