Образование коллоидных и тонкодисперсных частиц в электролитах при нанесении металлов и сплавов и их влияние на свойства получаемых гальванических покрытий и механизм выделения металлов издавна привлекали внимание электрохимиков. В [8, 13] исследовали влияние коллоидов желатина, декстрина на катодную поляризацию при электроосаждении металлических покрытий и на свойства катодных осадков. В [8] предполагали включение ионов металла в объеме раствора в состав коллоидной мицеллы и выход их из мицеллы перед разрядом. В [13] полагали, что заряженные коллоидные частицы органических добавок могут образовывать в непосредственной близости от катода ориентированный диффузный слой, который затрудняет подход катионов металла к центру роста, повышая поляризацию при их выделении. Выравнивание металлических покрытий объясняли влиянием коллоидов, а ухудшение внешнего вида покрытий в присутствии коллоидов – слишком большой концентрацией частиц и образованием геля, захватываемого растущим покрытием. Коллоидные частицы, включающие осаждаемый металл, преимущественно частицы гидроксидов и основных солей металла, вызывают рост на катоде губчатых покрытий при плотностях тока выше и даже ниже предельного тока диффузии [10, 11]. При этом дисперсные частицы на катоде не восстанавливаются.
Закономерности возникновения коллоидов в катодных процессах разряда металлов изучены в [4]. Высказано предположение, что вблизи катода в процессе электролиза образуются коллоидные и тонкодисперсные соединения электроосаждаемого металла [14]. Образование на катоде металлического покрытия из движущихся к нему частиц наблюдали в тех случаях, когда в условиях электролиза возникают кинетически устойчивые дисперсные системы. Возникновение у катода золей коррелировало с наводороживанием металла. Каждая коллоидная и тонкодисперсная частица у поверхности катода рассматривается как микроэлектрод. Если такая частица подходит к поверхности катода, например, на расстояние 10–7 см, и разность потенциалов между катодом и коллоидной частицей достигает хотя бы 0,1 В, то градиент потенциала составляет 106 В/см, то есть между частицей и катодом возникает очень сильное электрическое поле. При электролизе концентрированных растворов солей металлов у катода также образуются коллоидные растворы, однако размер частиц слишком мал для наблюдения под ультрамикроскопом.
В [6] путем электронно-микроскопических исследований было установлено, что на поверхности блестящих осадков имеется нерастворимый гидроксид металла, а основным фактором получения блестящих осадков никеля является наличие в прикатодном слое коллоидного гидроксида этого металла, образующегося в процессе электролиза. В [5] при помощи ультрамикроскопа исследовали образование устойчивых коллоидных и тонкодисперсных соединений никеля в прикатодном пространстве различных электролитов никелирования. Образование и устойчивость коллоидных соединений никеля в электролитах никелирования исследовали также в [2, 16]. В [10] также считали, что в диффузионном слое возникают коллоидные соединения гидроксидов металла. Возникновение у катода коллоидных соединений является вторичным процессом, первопричиной которого являются изменения рН в диффузионном слое у электрода, из-за протекания параллельных реакций. Предполагалось, что под действием водорода или света коллоиды гидроксидов могут восстанавливаться до металла.
На основании исследования электролита никелирования Уоттса с различными добавками сделан вывод о влиянии дисперсности коллоидных частиц основных соединений никеля на качество получаемых осадков [3]. Качество осадков улучшалось по мере увеличения дисперсности коллоидных соединений никеля. Кроме того, было высказано предположение, что электроосажденный никель является результатом двух одновременно протекающих процессов: разряда ионов никеля и восстановления до металла атомарным водородом пленки гидроксида, образующегося в результате защелачивания прикатодного пространства. Образование высокодисперсных золей в прикатодном слое является одним из необходимых условий роста блестящих гальванопокрытий. Определяющая роль при образовании блестящих покрытий отведена «диффузионно-гидродинамическим факторам подвода (или отвода) ионов к поверхности электрода» через пленку гидроксидов металлов, образующуюся при подщелачивании примыкающего к катоду слоя раствора. Пленки гидроксидов коллоидного характера могут восстанавливаться на катоде.
В [9] экспериментально показана возможность восстановления коллоидных соединений металлов на катоде в форме компактного гальванопокрытия. Обнаружено, что в присутствии коллоидных частиц соединений электроосаждаемых металлов и при обеспечении условий двухфакторной теории блескообразования достигается высокий блеск покрытий. В [12] доказано существенное ускорение электроосаждения металлов и сплавов из электролитов, содержащих коллоидные и тонкодисперсные соединения металла. Впервые введен термин «электролиты-коллоиды», под которыми подразумеваются электролиты, в которых восстановление металла происходит не только из простых и комплексных ионов, но и путем восстановления коллоидных и тонкодисперсных соединений металла. Тонкодисперсные системы соединений металла, способные восстанавливаться на катоде, могут возникать как при приготовлении электролитов, так и при растворении анодов, а также и в результате протекания вторичных электродных процессов, например подщелачивания прикатодного пространства, обусловленного разрядом ионов водорода, или специально вводиться извне.
Эти представления можно перенести на системы тонких дисперсий соединений электроосаждаемого металла, которые подходят к катоду и восстанавливаются на нем вместе с ионами. Такие системы обеспечивают возможность возникновения равновесных и неравновесных электроповерхностных явлений, которые могут существенно увеличивать массоперенос по сравнению с предельным током диффузии. Это явления электроосмоса, электрофореза, возможно также диэлектрофореза, диполофореза, диффузиофореза, приводящие к возникновению потоков ионов, частиц и своеобразного эффективного размешивания прилегающей к катоду части диффузионного слоя, в которой очень низка скорость конвекции и которая представляет наибольшие затруднения для массопереноса. Считалось, что электроосмотические потоки и все явления, связанные с электроповерхностными силами в тонкодисперсных системах, могут наблюдаться только при концентрациях раствора, не превосходящих децинормальные. Однако в последнее время показано, что электроосмотическое течение растворов электролитов происходит до концентрации 1–2 моль/л [17]. Кроме того, в прикатодной части диффузионного слоя концентрация раствора может быть существенно ниже, чем в объеме [15].
В состав большинства современных электролитов, применяющихся в гальванотехнике, входят различные комбинации добавок, обеспечивающие блеск покрытий, выравнивание и другие ценные свойства электролитов и покрытий. Среди них – сложные органические катионы и анионы с высокой поверхностной активностью, лиофильные коллоиды и полимерные поверхностно-активные вещества (ПАВ). Вещества подобного рода при определенной их концентрации могут даже в концентрированных растворах электролитов служить эффективными стабилизаторами коллоидных частиц соединений металлов. Некоторые ПАВ, применяемые в гальванотехнике, заведомо являются эффективными стабилизаторами дисперсий. В связи с этим при приготовлении электролитов, содержащих такие ПАВ, при растворении анодов или при подщелачивании прикатодных слоев в них могут возникать устойчивые дисперсные системы соединений восстанавливающегося на катоде металла. Эти высокодисперсные системы могут участвовать в катодном процессе формирования металлических покрытий.
В качестве основного компонента для разработки электролита никелирования выбран хлорид никеля. В таких электролитах наблюдается меньшая тенденция к коагуляции золей и образованию наростов на покрытиях. Кроме того, преимуществами хлоридных растворов, по сравнению с сульфатными, являются их высокая электропроводность, хорошее растворение в них анодов. Устойчивость в присутствии хлорида никеля золей и тонких взвесей гидроксидов и основных солей никеля в прикатодном слое и положительный заряд коллоидных и микрогетерогенных частиц может привести к изменению свойств покрытий и к интенсификации процесса электролиза.
Используя метод математического планирования экстремальных экспериментов, разработан хлоридный электролит состава, г/л: хлорид никеля шестиводный 200–350; сульфат никеля семиводный 3–7, борная кислота 25–40, хлорамин Б 1–3, КОБ 3–8 мл/л. При рН 1,0–5,5 и температуре 18–60 °С рабочие пределы катодной плотности тока составляют 0,5–110 А/дм2 [1].
Важными характеристиками никелевых покрытий являются: степень блеска, микротвердость, внутренние напряжения, адгезия, коррозионная стойкость, равномерность распределения по поверхности сложнопрофилированных деталей, пористость и т.д. В связи со спецификой восстановления на катоде коллоидных и тонкодисперсных частиц соединений никеля по сравнению с разрядом из ионов можно ожидать включения в никелевое покрытие, особенно при низких плотностях тока, невосстановившихся молекул соединений никеля, входящих в состав дисперсной частицы. Это может привести к изменению свойств покрытий. Микротвёрдость покрытий с повышением катодной плотности тока от 5 до 15 А/дм2 при температуре электролита 60 °С сначала повышается, а затем снижается при увеличении катодной плотности тока до 110 А/дм2. Такой же ход зависимости наблюдается при температуре 21 °С (рис. 1).
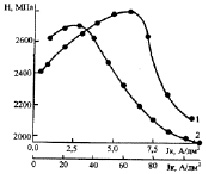
Рис. 1. Зависимость микротвёрдости никелевых покрытий от катодной плотности тока в электролите основного состава при рН 1,0 и температурах, °С: 1 – 21; 2 – 60
Для традиционных электролитов, в которых разряд металла происходит из его ионов, такая зависимость является необычной. Однако для электролита, высокая производительность которого объясняется особым механизмом восстановления вместе с ионами коллоидных и тонкодисперсных соединений электроосаждаемого металла, такая зависимость микротвердости покрытий от плотности тока является косвенным доказательством специфики катодного процесса. Если еще не достигнут потенциал восстановления тонкодисперсных частиц или потенциал восстановления уже достигнут, но из-за полидисперсности частиц восстановление происходит не полностью, то повышается количество включений в покрытие. Это изменяет структурно-чувствительные свойства. При достижении потенциала полного восстановления коллоидных и тонкодисперсных соединений никеля и при их монодисперсности количество включений невосстановившихся частиц в покрытие снижается, поэтому наблюдается снижение величины микротвёрдости.
Зависимость внутренних напряжений (Вн) никелевых покрытий, осажденных из электролита основного состава с рН 1,0, от катодной плотности тока и температуры электролита показана на рис. 2. Измерения производили в момент окончания электролиза. Наблюдали напряжения растяжения. Ход приведенной на рис. 2 зависимости такого структурно-чувствительного свойства, как Вн, подтверждает сказанное выше об изменениях микротвердости покрытий в электролитах, содержащих коллоидные и тонкодисперсные соединения электроосаждаемого металла.
Режимы электролиза (катодная плотность тока, рН и температура электролита) влияют на блеск покрытий так, как это показано на рис. 3.
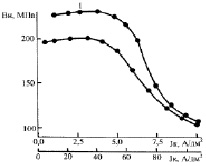
Рис. 2. Зависимость Вн никелевых покрытий от катодной плотности тока в электролите основного состава при рН 1,0 и температурах, °С: 1 – 21; 2 – 60. Толщина покрытий 12 мкм
Согласно двухфакторной теории блескообразования [9] для получения блестящих покрытий необходимы два условия:
1) образование в прикатодном слое коллоидных частиц типа [Ме·А]КОЛЛ (где Ме – ион металла, А – анион), которые обладают свойствами восстанавливаться водородом или электронами катода;
2) должны быть созданы силы, которые выстраивают восстанавливающиеся коллоидные частицы по форме фазовой поверхности жидкость 1 – жидкость 2. При этом жидкость 1 – электролит в объеме, а жидкость 2 – слой электролита у катода, где вязкость повышена благодаря присутствию дисперсных частиц. Силы поверхностного натяжения на этой границе и создают жидкоподобную поверхность блестящих покрытий.
Увеличение блеска покрытий с увеличением температуры электролита связано с увеличением степени гидролиза электролита и формированием слоя у катода с повышенной частичной концентрацией. По-видимому, частицы при этих температурах становятся более тонкодисперсными. Однако при температуре выше 70 °С может происходить разложение органических добавок-стабилизаторов тонкодисперсных систем, придающих устойчивость подвижной системе пор в трудноразмешиваемой части диффузионного слоя. Это способствует разрушению этой системы и резкому снижению степени блеска формирующихся никелевых покрытий. Кроме того, с повышением рабочей плотности тока из-за выделения на катоде совместно с никелем водорода в прикатодных слоях повышается рН. При рН выше определенного значения (в зависимости от температуры, состава и концентрации компонентов в электролите и т.д.) достигается рНГ никеля. Это приводит к образованию слишком крупных частиц гидроксидов и основных солей и к разрушению фазовой поверхности более вязкого слоя (жидкость 2) у поверхности электрода. При этом исчезает второй фактор, способствующий блеску гальванических покрытий по [9]. Нарушается также гидродинамический режим у поверхности растущего блестящего покрытия. Особый гидродинамический режим создается электроповерхностными явлениями в подвижной системе пор у катода при одновременном восстановлении вместе с ионами металла тонкодисперсных частиц его соединений.
Максимальный блеск никелевых покрытий наблюдается примерно при тех же плотностях тока, что и максимальная микротвердость. Это указывает на существенные изменения в слое электролита, прилегающего к катоду при этих режимах электролиза. Сцепление никелевых покрытий с основой из стали, меди и ее сплавов удовлетворяет ГОСТ 9.302-88.
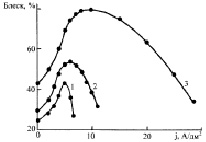
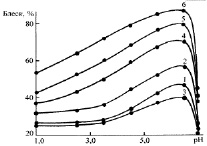
Рис. 3. Зависимость блеска никелевых покрытий от катодной плотности тока в электролите основного состава при рН 3,0 и температурах, °С: 1 – 20; 2 – 40; 3 – 60. Зависимость блеска никелевых покрытий от рН электролита в электролите основного состава при температурах, °С: 1, 2, 3 – 20; 4, 5, 6–60 и плотностях тока, А/дм2: 1, 3 – 2,0; 2, 4 – 4,0; 3, 5 – 6,5
Измерения рассеивающей способности (РС) хлоридного электролита никелирования (по методу Херринга и Блюма) производили в зависимости от катодной плотности тока, состава электролита и режима электролиза. РС в данных растворах почти не отличается от РС применяемых в промышленности сульфатно-хлоридных электролитов блестящего никелирования и находится в пределах 8–25 %.
При электроосаждении блестящих никелевых покрытий в промышленности в основном используются электролиты, работоспособные только при повышенных температурах (45–65 °С). Это приводит: к увеличению энергетических затрат, к ускорению испарения электролита из ванны и потому требует постоянной корректировки электролита, дополнительного времени на разогрев ванны до нужной температуры, постоянного контроля температуры электролита и т.д. Разработанный электролит работает как при повышенной температуре, так и при комнатной.
Выводы
1. Разработан хлоридный электролит блестящего никелирования. Данный электролит имеет более широкий рабочий диапазон температур и рН электролита, чем в широко используемых в промышленности сульфатно-хлоридных электролитах.
2. Исследованы физико-механические свойства покрытий (микротвердость, внутренние напряжения, пористость, сцепление, блеск). Изучена рассеивающая способность электролита. Показано, что при увеличении катодной плотности тока значения микротвердости, Вн, пористости, блеска проходят через максимум.



