Известно, что в результате метаболических превращений веществ в организме человека образуются токсичные свободные радикалы кислорода [1]. Они образуются в реакциях перекисного окисления липидов, при метаболизме различных препаратов, воздействии внешних факторов (действие ультрафиолета, ионизирующее облучение). Образовавшись в организме, они вступают во взаимодействие со структурами клетки, приводя в конечном счете к поражению мембран клеток, сопутствуя, таким образом, развитию патологического процесса при многих заболеваниях. В норме регуляция продукции активированных кислородных метаболитов и свободных радикалов в тканях и органах человека осуществляется многоуровневой физиологической антиоксидантной системой, которая включает в себя соединения различной химической природы: витамины, пигменты, гормоны, ферменты [2]. Несмотря на высокую эффективность антиоксидантной системы, она не всегда способна защитить организм человека от развития оксидантного стресса. В связи с этим одним из приоритетных направлений свободнорадикальной биохимии и медицины является создание препаратов, обладающих антиоксидантными свойствами, с целью применения их для профилактики и лечения заболеваний, сопровождающихся усилением свободнорадикальных реакций. Широкие перспективы для практического использования в качестве лекарственных препаратов антиоксидантного действия представляют биологически активные вещества природного происхождения, например вещества алкалоидов хинолизидинового ряда. Интерес к исследованиям по химической модификации и свойствам алкалоида цитизина обусловлен широким спектром биологической активности производных цитизина [3, 4]. В этой связи получение новых производных алкалоида цитизина, исследование их структуры и фармакологической активности является актуальной задачей современной химии и медицины.
Цель исследования
Осуществить синтез и изучить антиоксидантную активность О,О-диметил-N-цитизинилфосфата (цитафата) в отношении кислородных радикалов методом катодной вольтамперометрии.
Материалы и методы исследования
ИК спектр снимали на спектрометре с Фурье-преобразователем AVATAR-320 Nicolet в таблетках с KBr. Спектр ЯМР1Н записан на спектрометре Bruker 400 (400 МГц) в растворе ДМСО-d6 относительно внутреннего стандарта – ТМС. Температуру плавления вещества определили на приборе Boetius.
Синтез О,О-диметил-N-цитизинилфосфата. К смеси 2,86 г диметилфосфита и 24,6 г четыреххлористого углерода в 100 мл абсолютного бензола прикапывали при температуре 0–10 °С смесь 5 г цитизина и 2,63 г триэтиламина в 100 мл абсолютного бензола. Затем смесь перемешивали в течение 5 ч при комнатной температуре. Отфильтровывали и промывали гидрохлорид триэтиламина, отгоняли растворитель. Получили 5,6 г (72,1 %) продукта (перекристаллизация из бензола) с т.пл. 156 °С.
Исходные растворы исследуемых веществ с концентрацией 0,1 г/мл готовили следующим образом: на аналитических весах взвешивали 0,5 г образца и растворяли в 5 мл. Далее растворы с концентрацией 0,01 г/мл и 0,001 г/мл готовили последующим разбавлением дистиллированной водой в пенициллиновых флаконах объемом 10 мл.
Для исследований брали объем аликвоты 0,1 мл, соответственно концентрация исследуемых растворов представлена в таблице.
Методика эксперимента заключалась в съемке вольтамперограмм катодного ЭВ О2 с помощью вольтамперометрического анализатора, подключенного совместно с ПК [5]. Использовался постоянно-токовый режим катодной вольтамперометрии, скорость развертки потенциала W = 30 мВ/с, рабочий диапазон потенциалов от 0,0 до – 0,7 В, время перемешивания раствора 20 сек, время успокоения 10 сек. Электрохимическая ячейка представляла собой стеклянный стаканчик с раствором фонового электролита и опущенными в него индикаторным ртутно-пленочным электродом, хлорид-серебряным электродом сравнения и хлорид-серебряным вспомогательным электродом. В качестве фонового раствора выбран фосфатный буфер с рН 6,86, близким к физиологическому значению, объемом 10 мл.
Результаты исследования и их обсуждение
С целью поиска и изучения свойств новых биоактивных веществ на основе алкалоида цитизина нами осуществлен синтез О,О-диметил-N-цитизинилфосфата (цитафата) в условиях реакции Тодда-Атертона. Синтез O,O-диметил-N-цитизинилфосфата осуществляли взаимодействием О,О-диметилфосфита с цитизином в среде абсолютного бензола в присутствии четыреххлористого углерода и триэтиламина по следующей схеме:
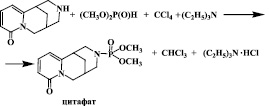
Синтезированный целевой продукт представляет собой белое кристаллическое вещество, легко растворим в воде, спирте, ацетоне и хлороформе, практически не растворим в эфире.
В ИК спектре данного соединения присутствуют интенсивные полосы поглощения, характерные для фосфорильной группы (Р=О) при 1265–1270 см-1, а в области 1025–1050 см-1 – для Р-О-С-группы.
При анализе ЯМР1Н спектра цитафата три группы сигналов низкого поля соответствуют протонам α-пиридинового ядра. Сигналы при 7,30 м.д. соответствуют β-протону. Расщепленный дублет при 6,09 м.д. соответствует γ-протону, а расщепленный дублет при 6,36 м.д. – α-протону. Следующая группа линий, представляющая собой сложный сигнал в области 3,81–4,12 м.д., соответствует аксиальному и экваториальному протонам в положении С10. Эта группа сигналов является АВ-частью системы АВХ, где Х – протон в положении С9. Экваториальный протон при С10 смещен в более слабое поле по сравнению с аксиальным. Группа линий в области 3,52–3,60 м.д. представляет собой сигналы пяти протонов, находящихся при С11, С13, и третичного протона С7. Протоны метокси-группы у атома фосфора неэквивалентны, и они проявляются в области 3,30 и 3,44 м.д. в виде двух расщепленных дублетов. Два третичных протона в положениях С7 и С9 у метиленового мостика не эквивалентны, так как протон при С7 находится в α-положении к двойной связи и подвержен влиянию анизотропии к ней, вследствие чего смещен в более слабое поле (δ 3,03–3,10 м.д.) относительно протона С9. А широкий сигналет в области 2,43 м.д. принадлежит протону С9. Группа линий в области 1,91–2,03 м.д. относится к протонам при С11 и С13.
Продолжая исследования фармакологической активности О,О-диметил-N-цитизинилфосфата, изучили его антиоксидантную активность с применением вольтамперограмм катодного ЭВ О2 с помощью вольтамперометрического анализатора при различных концентрациях.
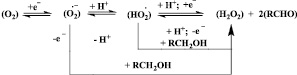
Активность образцов определяли, используя метод катодной вольтамперометрии, в частности процесс электровосстановления кислорода (ЭВ О2). Модельная реакция ЭВ О2 протекает на электроде по механизму, аналогичному восстановлению кислорода в тканях и клетках организма:
О2 + е– 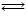 О2˙- (1)
О2˙- (1)
О2˙- + Н+ 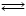 HO2˙ (2)
HO2˙ (2)
HO2˙ + Н+ + е- 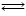 Н2О2 (3)
Н2О2 (3)
Н2О2+ 2Н+ + 2е- 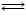 2Н2О (4)
2Н2О (4)
В данном случае рассматривается первая волна ЭВ О2 (восстановление кислорода до пероксида водорода) с образованием активных кислородных радикалов: О2-, НО2-× (выражения 1–3). Предполагается, что вещества реагируют с кислородом и его активными радикалами на поверхности индикаторного электрода, что отражается в изменении катодного тока ЭВ О2 [6].
Активность исследуемого вещества по отношению к ЭВ О2 определялась по следующей методике: снимались вольтамперограммы тока ЭВ О2 в отсутствии исследуемого вещества (фоновая кривая) по описанному выше способу. При отсутствии посторонних пиков фоновый раствор считался чистым. Затем в ячейку добавлялось исследуемое вещество с известной концентрацией (брали объем аликвоты 0,1 мл на 10 мл объема фонового электролита) и снималась катодная вольтамперограмма ЭВ О2 при тех же условиях. Измерения повторялись не менее 3 раз через определенный промежуток времени (180 с) и каждый раз оценивалось значение предельного тока ЭВ О2.
Изменение тока ЭВ О2 по своему абсолютному значению свидетельствует о том, что исследуемые образцы реагируют с кислородом и его активными радикалами в исследуемом растворе. Степень изменения тока ЭВ О2 являлась показателем активности исследуемого образца.
По полученным данным строилась зависимость относительного изменения тока ЭВ О2 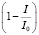 от времени протекания процесса в присутствии одной концентрации исследуемого образца.
от времени протекания процесса в присутствии одной концентрации исследуемого образца.
По линейной части графика и по тангенсу угла наклона касательной к данному участку кривой рассчитывался коэффициент активности образцов – K, мкмоль/(л×мин) по формуле:
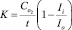 , (5)
, (5)
где Со2 – концентрация кислорода в исходном растворе без вещества, мкмоль/л;
Ii – текущее значение предельного тока ЭВ О2, мкА;
Iо – значение предельного тока ЭВ О2 в отсутствии вещества в растворе, мкА;
t – время протекания процесса, мин.
Для исследуемого вещества получена однотипная вольтамперограмма, наблюдалось уменьшение катодного тока ЭВ О2, что свидетельствует о проявлении ими антиоксидантной активности по отношению к данному процессу. Кроме того, наблюдался сдвиг потенциала катодного тока ЭВ О2 в положительную область потенциалов. Все вышесказанное предполагает наличие механизма ЕС (электрохимическая – химическая стадии), который включает последующую химическую реакцию взаимодействия антиоксидантов с активными кислородными радикалами.
При этом общая схема электродного процесса с последующими химическими реакциями взаимодействия антиоксидантов с активными кислородными радикалами будет выглядеть следующим образом:
Антиоксидантная активность О,О-диметил-N-цитизинилфосфата по отношению к ЭВ О, с различной концентрацией (n = 5, p = 0,95)
|
Концентрация вещества |
Среднее значение, K, мкмоль/л мин |
Стандартное отклонение, S |
Относительное стандартное отклонение, Sr |
Стандартное отклонение среднего, Sx |
Доверительный интервал, δ |
|
0,00001 г/мл |
0,183 |
0,032 |
0,174 |
0,019 |
0,05 |
|
0,0001 г/мл |
0,280 |
0,012 |
0,043 |
0,007 |
0,02 |
|
0,001 г/мл |
0,399 |
0,045 |
0,113 |
0,026 |
0,07 |
Антиоксидантную активность определяли, используя выражение (5) (см. таблицу).
Выводы
Осуществлен синтез и изучено влияние О,О-диметил-N-цитизинилфосфата на процесс электровосстановления кислорода в различных концентрациях. В качестве метода оценки применена катодная вольтамперометрия на ртутно-пленочном электроде. В данном подходе определение антиоксидантной активности отражало количество активных форм кислорода, нейтрализованных антиоксидантом за определенное время. Показано, что водный раствор цитафата проявляет антиоксидантную активность.
Эксперименты выполнены при поддержке гранта РФФИ, проект № 15-04-01110.



