В настоящее время увеличивается число людей, страдающих туберкулезом с множественной лекарственной устойчивостью. По данным ВОЗ ежедневно около 1000 человек в европейском регионе заражаются туберкулезом, в том числе мультирезистентным, и только 50 % из них удается успешно вылечить. Ситуация требует расширения доступа к безопасным и эффективным препаратам, а также инновационного подхода к экспресс-диагностике и лечению туберкулеза, исходя из каждого индивидуального случая [6].
Современная фармакотерапия туберкулеза предусматривает комплексное использование специфических антибактериальных препаратов и лекарственных средств разных фармакологических групп (иммуномодуляторов, гормональных препаратов, муколитических средств и др.). К препаратам 1 ряда, являющимся основными химиотерапевтическими средствами для лечения различных форм туберкулеза, относятся изониазид, его производные, антибиотики, пара-аминосалициловая кислота и ее производные. Основные препараты, особенно в виде комбинаций, применяют преимущественно при впервые выявленном туберкулезе. Курс лечения составляет от 3-х до 6-ти месяцев. Вместе с тем необходимо учитывать, что действие противотуберкулезных препаратов сопровождается обычно побочными эффектами, выраженность которых может возрастать при их одновременном применении [3].
Изучение фармакокинетики химиотерапевтических препаратов особенно важно в процессе химиотерапии туберкулеза, так как для достижения эффекта необходимо длительное лечение, что может привести к повышению чувствительности к применяемым лекарственным веществам. Кроме того, процесс лечения требует постоянного контроля за содержанием противотуберкулезных препаратов в крови, распределением их в организме и выведением для предотвращения передозировки. Это особенно актуально при нарушении функции почек, так как в этих случаях может наблюдаться задержка выведения противотуберкулезных средств и их кумуляция. Во многих случаях необходимо индивидуализировать дозы лекарственных препаратов с учетом их растворимости, всасываемости, интенсивности инактивации, скорости выведения, что зависит от активности фермента N-ацетилтрансферазы (NAT). Под действием фермента происходит биотрансформация (в частности, процесс ацетилирования) противотуберкулезных лекарственных средств, что приводит к увеличению растворимости получаемых метаболитов в воде и ускоренному выведению из организма почками.
Метаболизм изониазида представлен на схеме:
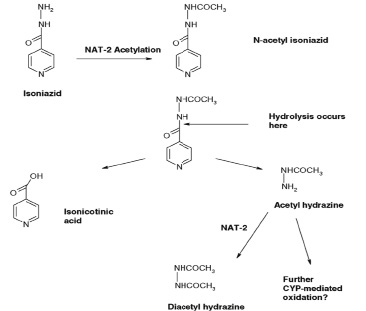
Следует отметить, что активность NAT у разных людей генетически отличается, поэтому метаболизм может быть или быстрым или медленным. Знание относительной индивидуальной активности NAT может позволить оптимизировать режимы дозирования противотуберкулезных лекарственных средств и оценить риск их воздействия на организм. Активность фермента NAT можно определить косвенным методом по исследованию фармакокинетики тест-препарата ацетилирования – изониазида.
Для количественного определения изониазида в субстанции ГФ XII издания рекомендует объемный метод кислотно-основного титрования в неводных средах, используя его основные свойства. Навеску лекарственного средства титруют хлорной кислотой в среде ледяной уксусной кислоты и уксусного ангидрида [2]. Метод связан с достаточно большими временными затратами, с необходимостью использования летучих агрессивных реактивов, а также имеются ограничения его применения для токсико-кинетических исследований.
На сегодняшний день существуют другие способы детектирования содержания тест-препарата ацетилирования – изониазида методами масс-спектрометрии, высокоэффективной жидкостной хроматографии, флуориметрии. Однако эти методы имеют ряд существенных недостатков, таких как высокая стоимость, методическая сложность и длительность проведения исследования [4, 5].
Таким образом, актуальной является разработка экспрессной методики количественного определения данного лекарственного средства в субстанции, обладающей высокой чувствительностью. Она позволит провести количественное определение изониазида не только в лекарственных формах, но и в биологических жидкостях организма человека (моча), что необходимо при фармакокинетических исследованиях с целью определения активности фермента NAT.
Целью нашего исследования является разработка простой в использовании, экспрессной и валидизированной методики количественного определения изониазида не только в фармацевтических субстанциях, но и в биологических объектах. В основе спектрофотометрического метода количественного определения в видимой области спектра, была использована реакция изониазида с метаванадатом аммония в среде хлороводородной кислоты. Реакция основана на способности соединений ванадия (V) образовывать окрашенные комплексы с органическими лигандами, имеющими в своей структуре определенные функциональные группы, содержащие атомы азота и кислорода (гидразидная группа).
Для достижения поставленных целей необходимо решить следующие задачи:
1. Осуществить выбор рабочей длины волны.
2. Определить линейную зависимость между концентрацией фармацевтической субстанции к оптической плотности продукта реакции с аммония ванадатом.
3. Установить время устойчивости окраски.
4. Определить чувствительность реакции с целью возможности использования её при химико-токсикологических исследованиях.
5. Определить диапазон подчинения продукта реакции основному закону светопоглощения.
6. Провести количественное определение изониазида в фармацевтической субстанции, лекарственной форме и биологической жидкости (моче).
Материалы и методы исследования
Все исследования проводили на фотометре КФК-3 в кюветах с толщиной оптического слоя 10 мм при комнатной температуре. В анализе использовали рабочий стандартный образец (РСО) изониазида (ФС 42-0236-07). Приготовление стандартного рабочего раствора: 0,12 г изониазида (точная навеска) помещали в мерную колбу емкостью 100 мл, растворяли в воде, доводили водой до метки, тщательно перемешивали. 25 мл полученного раствора переносили в мерную колбу емкостью 100 мл, доводили водой до метки, тщательно перемешивали.
Статистическую обработку экспериментальных данных исследований (р = 95 %) проводили с помощью программ StatSoft Statistica 6,0, Microsoft Excel с вычислением граничных значений доверительного интервала среднего результата и определением ошибки единичного определения [1].
Результаты исследования и их обсуждение
Для выбора рабочей длины волны готовили раствор изониазида с концентрацией 0,0003 г/мл. По истечении 5 минут измеряли оптическую плотность окрашенного продукта реакции при разных длинах волн, относящихся к видимой области спектра (380 нм – 780 нм).
Спектр поглощения раствора изониазида в видимой области имеет максимум при длине волны 430 нм. При той же длине волны проводили измерения оптической плотности испытуемых растворов и растворов сравнения.
Результаты определения устойчивости окраски во времени представлены в табл. 1. Из данных таблицы видно, что в течение 30 минут окраска оставалась устойчивой.
Для выявления линейной зависимости между концентрацией фармацевтической субстанции изониазида и оптической плотностью продукта его реакции с метаванадатом аммония готовили ряд разведений в широком диапазоне концентраций – от 0,0012 г/мл до 0,0027 г/мл. Проведенные исследования позволяют сделать заключение, что в выбранном интервале концентраций изониазида наблюдается подчинение закону Бугера – Ламберта – Бера.
Относительная погрешность определения находилась в пределах точности спектрофотометрического анализа.
Минимальная концентрация изониазида, определяемая по этой методике, составляет 0,0012 г/мл, что свидетельствует о возможности ее применения не только для анализа фармацевтических препаратов, но и для определения изониазида в биологических объектах.
Следующим этапом исследования явилось определение содержания изониазида в фармацевтической субстанции и лекарственной форме. Определение проводили в сравнительном аспекте с раствором стандартного образца, поскольку данный метод определения является более точным, надежным и отвечает требованиям Государственной Фармакопеи XII издания. Полученные результаты представлены в табл. 2.
Как следует из приведенных в таблице данных, полученные результаты укладываются в нормы допустимых отклонений.
Таблица 1
Зависимость оптической плотности окрашенного комплекса от времени
|
Объем раствора изониазида и его концентрация, г/мл |
Длина волны, нм |
Оптическая плотность |
|||||
|
5 мин |
10 мин |
15 мин |
20 мин |
25 мин |
30 мин |
||
|
6 мл; 0,0018 г/мл |
430 |
0,458 |
0,458 |
0,457 |
0,457 |
0,456 |
0,455 |
Таблица 2
Результаты определения изониазида в фармацевтической субстанции и лекарственной форме
|
№ опыта |
Объект исследования |
Найдено |
Нормы допустимых отклонений |
Метрологическая характеристика |
|
1 2 3 4 5 |
Фармацевтическая субстанция изониазида |
99,98 100,20 99,96 99,98 99,98 |
Не менее 99,9 %, не более 101,0 % |
Хср = 100,02 S = 0,1009 Sxср = 0,4512 Ε = 0, 0125 εa = 100,02 ± 1,25 |
|
1 2 3 4 5 |
Таблетки изониазида по 0,3 г |
0,292 0,299 0,300 0,292 0,299 |
[0,285÷0,315] |
Хср = 0,297 S = 0,0041 Sxср = 0,0018 Ε = 0,017 εa = 0,297 ± 0,017 |
Валидация методики показала, что данная методика не отягощена грубой и системной ошибкой, является правильной и позволяет получить воспроизводимые результаты.
Разработанная методика была применена в химико-токсикологическом исследовании изониазида в моче в качестве биологической жидкости.
Для приготовления модельной смеси использовали образец мочи, полученный от здорового добровольца. При этом в течении месяца до отбора проб человек не принимал лекарств. Модельные смеси мочи готовили путем добавления к ней определенного объема стандартного раствора изониазида с концентрацией 0,0003 г/мл. Приготовленные смеси выдерживали в течение 24 часов при комнатной температуре.
Изучено влияние окраски реактива метаванадата аммония и мочи на величину молярного коэффициента поглощения комплекса изониазида с метаванадатом аммония. Для этого были получены спектры метаванадата аммония, смеси метаванадата аммония с мочой и образца мочи. Как показали исследования, при длине волны, равной 430 нм, влияние реагента незначительно и его можно нивелировать, если включить все компоненты в раствор сравнения при спектрофотометрическом определении в видимой области спектра. Количественное определение изониазида в моче проводили спектрофотометрическим методом по методике, разработанной для фармацевтической субстанции исследуемого лекарственного средства. Определение изониазида в моче оценивалось методом «введено – найдено». Предел обнаружения изониазида при указанных условиях спектрофотометрического определения – 0,6 мг/мл.
Выводы
Разработана методика количественного определения изониазида в фармацевтической субстанции, лекарственной форме и биологической жидкости спектрофотометрическим методом в видимой области спектра. Показана возможность использования данной методики в дальнейших химико-токсикологических исследованиях.



