В последнее время возрос интерес к новым производным пиразолов в связи с проявлением такими соединениями различных видов биологической активности [5–7]. Среди них выделяются такие известные препараты, как анальгин, амидопирин и бутадион. Недавно были получены нитрозопиразолы, содержащие в своем составе этоксиметильную группу [1, 2]. Мы продолжили исследования в области применения реакции циклоароматизации замещенных β-дикетонов с гидразином и получили нитрозопиразол с метоксиметильной группой, а на его основе впервые синтезировали аминопиразол с метоксиметильным заместителем. Выбор данного направления обусловлен тем, что использование лекарственных веществ со спиртовой или карбоксильной группой в виде их сложных или простых эфиров изменяет полярность молекулы и улучшает проявление фармакологической активности [3].
Цель исследования
Разработка метода синтеза новых потенциально биологически активных производных пиразолов с метоксиметильным заместителем. Выделение и идентификация новых изонитрозодикетонов и пиразолов. Изучение физико-химических свойств синтезированных соединений.
Материалы и методы исследования
Структура полученных соединений подтверждена спектральными методами анализа. УФ-спектры записывали на спектрофотометре HELIOS OMEGA в этаноле. Спектры ЯМР 1Н регистрировали в ДМСО-d6 на приборе Bruker Avance III 600,13 МГц. ИК-спектры получены на ИК-микроскопе SpecTRA TECH InspectIR на базе ИК Фурье-спектрофотометра Impact 400. Элементный анализ выполняли на автоматическом CHNS-анализаторе EURO EA 3000 [4]. Взвешивание образцов производилось на весах Sartorius CP2P (Германия). Ход реакции и чистоту соединений контролировали методами ТСХ на пластинах Silufol UV-254 в системе этилацетат-толуол (1:3), пятна детектировали в ультрафиолетовом свете.
Результаты исследования и их обсуждение
Для решения поставленной цели мы конденсировали по Кляйзену метилметоксиацетат с ацетофеноном под действием этоксида натрия в тетрагидрофуране по методике [8]. В результате был получен 4-метокси-1-фенилбутан-1,3-дион (схема 1).
При нитрозировании 1-фенил-4-метоксибутандиона-1,3 нитритом натрия в уксусной кислоте согласно методике [1] был выделен ранее не известный 1-фенил-4-метоксибутан-1,2,3-трион-2-оксим (I) в виде кристаллов белого цвета с четкой температурой плавления (схема 2).
В ЯМР 1Н спектре 1-фенил-4-метоксибутан-1,2,3-трион-2-оксима присутствуют сигналы протонов группы СН3 метоксизаместителя в виде синглета с хим. сдвигом 3,34 м.д., сигнал протонов группы СН2 метиленового заместителя в виде синглета с хим. сдвигом 4,73 м.д., сигналы протонов фенильного заместителя в виде мультиплета с хим. сдвигом 7,58–7,83 м.д., сигнал протона группы NОН в области слабого поля с хим. сдвигом 13,15 м.д. в виде синглета (рис. 1).
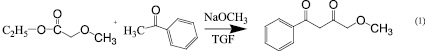
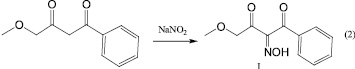
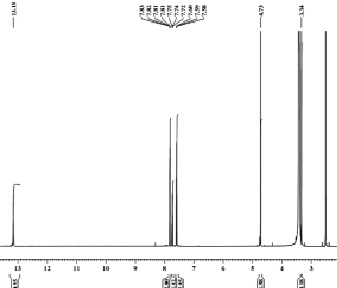
Рис. 1. ЯМР 1Н спектр 1-фенил-4-метоксибутан-1,2,3-трион-2-оксима
В ИК-спектре синтезированного 1-фенил-4-метоксибутан-1,2,3-трион-2-оксима присутствуют две характерные полосы сильных валентных колебаний соответствующих карбонильных групп, одна из которых связана с бензольным кольцом (поглощает в области 1666 см-1), а другая, алифатическая, в области 1703 см-1.
Для синтеза метоксиметилнитрозопиразола изонитрозодикетон вводили в реакцию с гидразингидратом в водно-щелочной среде. Новый фенилнитрозопиразол с метоксиметильным заместителем был выделен в виде кристаллов синего цвета с четкой температурой плавления (схема 3).
В ЯМР 1Н спектре 3-метоксиметил-4-нитрозо-5-фенил-1Н-пиразола присутствуют сигналы протонов группы СН3 метоксизаместителя в виде синглета с хим. сдвигом 3,34 м.д., сигнал протонов группы СН2 метиленового заместителя в виде синглета с хим. сдвигом 4,38 м.д., сигналы протонов группы фенильного заместителя в виде мультиплета с хим. сдвигом 7,6–8,24 м.д., сигнал протона пиразольного кольца с хим. сдвигом 14,26 м.д. в виде синглета (рис. 2).
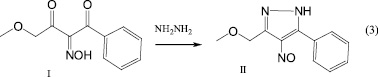
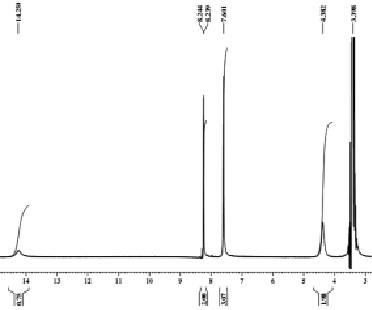
Рис. 2. ЯМР 1Н спектр 3-метоксиметил-4-нитрозо-5-фенил-1Н-пиразола
Синтезированный нитрозопиразол II восстанавливали гидразингидратом на катализаторе Pd\C 0.5 % в среде дихлорметана. В результате был впервые получен 3-этоксиметил-4-амино-5-фенил-1Н-пиразол в виде кристаллов белого цвета с четкой температурой плавления (схема 4).
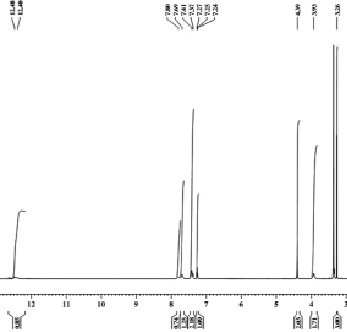
Рис. 3. ЯМР 1Н спектр 3-метоксиметил-4-амино-5-фенил-1Н-пиразола
В ЯМР 1Н спектре 3-метоксиметил-4-амино-5-фенил-1Н-пиразола присутствуют сигналы протонов группы СН3 метоксизаместителя в виде синглета с хим. сдвигом 3,26 м.д., сигналы протонов группы СН2 метиленового заместителя в виде синглета с хим. сдвигом 3,93 м.д., сигналы протонов группы NH2 в виде синглета с хим. сдвигом 4,39 м.д., сигналы протонов фенильного заместителя в виде мультиплета с хим. сдвигом 7,24–7,8 м.д., сигнал протона пиразольного кольца с хим. сдвигом 12,4 м.д. в виде синглета (рис. 3).
4-метокси-1-фенилбутан-1,2,3-трион-2-оксим (I). К раствору 6,9 г (35 ммоль) 4-метокси-1-фенилбутан-1,3-диона в 30 мл ледяной уксусной кислоты при охлаждении и перемешивании добавляли 2,73 г (39 ммоль) сухого нитрита натрия. Нитрит натрия добавляли порциями, чтобы температура смеси была не выше 16 °С. Реакционную массу перемешивали 4 ч, разбавляли 200 мл воды и экстрагировали диэтиловым эфиром. Эфирный слой сушили сульфатом натрия и упаривали в выпарной чашке. Остаток промывали гексаном и перекристаллизовывали из воды. Выход 4-метокси-1-фенилбутан-1,2,3-трион-2-оксима составил 3,65 г (46 %), вещество белого цвета, т.пл. 129–130 °С. ИК-спектр (тонкий слой), ν, см–1: 1668 (C=O), 1703 (C=O), 1117 (COC). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 3,34 с (3Н, СН3), 4,73 с (2Н. СН2), 7,58–7,83 м (5Н, Ph), 13,15 с (1Н, NOH). Найдено, %: С 59,35; Н 4,78; N 6,25. С11H11NO4. Вычислено: С 59,73; Н 5,01; N 6,33.
3-метоксиметил-4-нитрозо-5-фенил-1Н-пиразол (II). К раствору 3,2 г (14 ммоль) 4-метокси-1-фенилбутан-1,2,3-трион-2-оксима в 180 мл 7 % раствора КОН в воде, при перемешивании добавляли 1,456 г (29 ммоль) гидразингидрата. После перемешивания в течение 50 минут при 20 °С раствор подкисляли 5 % H2SO4 до pH = 4. Выпадал осадок синего цвета. выход 1,94 г (64 %), синие кристаллы, т.пл. 128–130 °С (EtOH). УФ-спектр, λмакс, нм (ε): 237 (16310), 319 (9500), 685 (55). ИК спектр (тонкий слой), ν, см–1: 1110 (COC). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 3,34 с (3Н, СН3), 4,38 с (2Н, СН2), 7,6–8,24 м (5Н, Ph), 14,26 с (1Н, NH). Найдено, %: С 60,94; Н 5,05; N 18,94. С11H11N3O2. Вычислено: С 60,82; Н 5,10; N 19,34.
4-амино-3-метоксиметил-5-фенил-1-Н-пиразол (III). В 30 мл CH2Cl2 растворяли 1,06 г (5 ммоль) 3-метоксиметил-4-нитрозо-5-фенил-1Н-пиразола. Добавляли 0,03 г палладия на угле 0,5 % и при интенсивном перемешивании по каплям 0,825 мл (20 ммоль) гидразингидрата. Через 30 минут отфильтровывали катализатор, фильтрат упаривали. Выход 0,88 г (87 %). Белые кристаллы, т. пл. 89–90 °С (EtOH). УФ-спектр (EtOH): λ макс., нм (lg ε): 204 (4,34), 279 (3,92). ИК-спектр (тонкий слой), ν, см–1: 3370 (NH2), 1071(COC). Спектр ЯМР 1Н (600 МГц, ДМСО-d6), δ, м. д.: 3,26 с (3H, СН3), 3,93 с (2H, СН2), 7,24–7,8 м (5Н, Наром), 4,39 с (2H, NH2), 12,4 с (1H, NH). Найдено, %: С 64,16; 6,32; N 20,29. С11H13N3O. Вычислено: С 65,01; Н 6,45; N 20,68.
Выводы
1. В ходе проведенного исследования был впервые получен 4-метокси-1-фенилбутан-1,2,3-трион-2-оксим.
2. Синтезирован ранее не известный 3-(метоксиметил)-4-нитрозо-5-фенил-1Н-пиразол.
3. Впервые выделен 4-амино-3-метоксиметил-5-фенил-1Н-пиразол.
4. Индивидуальность соединений подтверждена с помощью ТСХ, а химическая структура – современными спектральными данными.



