В последние годы в связи с ростом резистентности многих бактерий и вирусов к известным антимикробным препаратам заметно вырос интерес к разработке новых супрамолекулярных систем, обладающих антимикробными свойствами [1–5]. Поиск новых стратегий борьбы с микроорганизмами, обладающими множественной лекарственной устойчивостью, является актуальной задачей. Многие авторы представляют фотодинамическую инактивацию микроорганизмов одним из перспективных альтернативных подходов в этой области, число исследований и публикаций в которой растет с каждым годом. В качестве фотосенсибилизирующих агентов в этих случаях используют макрогетероциклические соединения и их комплексы [13]. Авторы работы [11] показали антибактериальную активность фталоцианинов кобальта против патогенных бактерий Xanthomonas citri и Xanthomonas Compstris. В работе [10] исследовано антимикробное действие протопорфирина кобальта против золотистого стафилококка.
Цель исследования. Синтез супрамолекулярных донорно-акцепторных аксиальных комплексов (окта(3,5-ди-трет-бутилфенокси)фталоцианинато) кобальта (II) с биоактивными органическими основаниями (пиридин, пиразин), модификация поверхности полипропиленовой пленки (ПП) синтезированными соединениями и выявление их антибактериальной/противогрибковой активности.
Материалы и методы исследования
(Окта(3,5-ди-трет-бутилфенокси)фталоцианинато)кобальта (II) CoPc(3,5-di-tBuPhO)8 (рис. 1) был синтезирован по реакции между ацетатом кобальта (II) и соответствующим органическим лигандом (H2Pc(3,5-di-tBuPhO)8) в кипящем диметилформамиде и очищен колоночной хроматографией (силикагель/CH2Cl2). ЭСП (толуол) λmax nm (lg ε): 304 (4,76); 340 (4,72); 607 (4,45); 646 (4,53); 673 (5,17). ИК спектр (KBr), ν, cm–1: 2964, 2905, 2868, 1608, 1588, 1524, 1457, 1415, 1363, 1348, 1297, 1274, 1246, 1198, 1145, 1095, 1052, 961, 903, 864, 836, 756, 726, 707. 1H ЯМР (400 MHz; δ, ppm; CDCl3): δ = 8,94 (s, 8 H), 8,03 (s, 8 p-H), 7,29 (s, 16 o-H), 1,35 (s, 144 tert-butyl-H) ppm. Найдено: C 76,79; H 7,47; N 5,23 %; C144H176N8O8Co вычислено: C 78,4; H 8,04; N 5,08 %. Масс спектр (MALDI-TOF): m/z = 2203 [M]+.
Реакция аксиальной координации CoPc(3,5-di-tBuPhO)8 с органическими основаниями (L = Py, Pyz) была изучена при 298 K в толуоле спектрофотометрически, использовался метод молярных отношений. Готовили серию растворов в толуоле с постоянной концентрацией фталоцианинового комплекса (5,0•10–6 моль/л) и различными концентрациями органического основания (0–0,56 моль/л).
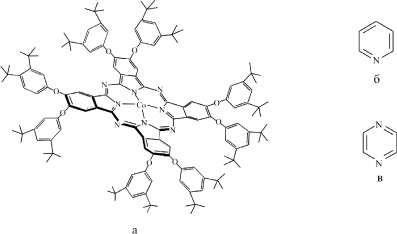
Рис. 1. Структурные формулы CoPc(3,5-di-tBuPhO)8 (а), пиридина (б) и пиразина (в)
Константы устойчивости донорно-акцепторных комплексов (Kу) определяли по уравнению (1) для трехкомпонентной равновесной системы:
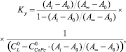 (1)
(1)
где 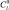 ,
, 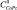 – начальные концентрации органического основания и CoPc(3,5-di-tBuPhO)8 в толуоле соответственно; А0, Аi, А∞ – оптические плотности при рабочей длине волны для фталоцианина кобальта, равновесной смеси при определенной концентрации молекулярного лиганда и аксиального донорно-акцепторного комплекса. Количество присоединяемых молекул органического основания определяли как тангенс угла наклона прямой lgI – lgCL где I – индикаторное отношение, определяемое по уравнению I = (Ai – A0)/(A∞ – Ai).
– начальные концентрации органического основания и CoPc(3,5-di-tBuPhO)8 в толуоле соответственно; А0, Аi, А∞ – оптические плотности при рабочей длине волны для фталоцианина кобальта, равновесной смеси при определенной концентрации молекулярного лиганда и аксиального донорно-акцепторного комплекса. Количество присоединяемых молекул органического основания определяли как тангенс угла наклона прямой lgI – lgCL где I – индикаторное отношение, определяемое по уравнению I = (Ai – A0)/(A∞ – Ai).
Концентрации растворов аксиальных комплексов фталоцианина кобальта с основанием для модификации полипропиленовой пленки соответствовали условиям окончания титрования исходного фталоцианина кобальта раствором органического основания (в точках эквивалентности).
Оценку биоцидного эффекта осуществляли по воздействию модифицированной синтезированными супрамолекулярными комплексами CoPc(3,5-di-tBuPhO)8 с биоактивными основаниями полипропиленовой пленки (ПП) на грамположительные (Staphylococcus aureus), грамотрицательные (Escherichia coli) бактериальные культуры, а также дрожжеподобные грибы рода кандида (Candida albicans) на плотных и в жидких питательных средах.
Для проведения эксперимента был использован традиционный метод оценки антимикробной активности пленок. Пленки были помещены на поверхность плотных питательных сред в чашках Петри, засеянных «методом газона» испытуемым тест-микробом. После 24-часового термостатирования при температуре 37 °С определяли величину зоны задержки роста вокруг образцов пленок. Испытания образцов пленок в жидкой питательной среде включали учет роста бактерий и грибов через 24 часа инкубации пробирок с мясопептонным бульоном (МПБ), тест-культурой и образцом пленки в термостате при 37 °С. Определяли изменение мутности среды в сравнении с контролем, с последующим высевом микроорганизмов из жидкой питательной среды на чашки Петри с плотными питательными средами, их инкубацией в термостате при 37 °С 24 часа и подсчетом колониеобразующих единиц – КОЕ. Кроме того, количество выросших микроорганизмов оценивали спектрофотометрически по изменению мутности раствора, которая увеличивалась/уменьшалась при росте/гибели микроорганизмов. Затем на основании сравнения оптической плотности растворов определяли процент роста культуры.
Испытанию подвергали исходную полипропиленовую пленку и пленку, обработанную испытуемыми супрамолекулярными системами. Проявление антимикробных свойств исследуемых образцов изучали как при обычном освещении, так и при действии УФ облучения (365 нм) в течение 2 минут (антимикробная фотодинамическая терапия).
Результаты исследования и их обсуждение
Электронная абсорбционная спектроскопия является наиболее удобным и распространенным методом для изучения процессов координации органических молекул на макрогетероциклических комплексах металлов. Образование аксиальных комплексов за счет донорно-акцепторного взаимодействия металл – донорный атом органического основания сопровождается смещением и изменением интенсивности основных полос в ЭСП комплекса.
Реакция CoPc(3,5-di-tBuPhO)8 с пиридином и пиразином изучена в широком диапазоне концентраций оснований. Молекулы Py и Pyz обладают, наряду с σ-донорными, π-акцепторными свойствами и хорошо совмещаются с фталоцианиновым макроциклом в одной координационной сфере, что предопределило выбор органических биоактивных оснований. Кроме того, пиридин является структурным фрагментом ряда биологически активных соединений – витаминов, антибиотиков, алкалоидов, продуктов метаболизма. Пиразин и его производные обладают гербицидной и антибиотической активностью. Пиразиновый цикл входит в состав некоторых феромонов, антибиотиков (аспергилловая кислота), антивирусных, антибактериальных, противоопухолевых (эхиномицин) лекарственных препаратов.
При добавлении органического основания к толуольному раствору CoPc(3,5-di-tBuPhO)8 в ЭСП наблюдается постепенное уменьшение интенсивности и гипсохромный сдвиг длинноволновой полосы. В случае координации Py величина сдвига Q-полосы составляет 9 нм, а в случае Pyz – 1 нм (рис. 2). Как видно из рис. 2, ЭСП продуктов реакции не претерпевают принципиальных изменений и по-прежнему характеризуют координированный кобальтом (II) макроциклический хромофор. Установленная экспериментально обратимость спектральных изменений свидетельствует о протекании реакции CoPc(3,5-di-tBuPhO)8 с пиразином и пиридином до состояния равновесия. По тангенсу угла наклона линейной зависимости lgI от lgcL (рис. 3) определено число присоединившихся лигандов. Образовавшиеся в ходе реакции соединения представляют собой супрамолекулярные донорно-акцепторные комплексы состава 1:1.
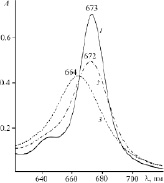
Рис. 2. Электронные спектры поглощения CoPc(3,5-di-tBuPhO)8 в толуоле (1), в смеси толуол-пиразин (СPyz = 0,56 моль/л) (2) и толуол-пиридин (СPy = 0,49 моль/л) (2)
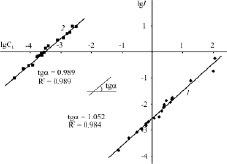
Рис. 3. Зависимости lgI от lgCL для реакции CoPc(3,5-di-tBuPhO)8 с пиразином (1) и пиримидином (2)
Полученные данные позволяют описать изучаемую реакцию уравнением
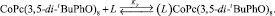 (2)
(2)
Константы устойчивости CoPc(3,5-di-tBuPhO)8 с пиридином и пиразином, рассчитанные по уравнению (1), составляют (3,42 ± 0,47)•103 и (4,63 ± 0,9)•102 л/моль соответственно.
Образование донорно-акцепторных комплексов CoPc(3,5-di-tBuPhO)8 с Py и Pyz подтверждено данными ИК и 1Н ЯМР спектроскопии. В ИК спектре продукта реакции (2) наблюдается высокочастотный сдвиг интенсивных полос изоиндольных фрагментов фталоцианина кобальта в области 1440–1450 см–1. Эти спектральные изменения в результате координации органического основания с кобальтфталоцианином разумно связать с выходом Со из плоскости макроцикла. Такие внеплоскостные смещения должны будут внести изменения в перекрывание dπ-орбиталей металла и еg*-орбиталей фталоцианина, приводя к изменениям энергии колебаний изоиндольных фрагментов фталоцианина. В ИК спектрах (Py)CoPc(3,5-di-tBuPhO)8 и (Pyz)CoPc(3,5-di-tBuPhO)8 наблюдаются также новые полосы, соответствующие колебаниям координированного пиридина (при 1742, 1492, 1408, 1216, 801, 779, 735, 518 см–1) и координированного пиразина (при 1737, 881, 807), частоты которых смещены примерно на 5–20 см–1 по сравнению с чистым Py и Pyz [7] соответственно. Новые сигналы при 397 и 464 см–1 соответствуют связи Co-NPy [12].
Диамагнитный комплекс CoPc(3,5di-tBuPhO)8 имеет спектр 1H ЯМР с четко разделенными сигналами протонов бензольных остатков и 3,5-ди-трет-бутильных групп в области от 8,94 до 7,29 ppm и 1,35 ppm. Введение в раствор комплекса в CDCl3 пиридина сопровождается появлением двух новых относительно узких сигналов пиридинового кольца при 7,7 и 7,4 ppm, которые претерпевают небольшой сильнопольный сдвиг по сравнению с сигналами некоординированного пиридина [8]. Наиболее заметно влияние на сигналы расположенных близко к макроциклу протонов изоиндольных групп. В спектре CoPc(3,5-di-tBuPhO)8 протоны изоиндольных групп проявляются в виде синглета с химическим сдвигом 8,94 ppm. Для комплекса с пиридином данные протоны проявляются в виде уширенного синглета в области 8,86 ppm. Сигналы пара-протонов фенильных колец претерпевают лишь небольшой сильнопольный сдвиг, тогда как сигналы орто-протонов фенильных групп не смещаются, возможно, по причине расположения фенильных колец вне плоскости макроцикла. Аналогичные изменения наблюдаются и при координации пиразина.
(Окта(3,5-ди-трет-бутилфенокси)фталоцианинато)кобальт (II) и донорно-акцепторные супрамолекулы на его основе были нанесены на полипропиленовые пленки с целью исследования их актибактериальных/противогрибковых свойств. В результате испытаний образцов пленок на плотной питательной среде установлено, что исследуемые образцы пленок не подавили рост тест-культур Staphylococcus аureus, Escherichia coli и грибов Candida albicans. Зон задержки роста вокруг образцов не выявлено, что связано в первую очередь с тем, что синтезированные соединения не растворимы в водных средах и не мигрируют в окружающую среду. Можно говорить лишь о факте задержки роста тест-культур под некоторыми образцами.
Результаты испытаний образцов в жидких питательных средах с последующим высевом демонстрируют данные, полученные при испытаниях на плотных питательных средах (сплошной рост тест-культур – 1000 КОЕ/мл – посевная доза) в отношении Escherichia coli и грибов Candida albicans. В отношении Staphylococcus aureus выявлено отсутствие роста у образца полипропиленовой пленки, модифицированной супрамолекулярным комплексом (Pyz)CoPc(3,5-di-tBuPhO)8 и минимальный рост (45 КОЕ) в случае образца (Py)CoPc(3,5-di-tBuPhO)8 при их предварительном облучении (рис. 4).
Следующим этапом исследования антибактериальной/противогрибковой активности являлась оценка с помощью счетного спектрофотометрического метода. На основании сравнения оптической плотности растворов определяли процент задержки роста культуры (таблица).
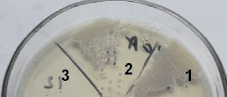
Рис. 4. Результаты воздействия полипропиленовой пленки, модифицированной комплексами на основе CoPc(3,5-di-tBuPhO)8, в течение 24 часов на жизнедеятельность микроорганизмов Staphylococcus aureus: 1 – контрольный образец; 2 – CoPc(3,5-di-tBuPhO)8 + УФ; 3 – (Pyz)CoPc(3,5-di-tBuPhO)8 + УФ
Влияние химической структуры комплексов на антибактериальную/противогрибковую активность
|
Образцы ПП пленки, модифицированные синтезированными соединениями |
Подавление роста культуры, % |
||
|
Staphylococcus aureus |
Escherichia coli |
Candida albicans |
|
|
Контроль |
0 |
0 |
0 |
|
Контроль + УФ |
5 |
3 |
0 |
|
CoPc(3,5-di-tBuPhO)8 |
52 |
0 |
29 |
|
CoPc(3,5-di-tBuPhO)8 + УФ |
68 |
20 |
37 |
|
(Py)CoPc(3,5-di-tBuPhO)8 |
66 |
5 |
32 |
|
(Py)CoPc(3,5-di-tBuPhO)8 + УФ |
82 |
17 |
35 |
|
(Pyz)CoPc(3,5-di-tBuPhO)8 |
71 |
10 |
33 |
|
(Pyz)CoPc(3,5-di-tBuPhO)8 + УФ |
93 |
10 |
38 |
Полученные данные свидетельствуют о том, что синтезированные супрамолекулярные комплексы не проявляют антибактериальную активность относительно кишечной палочки Escherichia coli. По балльной системе данные соединения можно оценить в 2 балла, что соответствует незначительному снижению количества микроорганизмов, указывая на недостаточное антимикробное действие [6]. Также наблюдается только незначительный противогрибковый эффект по отношению к Candida albicans. Максимальный процент подавления роста культуры проявляют CoPc(3,5-di-tBuPhO)8 и (Pyz)CoPc(3,5-di-tBuPhO)8 при предварительном УФ облучении образцов (λ = 356 нм) в течение 2 минут. Синтезированные соединения на основе (октакис3,5-ди-трет-бутилфенокси)фталоцианинато)кобальта (II) показывают наилучшее антибактериальное действие по отношению к Staphylococcus aureus. В 3 балла (90–94 %), что соответствует значительному снижению количества микроорганизмов (хороший антимикробный эффект), можно оценить действие донорно-акцепторного комплекса (Pyz)CoPc(3,5-di-tBuPhO)8, при предварительном УФ облучении (λ = 356 нм) в течение 2 минут. Без облучения наблюдается недостаточное антимикробное действие (таблица). Возможно, такое избирательное антибактериальное/противогрибковое действие на различные микроорганизмы связано со строением последних. Грамотрицательные бактерии обладают высокоорганизованной внешней мембраной по сравнению с грамположительными бактериями, что создает более высокий барьер для проникновения фотосенсибилизаторов в клетки [9].
Таким образом, установлено, что синтезированные супрамолекулярные аксиальные комплексы на основе окта(3,5-ди-трет-бутилфенокси)фталоцианинато)кобальта (II), иммобилизированные на поверхности полипропилена, обладают антибактериальным действием против золотистого стафилококка (Staphylococcus aureus) только при активации макрогетероциклического агента УФ светом (λ = 356 нм). В случае грамотрицательных бактерий Escherichia coli антибактериальный эффект практически не наблюдается. Относительно Candida albicans исследуемые донорно-акцепторные системы обладают слабовыраженным противогрибковым действием.
Полученные супрамолекулярные системы на основе окта(3,5-ди-трет-бутилфенокси)фталоцианинато)кобальта(II) могут быть перспективными для создания антибактериальных материалов нового поколения, которые могут использоваться не только в сфере медицины, но и в других областях, где необходимы средства профилактики и защиты от воздействия бактерий.
Заключение
1. Проведено исследование антимикробных свойств образцов пленок на фирмикутных бактериях Staphylococcus aureus, грациликутных бактериях Escherichia coli и грибах Candida albicans на плотных средах и в жидких питательных средах. По результатам испытаний установлено, что на плотных питательных средах исследуемые образцы не проявляют антимикробной активности. Зоны задержки роста тест-культур вокруг исследуемых образцов не выявлены, но под некоторыми образцами рост микроорганизмов отсутствовал.
2. Результаты испытаний образцов в жидких питательных средах с последующим высевом подтвердили данные, полученные при испытаниях на плотных питательных средах (сплошной рост тест-культур – 1000 КОЕ/мл – посевная доза) в отношении Escherichia coli и грибов Candida albicans. В отношении Staphylococcus aureus выявлено отсутствие роста у образца (Pyz)CoPc(3,5-di-tBuPhO)8 и минимальный рост (45 КОЕ) – у образца (Py)CoPc(3,5-di-tBuPhO)8 при предварительном УФ облучении.
Работа выполнена на оборудовании Центра коллективного пользования «Верхневолжский региональный центр физико-химических исследований» и при финансовой поддержке гранта РФФИ № 15-43-03013-р-центр-а).



