Горнодобывающая промышленность является источником образования большого количества отходов, не только твердых (отвалы, хвосты), но и жидких природно-техногенных (подотвальные и рудничные воды). Значительные объемы вод и высокие концентрации в них цинка позволяют рассматривать этот вид отходов в качестве сырья для извлечения металла. Переработка цинксодержащих природно-техногенных вод позволит более полно использовать природные ресурсы. В микрокомпонентном катионном составе подотвальных и рудничных вод горных предприятий Южного Урала преобладают железо, медь и цинк. В макрокомпонентном анионном составе преобладает сульфат-ион. Концентрация цинка достигает 1800 мг/дм3. Ежегодно с техногенными водами только Учалинского ГОКа безвозвратно теряется 372,29 т цинка. Используемые сегодня технологии переработки таких вод преимущественно направлены на извлечение меди. В настоящее время эффективные технологии, позволяющие селективно извлекать цинк в виде товарного продукта, отсутствуют.
Наиболее перспективно для переработки цинксодержащих техногенных вод использовать метод гальванокоагуляции с применением гальванопары «железо-углерод» и «алюминий-углерод». Эффективность данного метода обусловлена простотой аппаратурного оформления, дешевизной используемых материалов, а также возможностью селективного извлечения ионов цинка из высокоминерализованных кислых растворов.
В работе использованы общенаучные и специальные методы исследования. При реализации экспериментов применяли комплекс физических и физико-химических методов: химический, рентгенофазовый, элементный электронный, минералографический, рН-метрия, термодинамический, симплекс-центроидный методы анализа. Измерение контрольных параметров исследуемых процессов проводилось с использованием стандартных методик. Обработку экспериментальных данных проводили на основе методов математической статистики с применением программного обеспечения Statistika 6.0 и Microsoft Excel.
Основная задача работы заключается в исследовании закономерностей и механизма гальванокоагуляционного извлечения цинка из техногенных гидроресурсов и оптимизации технологических параметров для селективного извлечения цинка в продукт с массовой долей металла выше нижнего предела рентабельной металлургической переработки.
Для уточнения механизма перевода растворенных металлов в твердую фазу более детально изучено распределение ионных форм цинка, присутствующих в сульфатном растворе. Термодинамическим моделированием системы «Zn2+–SO42–Н2O–Н+–ОH–» с изменением температуры от 4 до 30 °С и концентрации цинка от 10 до 2000 мг/дм3 сульфат иона и гидроксил иона от 10 до 2000 мг/дм3 установлено, что в диапазоне значений рН 1,2–4,3 цинк находится в форме Zn2+ (99,8–99,9 %). При рН 4,6–6,5 цинк находится в форме Zn2+ (92,4–99,8 %) и Zn(OH)+ (0,2–7,6 %). Результаты термодинамического расчета коррелируют с мембранным анализом, которым установлено, что в металлоносных водах с рН 2,5–4,5 для цинка основной формой миграции является растворенная, в которой находится 92,4–99,5 % металлов, а железо с содержанием от 36 до 64 % находится во взвешенной форме.
Распределение цинка по ионным формам учтено при термодинамическом анализе приоритетности протекания реакций в гальванокоагуляционной системе «Fe0(анод) – Н+– Zn2+ – SO42– – Н2O – ОH– – C0(катод)», для которой в межэлектродном пространстве существует градиент значений рН.
Расчеты показали, что наиболее энергетически выгодными реакциями, после реакции (1) с участием негидратированных ионов, является окислительно-восстановительная с участием тригидроксокомплексного катиона железа (реакция (2)) и ионов двухвалентного железа и цинка:
реакция 1
2Fe2+ + Zn2+ + 2H+ + 5O2– = = ZnFe2O4 + H2O+2е –1039,40 ?G, кДж/моль;
реакция 2:
2[Fe3(OH)4]5+ + 3Zn2+ + 4O2– = = 3ZnFe2O4 + 8H+ – 806,30 ?G, кДж/моль.
Анализом состава цинксодержащих соединений в образующейся на поверхности катодной частицы пленке на рентгенограмме зафиксированы отражения, принадлежащие фазам ZnFe2O4, ZnO и Zn(OН)2, а также – следы элементного цинка.
Теоретическое обоснование параметров селективного выделения цинка из раствора в присутствии меди проведено с применением программного комплекса «селектор С» методом минимизации свободной энергии в гетерогенной многокомпонентной системе, включающей компоненты гальванопары и модельного стока. Матрица просчета для системы CuSО4–Cu(OH)2–ZnSО4, Zn(OH)2–Fe–С–О2–H2SО4–Н2О состояла из 7 независимых и 125 зависимых компонентов, в том числе 39 твердых фаз и 77 компонентов водных растворов электролитов. Установлено, что в области значений характерных для кислых вод горных предприятий в зависимости от кислотности и соотношения железо-кислород, медь в равновесном осадке находится в виде феррита, гидроксосульфата, цементной меди и оксида. Цинк переходит в осадок в виде феррита, а селективное осаждение и отделение цинка от меди с образованием нерастворимых цинксодержащих соединений термодинамически наиболее вероятно в окислительных условиях при рН равновесных растворов выше 5,2 и Eh 0,57–0,60 В и концентрации сульфатов менее 0,045 моль/дм3. Теоретическая массовая доля цинка в селективных осадках, полученных в оптимальных областях параметров при пересчете фазового состава в элементный, составила от 6,28 до 11,78 %. С увеличением концентрации кислорода в системе содержание цинка в осадке увеличивается. При рН жидкой фазы в системе 6,5 и соотношении Fe:O2 = 1:1 теоретическая массовая доля феррита цинка в осадке составляет 43 %, а при соотношении Fe:O2 = 1:1,5 составляет 76 %.
Предварительная аэрация раствора сульфата цинка приводит к его помутнению в результате образования коллоидного гидроксида цинка, что подтверждено результатами фазового анализа выпадающего осадка.
При анализе влияния рН на показатели гальванокоагуляционного извлечения ионов цинка установлено, что с увеличением исходного значения рН раствора с 5,2 до 6,5 возрастает извлечение ионов цинка с 75 до 87 %, массовая доля цинка увеличивается с 5,5 до 6,78 % и наблюдаются максимальные значения удельного выхода осадка и массовой доли цинка. Максимальное извлечение ионов цинка характерно для области рН более 8,5. Это объясняется протеканием процесса кислотно-основного осаждения ионов цинка в виде гидроксида Zn(OH)2. Следовательно, для гальванокоагуляционного извлечения цинка оптимальная область рН обрабатываемых растворов от 5,2 до 6,5.
Изучением кинетических закономерностей изменения массовой доли цинка в осадке в зависимости от исходной концентрации установлено, что при гальванокоагуляционном процессе оптимальное время извлечения цинка составляет 20 минут.
В результате проведенного эксперимента по плану Бокса и Уилсона 23 получено уравнение регрессии, адекватно описывающего исследуемую область. В качестве факторов эксперимента приняты: х – рН; х2 – концентрация ионов цинка, мг/дм; х3 – время, мин. Предполагаемые наилучшие значения факторов эксперимента, то есть нулевые уровни, таковы: х10 = 4, х20 = 400 мг/дм3, х30 = 12 мин. Выбраны следующие шаги варьирования факторов: Dх1 = 1,5; Dх2 = 100 мг/дм3; Dх3 = 3 мин. Интервалы варьирования факторов х1, х2 и х3 (хjo ± Dхj) приняты такими, при которых заметно изменяется массовая доля цинка.
Уравнение модели процесса с кодированными факторами эксперимента имеет вид
Массовая доля цинка в осадке, полученном в лабораторном эксперименте на гальванокоагуляционной установке в области оптимальных параметров процесса составляет 6,8–8,7 %.
По результатам лабораторных исследований отработаны оптимальные режимы двухстадиальной гальванокоагуляционной технологии извлечения меди и цинка с последующей доочисткой воды. Технология включает гальванокоагуляционную обработку воды с рН 2–3,5 в течение 4–6 минут в поле гальванопары «железный скрап: кокс» = 3:1 для перевода меди в ферритный осадок, отстаивание слива с подачей флокулянта «Магнафлок» с расходом 0,7 г/м3 в течение 30–45 мин, подщелачивание обезмеженной осветленной воды до рН 5,2–6,2, и аэрацию в течение 20–25 мин с расходом воздуха 5 м3/м3 в мин, гальванокоагуляционную обработку подготовленной обезмеженной воды в течение 14–16 мин в поле гальванопары железный скрап: кокс = 1:1 для перевода цинка в ферритный осадок и отстаивание слива с подачей флокулянта «Магнафлок» с расходом 1,0 г/м3 в течение 30–45 мин, фильтрование осветленной воды после второй стадии через двухслойную загрузку цеолит Н = 400 мм и известняк Н = 700 мм со скоростью 3,0–3,4 м/ч.
Проведенные исследования показали, что гальванокоагуляционным способом возможно эффективное извлечение ионов Zn2+ из техногенных гидроминеральных ресурсов в виде товарной продукции.
Разработаны технологические рекомендации по рациональному проведению гальванокоагуляционного извлечения Zn2+ и Сu2+ из техногенных гидроминеральных ресурсов. Установлен технологический режим каждой стадии технологического процесса. На первой стадии использовали гальванопару Fe:С в объемном соотношении 3:1. На второй ? гальванопару Fe:С в объемном соотношении 1:1. Время обработки воды в поле гальванопары составило, соответственно для I и II стадии 5 и 12 минут.
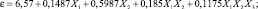
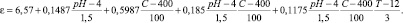
Выводы
1. Форма нахождения цинка в кислых сульфатных водах позволяет выделять его методом гальванокоагуляции не только в форме адсорбтива на оксогидроксосоединениях железа и ферритов цинка, но и богатой по цинку фазы – цинкита, что способствует обогащению осадка цинком.
2. Рациональные параметры процесса гальванокоагуляционного извлечения цинка: рН 5,2–6,5, t = 14–16 минут, после предварительной аэрации раствора в течение 20–25 минут обеспечивают получение продукта с массовой долей цинка, пригодного для утилизации в металлургическом переделе.
3. Селективное выделение цинка из поликомпонентного раствора обеспечивается электрохимическим приоритетом цинка, позволяющим вытеснять медь из растворов её солей, и повышением скорости перехода цинка в ферритный осадок после предварительной аэрации в первые 4 минуты контакта раствора с гальванопарой на 14–53 % при одновременном незначительном повышении скорости перехода в осадок железа (от 0,55 до 0,57 мг/с).
4. Применение двух стадий гальванокоагуляции с соотношением железо: углерод в загрузке соответственно 3:1 и 1:1 в области значений рН соответственно 2,0–3,5 и 5,5–6,5 и последующая очистка вод сорбцией на геохимическом барьере позволяет получить дополнительные металлсодержащие продукты и нормативно очищенную воду.



