В последние годы интерес к нанодисперсным порошковым материалам сильно возрос. В работах [18, 11] показано, что ряд физических свойств наноструктурных материалов значительно превосходят обычные крупнозернистые материалы. Особый интерес вызывает керамика на основе магний-алюминиевой шпинели, которая имеет широкое применение в металлургии, радиотехнике, химическом производстве и рассматривается как перспективная в ядерной технике.
Целью настоящей работы является синтез нанопорошка состава PrxMg1-xAl2O4 шпинельной структуры методом низкотемпературного горения и изучение их физико-химических и каталитических свойств в превращении метанола в диметиловый эфир.
Экспериментальная часть
По общепринятому методу для синтеза магний-алюминиевой шпинели используют химически чистые порошки MgO и Al2O3 [8]. Синтез проводят твердофазной реакцией в интервале температур 1100–1600 °С [2, 1, 8, 7, 16, 1, 6].
В настоящей работе нанопорошки шпинельной структуры получали методом низкотемпературного горения. Исходными реактивами для синтеза были следующие:
– алюминий азотнокислый 9-водный, Al(NO3)3 9H2O;
– магний азотнокислый 6-водный, Mg(NO3)2 6H2O;
– церий карбонат (III), Pr(CO3)3, – диетилмалонат C7H12O4;
– гидразин моногидрат NH2NH2 H2O;
– спирт абсолютный C2H5OH;
– азотная кислота HNO3 с концентрацией 65 %.
Предшественником была высушенная смесь комплексных соединений магния и алюминия с гидразидами малоновой кислоты. При синтезе предшественника применяли свежеприготовленный дигидразид малоновой кислоты, полученный перемешиванием диетилмалоната с гидразин моногидратом в мольных соотношениях 1:2. Процесс протекает по химической реакции
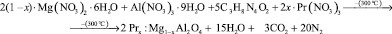
и азотнокислые соли алюминия и магния. В ходе получения дигидразидов малоновой кислоты магния, алюминия и празеодиума лучшие результаты получаются при использовании азотнокислых солей. При этом раствор азотнокислого празеодиума получен растворением карбоната празеодиума (III) в концентрированной азотной кислоте при комнатной температуре. После прекращения выделения CO2 раствор концентрировали до определенной кондиции выпариванием при 60–80 °С. Таким образом, приготовлены водные растворы азотнокислых солей магния, алюминия и празеодиума. Затем смешивали эти растворы с таким расчетом, чтобы мольные соотношения были Pr : Mg : Al = x : (1 – х) : 2 (где х – мольная доля празеодиума), если конечный состав неорганического пигмента соответствует PrхMg(1-х) Al2О4. Нами синтезированы составы, где х = 0,03, 0,05, 0,10 и нелегированная шпинель MgAl2O4. Приготовление предшественников для синтеза указанных составов осуществлено простым перемешиванием трехкатионного (празеодиума, магния и алюминия) раствора с дигидразидом малоновой кислоты. Соотношение нитратов магния и алюминия в растворе составляло 1:2. Затем смешивали раствор с соответствующим количеством спиртового раствора дигидразида малоновой кислоты, интенсивно перемешивали и высушивали в глубоких стаканах на электролитах с закрытыми нагревателями. Сушку проводили при температуре кипения раствора. После испарения сухой предшественник подвергали термогравиметрическому анализу. Результаты исследования представлены на рис. 1.
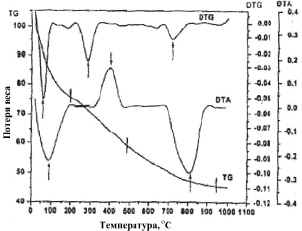
Рис. 1. Кривые термогравиметрического анализа (TГ, DTГ, DTA) в процессе синтеза порошка Pr0,10Mg0,90Al2O4
Исследования проводили на приборе SDT2960 с помощью термоанализатора типа- DТ5 [12, 17]. Согласно кривым, весь процесс можно разделить на три этапа: на первом этапе с увеличением температуры до 200 °С происходит удаление влажности и связанной воды, которая сопровождается появлением глубокого эндоэффекта при 80 °С на кривых DTГ и DTA и малыми эндоэффектами на кривой DTГ при 130 и 190 °С. Последние эффекты не наблюдаются на кривой DTA, видимо, они сливаются с эндоэффектом при 80 °С. Потеря массы на первом этапе процесса составляет 25 % от исходного образца. Второй этап охватывает температурный интервал 200–500 °С. Здесь наблюдается один глубокий эндоэффект при 270 °С и один незаметный эффект при 445 °С. В процессе синтеза порошка Pr0,10Mg0,90Al2O4 на кривых DTA при 400 °С наблюдается сильный экзотермический эффект. Этот эффект относится к горению предшественника. Видимо, наличие празеодима, который находится в субстрате, автокаталитически действует на процесс горения. Потеря массы на данном участке составляет около 17,5 %. Согласно реакции горения предшественника выделяются СО, CO2 и NOx газы. Площадь экзоэффекта позволяет предполагать полноту горения органической части предшественника. На третьем этапе в температурном интервале 500–950 °С потеря массы составляет 12,5 %. На этом этапе наблюдаются два эффекта на кривой DTГ и один глубокий растянутый эндоэффект на кривой DTA. Аналогичный эффект при 800 °С на кривой DTA отвечает процессу образования чистого MgAl2O4.
Рентгенофазовый анализ проводили на дифрактометре XRД Д 8 фирмы «Bruker» на Сu Кα излучении, сравнением дифрактограммы порошков, прокалённых после синтеза (рис. 2).
Отжиг образцов проводили при различных температурах в течение 2-х часов. Где размеры частиц (D, нм), параметры ячейки (а, нм) и плотность (ρ, г/см3), фазообразование и размеры частиц определены с помощью рентгеновских дифракционных данных.
Размеры частицы порошка рассчитывали согласно уравнению Шерера:
D = (0,9l)/(β cos θ) [9, 14],
где D – размер кристаллитов (нм), длина волны излучения (0,15406 нм), β – ширина половины высоты максимального пика (радиан), θ – угол Брегга (градусы). Параметр кубической решетки (а) был рассчитан по формуле
а = dhkl (h2 + k2 + l2) 1/2,
где hkl – индексы Миллера; dhkl – межплоскостные расстояния. Рентгеновскую плотность (d) рассчитывали по уравнению
d x-ray = 8M/N•a3;
здесь M – молярная масса; N – число Авогадро; а – параметр решетки. Результаты рентгенографического анализа приведены в табл. 1.
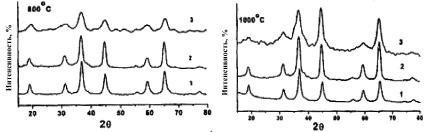
а б
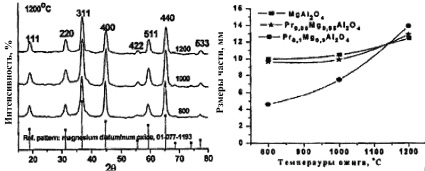
в г
Рис. 2. Дифрактограммы порошков (а, б и в), соответствующих составу (I) MgAl2O4, (II) Pr0,05Mg0,95Al2O4, (III) Pr0,1Mg0,9Al2O4 зависимости размеров наночастиц от температуры термической обработки
Таблица 1
Рентгенографические данные образцов, термически обработанных при 800, 1000, 1200 °С в течение 2-х часов
|
Показатели |
Фазы |
|||
|
MgAl2O4 |
Pr0,05Mg0,95Al2O4 |
Pr0,1Mg0,9Al2O4 |
Pr6O11 |
|
|
Температура термической обработки, 800 °С |
||||
|
Размер частиц, нм |
10 |
9,7 |
4,6 |
24,4 |
|
Параметр решетки a |
0,805 |
0,8065 |
0,8024 |
0,546 |
|
Объем ячейки V (a3) |
0,522 |
0,5246 |
0,51663 |
0,16277 |
|
Плотность ρ, г/см3 |
3,62 |
3,83 |
4,14 |
6,99 |
|
Температура термической обработки, 1000 °С |
||||
|
Размер частиц, нм |
10,5 |
10,2 |
7,5 |
25,6 |
|
Параметр решетки a |
0,8063 |
0,8067 |
0,8055 |
0,5465 |
|
Объем ячейки V (a3) |
0,524 |
0,52499 |
0,5227 |
0,16322 |
|
Плотность ρ, г/см3 |
3,599 |
3,831 |
4,087 |
0,697 |
|
Температура термической обработки, 1200 °С |
||||
|
Размер частиц, нм |
12,5 |
12,9 |
14 |
53,55 |
|
Параметр решетки, a |
0,8082 |
0,8070 |
0,8024 |
0,5469 |
|
Объем ячейки V (a3) |
0,528 |
0,5253 |
0,52314 |
0,1635 |
|
Плотность ρ, г/см3 |
3,57 |
3,83 |
4,0834 |
6,95 |
Инфракрасные спектры образцов были записаны в диапазоне 200-4000 см-1 с помощью ИК Jasko плюс-460. Способ включает смешивание прокаленного образца мг порошка c порошком бромида калия KBr в агатовой ступке. Функциональные органических и неорганических групп порошкового материала характеризовались инфракрасным спектром. Результаты ИК-спектроскопии полученных образцов представлены в табл. 2.
Таблица 2
Значения полос пропускания в ИК-спектрах для MgAl2O4, Pr0,05Mg0,95Al2O4, Pr0,1Mg0,9Al2O4 и Pr6O11, непосредственно после горения предшественника при 300 °С и термически обработанных при 1000 °С
|
Т, °С |
Предполагаемые группы |
||||
|
–OH |
–CH |
O–H |
N=O |
Me–O |
|
|
Для соединения MgAl2O4 |
|||||
|
300 |
3456 |
– |
1635 |
1382 |
683–451 |
|
1000 |
3448,5 |
– |
1639 |
1400 |
698–513 |
|
Для легированной фазы Pr0,05Mg0,95Al2O4 |
|||||
|
300 |
– |
– |
– |
– |
– |
|
1000 |
3445 |
1636 |
1396 |
687–529 |
|
|
Для легированной фазы Pr0,1Mg0,9Al2O4 |
|||||
|
300 |
3417 |
– |
1643 |
1385–829 |
590–424 |
|
1000 |
3437 |
– |
– |
1404 |
667–505 |
|
Pr6O11 |
|||||
|
300 |
3600 |
2923–2854 |
1643 |
1385–849 |
667 |
|
1000 |
3445 |
– |
1636 |
1400 |
– |
Полосы пропускания, наблюдаемые в интервале частот 3410–3460 и 1635–1639 см–1, связаны с наличием влаги или поверхностных гидроксильных групп. По-видимому, вода адсорбируется при хранении образцов в атмосфере лаборатории. Полосы пропускания при 1382–1404 см–1 соответствуют резонансному колебанию в NOх группах. В образцах, полученных непосредственно после низкотемпературного горения предшественника при 300 °С, полосы поглощения NOх группы имеют заметные интенсивности и резко уменьшаются при повышении температуры отжига образцов, а при отжиге 1200 °С они полностью исчезают. Наблюдаемые полосы пропускания при 2923–2854 у образцов состава Pr6O11, по-видимому связаны с наличием органических остатков, не сгоревших при относительно низких температурах. Характерные колебания для октаэдрически [AlO6] и тетраэдрически [MgO4] расположенных Me–O групп в шпинельной структуре соответствуют полосам пропускания:
для чистого MgAl2O4 при 698–513 см–1;
для Pr0,05Mg0,95Al2O4 при 687–529 см–1;
для Pr0,1Mg0,9Al2O4 при 667–505 см–1.
Изучение некоторых физико-химических свойств этих материалов вызвало большой интерес для рассмотрения их каталитических свойств в превращении метанола в диметиловый эфир (ДМЭ).
Одной из наиболее вероятных альтернатив замены нефтяного сырья считается получение углеводородов из метанола через диметиловый эфир. При этом к преимуществам метанола как сырья можно отнести возможность ориентации его на крупнотоннажное производство ДМЭ, бензина, низших олефинов и ароматических углеводородов. Процессы превращения метанола в олефиновые углеводороды и высокооктановый бензин приобрели практическую значимость в результате работ исследователей фирмы «Моbil Oil» [5].
В последние годы внимание привлекают работы, направленные на синтез олефинов С2–С3 не из метанола, а из ДМЭ. Появлению подобных методов способствовали результаты исследования механизма превращения метанола в низшие олефины, согласно которым ДМЭ является промежуточным продуктом.
Разрабатываются два направления получения олефинов С2–С3 из природного газа через ДМЭ [13, 3, 4]. Одно включает стадию синтеза ДМЭ из метанола по реакции дегидратации:
2 CH3OH → CH3OCH3 + H2O.
Другое же предполагает прямое получения ДМЭ из синтез-газа в одну стадию
3 CO+ 3 H2 → CH3OCH3 + H2O.
В работе [3] показано, что основным продуктом превращения метанола при 300–450 °С в присутствии катализатора, полученного смешением алюмината кальция с оксидом магния, является ДМЭ, выход которого достигает 50 % при селективности 98 %. В области температур выше 400 °С преобладало разложение метанола до оксидов углерода. В связи с этим целесообразно было изучение каталитических свойств нанопорошков MgAl2O4, PrхMg1-хAl2O4 в процессе превращения метанола в ДМЭ.
Превращение метанола изучали в проточном режиме, при атмосферном давлении. Пары спирта подавали из барботера током азота. Продукты реакции анализировали хроматографически. На всех изученных катализаторах при температуре 300 °С и объемной скорости метанола 1 ч–1 метанол превращается практически только в метиловый эфир.
Как видно из табл. 3, каталитическая активность нанопорошков, синтезированных шпинелей зависит от химического состава и условий их термической обработки.
Таблица 3
Превращение метанола в ДМЭ на нанопорошках шпинелей Условия: Р = 1 атм., V = 10 ч–1, T = 300 °С
|
Нанопорошки шпинелей |
Условия термической обработки, °С |
Размер частиц, нм |
Конверсия, мас. % |
Выход ДМЭ, мас. % |
|
MgAl2O4 |
800 °С |
10 |
80,5 |
77,3 |
|
1000 °С |
10,5 |
77,4 |
76,8 |
|
|
1200 °С |
12,5 |
70,2 |
69,5 |
|
|
Pr0,05Mg0,95Al2O4 |
800 °С |
9,7 |
98,3 |
96,5 |
|
1000 °С |
16,2 |
96,2 |
95,1 |
|
|
1200 °С |
12,9 |
84,4 |
83,5 |
|
|
Pr6O11 |
800 °С |
24,4 |
83,2 |
70,2 |
|
1000 °С |
25,6 |
72,2 |
61,6 |
|
|
1200 °С |
53,6 |
64,7 |
52,7 |
|
|
Pr0,1Mg0,9Al2O4 |
800 °С |
4,6 |
99,1 |
98,2 |
|
1000 °С |
7,5 |
97,8 |
96,6 |
Оксид Pr6O11 с размерами частиц 24,4–53,5 нм проявляет существенно низкую активность по сравнению со шпинелями состава MgAl2O4, Pr0,05Mg0,95Al2O4 и Pr0,1Mg0,9Al2O4. Модифицирование шпинели MgAl2O4 празеодимом приводит к существенному возрастанию его активности. В присутствии наночастиц Pr0,05Mg0,95Al2O4 и Pr0,1Mg0,9Al2O4 выход диметилового эфира достигает 96,5–98,2 % при конверсии метанола 98,3–99,1 %. Наиболее высокую активность проявляют образцы нанопорошков шпинелей, прошедшие термическую обработку в интервале температур 800–1000 °С. При дальнейшем повышении температуры происходит заметное снижение активности нанопорошков шпинелей.
Таким образом, нанопорошки состава Pr0,05Mg0,95Al2O4, и Pr0,1Mg0,9Al2O4, прошедшие термическую обработку при 800–1000 °С, можно использовать в качестве катализатора при получении диметилового эфира из метанола.



