Уникальныe оптическиe, фотоэлектрическиe и электрическиe свойства халькогенидных стекол, основанные на фотоструктурных изменениях, позволяют найти им широкое применение в фотонике, оптоэлектронике и микроэлектронике в качестве приборов с оптической памятью, сред для регистрации и хранения оптической и голографической информации, в интегральной оптике, в качестве микроинтерферометров, коммутаторов, оптических усилителей в телекомуникационных системах, оптических элементов для инфракрасной (ИК) оптики, нелинейных оптических элементов, фоторезисторов в микроэлектронике и т.п. [4, 7].
Благодаря перспективности их применения в различных областях техники по-прежнему актуальны вопросы, связанные с воздействием на образцы агрессивных сред [9]. Халькогенидные стекла обладают химической стойкостью по отношению к большинству агрессивных сред. Они не гигроскопичны, не изменяются при хранении во влажном воздухе, не взаимодействуют с водой и растворами кислот-неокислителей, медленно растворяются в растворах концентрированной азотной кислоты, при нагревании наблюдается увеличение растворимости. Халькогенидные стекла менее устойчивы по отношению к растворам щелочей.
Связь между компонентами халькогенидных стекол практически ковалентная, доля ионной составляющей химической связи не превышает 10 % [1] и с введением в состав стекла РЗЭ увеличивается незначительно. Поэтому скорость растворения большинства халькогенидных стекол, как и всех веществ, связь в которых в основном ковалентная, определяется гетерогенной химической реакцией, протекающей на поверхности твердой фазы, и, как правило, не зависит от диффузии [1, 3, 9].
Кинетику растворения стекол на основе As2Se3 и AsSe изучали по разрезам As2Se3–Eu (EuSe, Eu2Se3) и AsSe–Eu, в растворах КОН марки «х.ч.» различной концентрации (0,25; 0,5; 1; 2 н) скорость растворения определялась весовым методом. Исследуемые образцы – плоско-параллельные диски с известной площадью поверхности – подвешивались с помощью зажимов из некорродирующего материала и подвергались растворению в растворах КОН при различных температурах. Для стандартизации поверхности образцы предварительно подвергались 15-минутному травлению в 0,25 Н растворе КОН. Раствор перед каждым опытом обновлялся, температура поддерживалась с постоянной точностью ±5 °С с помощью термостата UТU 5. Измерение скорости растворения проводили на отшлифованных плоскопараллельных образцах. Растворение образцов проводили при 298, 308, 318 К. Усредненное значение скорости растворения рассчитывали по следующей формуле:
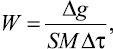 мол/см2•с,
мол/см2•с,
где W – скорость растворения, мол/см2•с; Δg – убыль веса образца, г; S – площадь поверхности образца, см2; M – молекулярный вес усредненной структурной единицы, г/моль; Δτ – время релаксации, с.
Значения скоростей растворения, вычисленных по экспериментальным данным, для стекол систем As2Se3–Eu (EuSe, Eu2Se3) приводятся в табл. 1.
Как видно из табл. 1, увеличение концентрации европия в составе стекол, а также температуры положительно влияет на скорость растворения.
Скорость растворения связана с энергией активации процесса и сильно зависит от природы и количества различных добавок:
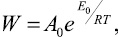
где W – скорость процесса растворения, моль/см2•с; A0 – предэкспоненциальный множитель; E0 – энергия активации растворения, ккал/моль; R – универсальная газовая постоянная; T – температура.
Прологарифмированное соотношение имеет вид
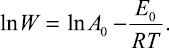
Таблица 1
Зависимость скорости растворения от температуры стекол систем As2Se3–EuSe и AsSe–Eu (0,5 н раствор КОН)
|
As2Se3–EuSe |
|||||||||||
|
T |
1/T |
As2Se3 |
1 мол. % EuSe |
3 мол. % EuSe |
5 мол. % EuSe |
10 мол. % EuSe |
|||||
|
W•108 |
ln W |
W•108 |
ln W |
W•108 |
ln W |
W•108 |
ln W |
W•108 |
ln W |
||
|
298 |
0,0034 |
1,0 |
–18,42 |
18,0 |
–15,65 |
29 |
–15,05 |
35 |
–11,87 |
28,5 |
–15,08 |
|
303 |
0,0033 |
1,6 |
–17,97 |
20 |
–15,43 |
32 |
–14,96 |
38 |
–14,78 |
35 |
–14,87 |
|
323 |
0,0031 |
7,5 |
–16,41 |
32 |
–14,96 |
34 |
–14,89 |
40 |
–14,73 |
63 |
–14,28 |
|
AsSe–Eu |
|||||||||||
|
T |
1/T |
AsSe |
1 мол. % Eu |
2 мол. % Eu |
3 мол. % Eu |
4 мол. % Eu |
|||||
|
W•108 |
ln W |
W•108 |
ln W |
W•108 |
ln W |
W•108 |
ln W |
W•108 |
ln W |
||
|
298 |
0,0034 |
0,4 |
–19,42 |
8,9 |
–18,53 |
65,8 |
–14,24 |
77 |
–14,08 |
79 |
–14,08 |
|
303 |
0,0033 |
0,6 |
–18,95 |
54,5 |
–14,46 |
71,2 |
–14,29 |
81 |
–14,09 |
85 |
–13,98 |
|
323 |
0,0031 |
3,4 |
–17,20 |
64,9 |
–14,25 |
79,6 |
–14,07 |
84 |
–13,99 |
115 |
–13,66 |
Таблица 2
Некоторые кинетические данные стекол
|
Состав стекла |
E0, ккал/моль |
CЭ, моль/см2 с |
CT, моль/см2 с |
|
Система As2Se3–Eu |
|||
|
As2Se3 |
15 |
1,6•1027 |
3,9•1027 |
|
[As2Se3]0,99[Eu]0,01 |
2,1 |
1,2•1029 |
6,61•1027 |
|
[As2Se3]0,98[Eu]0,02 |
1,6 |
5•1018 |
6,8•1027 |
|
[As2Se3]0,97[Eu]0,03 |
0,9 |
1,5•1018 |
6,85•1027 |
|
[As2Se3]0,96[Eu]0,04 |
0,7 |
6,9•1019 |
6,81•1027 |
|
Система As2Se3–EuSe |
|||
|
[As2Se3]0,99[EuSe]0,01 |
4,6 |
2,4•1020 |
3,61•1027 |
|
[As2Se3]0,97[EuSe]0,03 |
1,3 |
1,6•1018 |
3,69•1027 |
|
[As2Se3]0,95[EuSe]0,05 |
1,6 |
4,4•1018 |
3,75•1027 |
|
[As2Se3]0,90[EuSe]0,10 |
5,96 |
4,1•1021 |
3,87•1027 |
|
Система AsSe–EuSe |
|||
|
AsSe |
17 |
6,5•1027 |
6,6•1027 |
|
[AsSe]0,99[Eu]0,01 |
2,2 |
1,2•1020 |
5,61•1027 |
|
[AsSe]0,98[Eu]0,02 |
1,5 |
3,0•1018 |
6,78•1027 |
|
[AsSe]0,97[Eu]0,03 |
3,5•1018 |
6,89•1027 |
|
|
[AsSe]0,96[Eu]0,04 |
4,5•1018 |
6,85•1027 |
|
|
[AsSe]0,95[Eu]0,05 |
6,9•1018 |
6,94•1027 |
|
Построили график зависимости 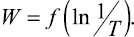 Зависимость носит линейный характер. Используя полученные данные и известные выражения, нашли значения энергии активации и предэкспоненциального множителя, выраженного эмпирически и теоретически E0; CЭ; CT (табл. 2).
Зависимость носит линейный характер. Используя полученные данные и известные выражения, нашли значения энергии активации и предэкспоненциального множителя, выраженного эмпирически и теоретически E0; CЭ; CT (табл. 2).
Из табл. 2 видно, что увеличение содержания европия в халькогенидных стеклах, в отличие от переходных (d-элементов) и постпереходных элементов [1] приводит к резкому уменьшению энергии активации и предэкспоненциального множителя. Это объясняется увеличением доли ионной составляющей в структурных единицах, что непосредственно связано с электронной конфигурацией Eu 4f7 и структурными особенностями и размерами атома/иона.
В области стекло кристалл наблюдается возрастание указанных параметров, что можно объяснить образованием кристаллических центров в стекле. При сравнении значений скорости растворения сплавов при различных концентрациях выявлено, что увеличение скорости растворения с увеличением концентрации щелочи, имеет следующий вид 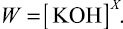
Процессы растворения образцов можно представить следующими реакциями
As2Se3 + KOH = K3AsO3 + K3AsS3 + H2O.
Eu в образцах находится в двухвалентном состоянии, это состояние наиболее выгодно и объясняется стaбильностью электронной конфигурации 4f7. Однако будучи самым активным лантаноидом на открытом воздухе он быстро переходит в трёхвалентное состояние и в щелочном растворе выпадает в виде беловатого осадка
2•Eu2+ + KOH = Eu(OH)2 + K+;
Eu(OH)2 + O2 > Eu(OH)3 ¯.
Изучение процесса кристаллизации стекла является одним из эффективных методов исследования строения стекла и стеклообразного состояния. Как с теоретической, так и с практической точки зрения интерес представляет переход твердого тела из стеклообразного в кристаллическое состояние, происходящий макроскопически по всему объему – объемная кристаллизация. Кристаллизацию стекол проводили изотермическим отжигом. Температуру отжига определяли из термограмм соответствующих стекол, ее значение на 10–15 К превышало температуру кристаллизации стекол. Установлено, что после кристаллизации плотность соответствующих стекол увеличивается. Поэтому в качестве меры объемной кристаллизации мы рассматривали относительное изменение плотности сплавов, для чего использовали экспериментальные значения плотности, полученные при каждой исследуемой температуре. Процент объемной кристаллизации был рассчитан по известной формуле:
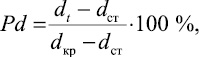
где dкр; dcт; dt – соответственно плотности образцов в стеклообразном, кристаллическом состоянии и в данный момент времени.
На рис. 1 представлены изотермы процента объемной кристаллизации Pd стекла состава [As2Se3]0,97[Eu]0,03 при различных температурах. Из рис. 1 видно, что увеличение температуры и времени положительно влияет на скорость кристаллизации.
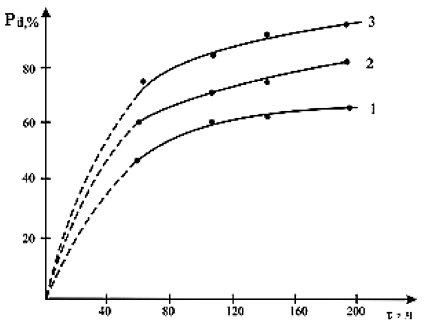
Рис. 1. Изотермы процента объемной кристаллизации Pd стекол [As2Se3]0,97[Eu]0,03 при температурах: 1 – 470 К; 2 – 490 К; 3 – 520 К
Увеличение содержания Eu в сплавах также способствует увеличению скорости кристаллизации. Этот факт можно объяснить возникновением новых структурных единиц и химической связью в стеклах.
Для анализа локальной структуры вещества было бы уместно обратиться к интерпретации колебательных спектров изучаемых образцов. Результаты исследований комбинационного рассеяния, проведенные нами на приборе micro-Raman System RM1000 (Renishawplc, UK) при комнатной температуредля стекла As2Se3 в области 100–700 см–1, хорошо согласуются с литературными данными [5, 6, 8].
Наиболее интенсивная полоса имеет место при 228 см–1 и относится к v1 (A) колебательной валентности, соответствующей пирамидальной структурной единице в стекле (рис. 2).
Локальный порядок описывается специфичными атомными кластерами, представляющими собой пирамидальные единицы AsSe3. Сильные эффекты на колебательный спектр оказывает как локальный атомный кластер, так и топология. Массивные образцы стекол образованы пересекающейся случайной сетью атомных единиц.
Так как значения масс As и Se близки друг другу, колебательные частоты атомных единиц могут быть очень похожи. Слабые плечи при 230 см–1 могут указывать на гомополярные AsAs и SeSe связи в слитке As2Se3. Интерпретация спектральных особенностей достаточно сложна.
Полоса около 495 см–1 указывает на нестехиометрическую структурную единицу Se8. Это может указывать на существование тонкого аморфного слоя у поверхности слитка. Появление и исчезновение пиков некристалличных образцов на спектре может объясняться различной молекулярной конфигурацией кластеров. К тому же на колебательную активность влияет изменение в поляризуемости, так что методы, вовлекающие взаимодействия между молекулами, могут оказывать вклад в комбинационное рассеяние света.
После кристаллизации образцов также были проведены спектроскопические исследования (рис. 3) и полученные результаты также свидетельствуют о преобладании слоистой структуры и находятся в хорошей корреляции с литературными данными [8]. В пределах узкой полосы слоя, координация каждого атома As равна 3, а Se равна 2. Это согласуется с правилом Юм-Розери и требованиями октета ковалентной связи. За слабые связи между слоями ответственны Ван дер Ваальсовые связи.
Добавление Еu изменяет вид спектра чистого As2Se3, что может указывать на образование соединения EuAs4Se7 (рис. 4).
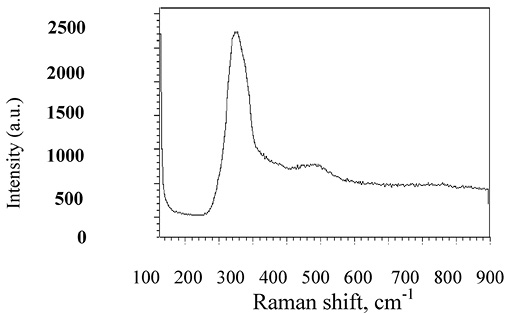
Рис. 2. Спектр комбинационного рассеяния света As2Se3 при комнатной температуре
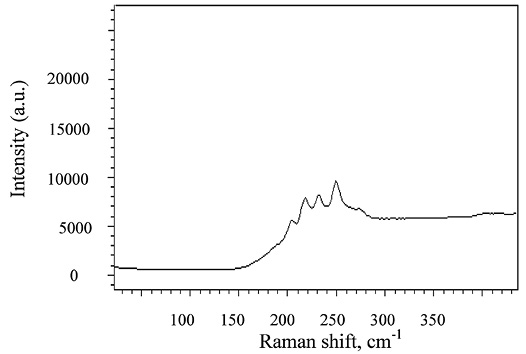
Рис. 3. Спектр комбинационного рассеяния света кристаллического As2Se3
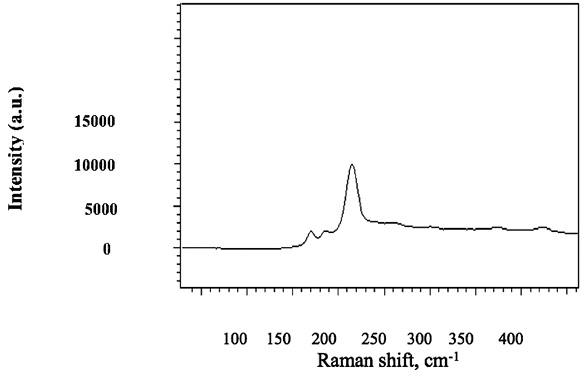
Рис. 4. Спектр комбинационного рассеяния света стеклообразного EuAs4Se7
Образование такого типа соединения типично для редкоземельных соединений с переменной степенью окисления и объясняется как присутствием электрона на d-орбитале, так и степенью заполнения f-орбитали. Кристаллохимические особенности халькогенидов As и Еu позволяют предположить присутствие стибнитоподобных блоков в структуре EuAs4Se7, в которых одна часть атомов Se вовлечена только в координацию с катионами Еu, а другая соединяется с As, образуя анионные группы As4Se6 [2]. Это хорошо согласуется с составом структурных блоков стибнитов, в которых число анионов должно быть на 2 больше катионов. 2 редкоземельных катиона и 2 атома Se размещены между блоками. В отличие от других структур, наблюдается сильное уменьшение симметрии и цементирование As4Se6 восьмивершинниками Еu и полиэдрами последнего, эти группы, соединяясь углами, и образуют димеры.
Таким образом, при изучении кинетики растворения в растворах КОН стекол при различных температурах выявлено, что увеличение концентрации Еu в стеклах, а также температуры и концентрации растворителя положительно влияет на скорость растворения. Исследование кристаллизации стекол также показало, что скорость кристаллизации также увеличивается с увеличением содержания Еu.



