Известно, что предприятия текстильной промышленности ежегодно производят большие объёмы сточных вод. Современные красители устойчивы к воздействию агрессивных факторов окружающей среды: для них характерна неспособность к биологической деструкции и высокая устойчивость к химическим и температурным воздействиям. Попадая со сточными водами в объекты окружающей среды, красители угнетают жизнедеятельность экосистем и отрицательно влияют на процессы самоочищения водоемов. Поэтому цветность (в градусах платино-кобальтовой шкалы) является одним из основных нормируемых параметров сточных вод.
Для деколоризации сточных вод применяют различные методы: электрохимическое окисление [3], ультразвуковая активация процесса окисления [4], биодеградация [10] и др. Большинство красителей не поддаются химическому или биологическому уничтожению, что вызывает их накопление в окружающей среде. Наиболее эффективными являются передовые окислительные процессы (AOPs) с участием высокоактивных гидроксильных радикалов в гомогенной или гетерогенной фазах [2, 9]. Для очистки сточных вод, содержащих органические загрязнители, широко используют Фентон-процессы [7]. В гомогенном катализе в таких системах в комбинации с пероксидом водорода чаще используют соли железа, что приводит к высоким эколого-экономическим затратам. Высокая концентрация оставшихся ионов железа в гомогенном процессе Фентона требует его удаления. Для минимизации этих затрат предложены гетерогенные катализаторы Фентона, в частности железосодержащие материалы на основе мезопористого диоксида кремния, цеолиты. В гомогенном фотокатализе для окисления органических красителей в слабокислой или нейтральной средах также является активной ферриоксалатная система 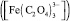 [8]. Поскольку продукты фотодеградации красящих веществ часто являются биоразлагаемыми, в дальнейшем стоки подвергают дополнительной очистке в биологических сооружениях.
[8]. Поскольку продукты фотодеградации красящих веществ часто являются биоразлагаемыми, в дальнейшем стоки подвергают дополнительной очистке в биологических сооружениях.
Нами показано, что Fe-керамические композиты на основе нитридов кремния, бора и сиалона эффективны в процессах фотокаталитического окисления растворимых органических веществ (РОВ), в частности щавелевой кислоты, фенолов, формальдегида [5, 6]. Высокая активность таких матриц связана с наличием фазы железа, при растворении которого в присутствии реагентов активаторов (Н2О2, Н2С2О4) в растворе образуются фотокаталитические системы (Фентона, ферриоксалатная и др.). При этом растворы не загрязняются железом, что имеет экологическую и экономическую привлекательность. Кроме того, металлокерамические композиты могут включать в свой состав полупроводниковые соединения, что придаёт им оптические свойства.
Одним из важных факторов, определяющих состояние органических красителей и активность фотокаталитических систем, является кислотность раствора. Цель работы – изучение влияния рН среды на формы нахождения органических красителей в воде и степень их деколоризации при использовании металлокерамических композитов на различной основе в условиях фотосистем – Фентона и ферриоксалатной.
Материалы и методы исследования
Объекты исследования: композиты на основе нитридов кремния, бора и сиалона, полученные методом самораспространяющегося синтеза (СВС) в отделе структурной макрокинетики Томского научного центра СО РАН; красители – метиловый оранжевый (МО), метиленовый синий (МС), бромтимоловый (БТС) и тимоловый синий (ТС). МО принадлежит к группе азокрасителей, МС – представитель тиазиновых красителей, БТС и ТС относятся к группе арилметановых красителей.
Фазовый состав материалов изучали методом рентгеновской дифракции (РД) на дифрактометре фирмы Shimadzu XRD6000 (Япония, «Shimadzu»), микрорентгеноспектральный анализ композитов проводили на приставке Quantax 70 для растрового электронного микроскопа HitachiTM-3000. В качестве источника УФ излучения использовали ртутную лампу высокого давления ДРЛ-250 с наиболее интенсивной линией при 254 нм.
Контроль содержания красителей в реакционных системах осуществляли спектрофотометрическим методом (СФ). Для выбора оптимальных условий (область рН, c) количественного определения красителей изучали влияние кислотности раствора на их спектральные характеристики методом сканирующей СФ на приборе СФ-56 (Россия). Для этого регистрировали спектры поглощения красителей в области 350–700 нм, изменяя рН раствора в интервале 2–10. Степень деколоризации раствора оценивали по убыли красителя из раствора (R, %) по формуле
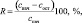
где cнач и cост – начальная и остаточная концентрации красителя в растворе.
Методика эксперимента описана в работе [6]. Исходные концентрации растворов составляли для МС – 5 мг/л, МО, БТС и ТС – 10 мг•л–1.
Результаты исследования и их обсуждение
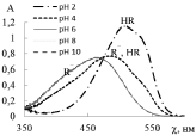
Состояние кислотно-основных красителей зависит от рН раствора, что выражается в их способности поглощать излучение при различных значениях длин волн. В литературе указаны длины волн, при которых следует определять концентрацию красителей, но не даны чёткие ограничения по кислотности раствора. Поскольку в реакционных системах кислотность может изменяться в широких пределах, были получены спектры поглощения красителей в зависимости от рН раствора (рис. 1).
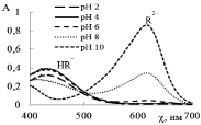
Из рис. 1, а видно, что максимум поглощения протонированной красной формы МО (рН 2) проявляется при λ = 510 нм. В слабокислой среде (рН 4) в растворе присутствуют молекулярная и ионная формы МО (красная и жёлтая), что соответствует оранжевой окраске раствора и максимуму поглощения при λ = 480 нм, в области рН 6–10 наблюдается интенсивная полоса поглощения при λ = 461 нм, которая относится к жёлтой форме красителя. Спектры поглощения МС (рис. 1, б) свидетельствуют об отсутствии видимого влияния рН раствора на состав и оптические свойства красителя. Это может быть обусловлено его сильноосновными свойствами, которые не приводят к изменению электронного строения в исследуемой области рН. Электронный спектр красителя имеет в видимой области 2 полосы поглощения с максимумами 612 и 660 нм. Наиболее интенсивная полоса поглощения наблюдается при λ = 660 нм, соответствует мономерной форме красителя и синей окраске раствора, спектральную полосу при λ = 612 нм относят к димерам [1]. Из этого вытекает, что аналитический контроль МС следует проводить при 660 нм в широкой области рН (2–10).
 а
а 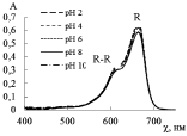 б
б
 в
в 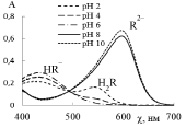 г
г
Рис. 1. Спектры поглощения растворов красителей: а – МО; б – МС; в – БТС; г – ТС в области рН 2–10
На рис. 1, в, г приведены спектры поглощения БТС и ТС. Красители являются слабыми двухпротонными кислотами, поэтому наблюдается влияние рН раствора на соотношение форм и соответствующих им спектральных линий. Отщепление первого протона происходит в кислой среде, так как сульфогруппа характеризуется сильными кислотными свойствами. Кислотно-основное равновесие HR– ↔ R2– + H+ для БТС характеризуется рКа2 = 7,30, а для ТС рКа2 = 9,20 и смещено вправо в щелочной среде. В растворе БТС в кислой среде (рН 2–6) преобладает жёлтая форма HR– и в спектре ей соответствует полоса поглощения при λ = 435 нм (рис. 1, в). Увеличение рН раствора до 8–10 приводит к снижению интенсивности спектральной линии при 435 нм и её незначительному смещению, при этом интенсивность полосы при 616 нм, соответствующей синей форме красителя R2–, заметно возрастает. Аналитический контроль БТС следует осуществлять в слабокислой среде (рН 4–6) при λ = 435 нм или в щелочной среде (рН 8–10) при λ = 616 нм.
Для ТС характерны два перехода окраски: красная-желтая при рН 1,2–2,8 и желтая-синяя при рН 8,0–9,6. В кислой среде (рН 2) преобладает красная форма красителя (H2R), которой соответствует полоса с максимумом поглощения при λ = 544 нм. В области рН 4–6 в растворе преобладает желтая форма ТС (HR–), которая поглощает при λ = 430 нм. В щелочной среде (рН 8–10) доминирует синяя депротонированная форма ТС (R2–) и соответствующая ей спектральная полоса с максимумом поглощения при λ = 596 нм. Для количественного определения ТС наиболее чувствительной является полоса поглощения при λ = 596 нм.
В табл. 1 сведены спектральные характеристики красителей и область рН для их количественного определения методом СФ.
Таблица 1
Условия количественного определения красителей методом СФ
|
Краситель |
λ, нм |
Область рН |
|
Метиловый оранжевый |
462 510 |
6–10 2 |
|
Метиленовый синий |
661 |
2–10 |
|
Бромтимоловый синий |
435 616 |
4–6 8–10 |
|
Тимоловый синий |
596 435 |
8–10 2–6 |
Таблица 2
Фазовый состав и содержание железа в исследуемых композитах
|
Номер образца |
Основа композита |
Фазовый состав |
w(Fe), % |
|
1 |
BN |
BN, Fe, FeB + Fe2B, Fe3C, H3BO3 |
46–50 |
|
2 |
BN |
BN, Fe, FeB + Fe2B |
5–35 |
|
3 |
Si3N4 |
Si3N4, Fe, FeхSiy |
4–34 |
|
4 |
Si3Al3O3N5 |
Si3Al3O3N5, Fe, Si3N4, SiC |
1,6–2,5 |
В табл. 2 представлен фазовый состав исследуемых материалов. Композиты № 1 и 2 получены азотированием ферробора, № 3 – азотированием ферросилиция. Применение мочевины в качестве порообразователя при синтезе образца № 1 приводит к образованию новых фаз (Fe3C, H3BO3). Методом рентгеновской микроскопии установлено [6] присутствие примесных элементов (Mg, Al, Si), которые могут находиться в образце № 1 в виде соответствующих карбидов (MgC2, Al4C3, SiC). Сиалон (№ 4) получали азотированием кремний- и кислородсодержащей шихты в самоподдерживающем режиме при повышенном давлении.
Наличие в материалах (кроме № 3) широкозонных полупроводниковых соединений (BN, FeB, SiC, MgC2, Al4C3) может обеспечивать оптическую активность их матрицам в условиях УФ и видимого излучения. Кроме того, образцы № 1–3 включают значительное количество железа, что перспективно для создания в растворе при внесении Н2О2 или Н2С2О4 фотоактивных систем (Фентона, ферриоксалатная).
В табл. 3 представлены результаты оценки каталитической активности композитов в процессах деколоризации растворов красителей в условиях систем Фентона (Fe/Н2О2/УФ) и ферриоксалатной (Fe/Н2С2О4/УФ). Видно, что наиболее высокая степень обесцвечивания растворов красителей наблюдается в присутствии образцов на основе нитрида бора с добавкой Н2С2О4, то есть в условиях ферриоксалатной системы. С одной стороны, вследствие оптической активности керамической матрицы на активных центрах её поверхности может происходить фотоадсорбция молекул красителей, с другой – их окисление гидроксил-радикалами, образующимися в растворе при возникновении систем Фентона или ферриоксалатной. Большая активность ферриоксалатной системы связана с тем, что в реакционном растворе для неё создаётся оптимальная кислотность (рН 5–6), в отличие от системы Фентона, которая эффективна в более кислой среде (рН 2–3).
Фотокаталитическая активность композитов на основе нитрида кремния (№ 3) и сиалона (№ 4) коррелирует с содержанием железа в образце и указывает на преобладающую роль гомогенного катализа.
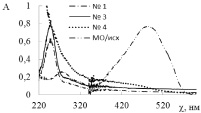
На рис. 2, а, б представлены спектры поглощения исходных растворов красителей (МО, БТС) и после каталитических экспериментов. Видно, что в присутствии композита на основе нитрида бора (№ 1) в спектрах реакционных растворов красителей практически отсутствуют все полосы поглощения в видимой и УФ области (250–700 нм). Это свидетельствует о деколоризации растворов красителей вследствие их деградации. Аналогичные зависимости получены для красителей МС и ТС.
Таблица 3
Степень деколоризации (%) растворов красителей в присутствии композитов на основе нитридов бора, кремния и сиалона в условиях УФ излучения (сМС = 5 мг•л–1; сМО = сБТС = сТС = 10 мг•л–1; рН ~ 5; mkt = 200 мг; vр-ра = 20 мл; τУФ = 20 мин)
|
Номер образца |
Fe/Н2О2/УФ |
Fe/Н2С2О4/УФ |
||||||
|
БТС |
ТС |
МО |
МС |
БТС |
ТС |
МО |
МС |
|
|
1 |
60 |
62 |
96 |
91 |
88 |
97 |
97 |
96 |
|
2 |
55 |
47 |
83 |
90 |
85 |
82 |
95 |
98 |
|
3 |
50 |
32 |
35 |
76 |
75 |
62 |
82 |
60 |
|
4 |
29 |
18 |
13 |
27 |
60 |
51 |
89 |
95 |
 а
а 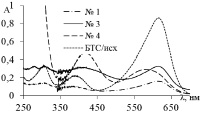 б
б
Рис. 2. Спектры поглощения исходных растворов красителей и после фотокаталитического эксперимента при использовании композитов № 1, 3, 4 с добавкой Н2С2О4: а – МО; б – БТС
В растворах красителей после фотокаталитического эксперимента также контролировали общее содержание железа методом ААС на спектрометре Thermo Scientific ICE 3300 (США). Концентрация железа в исследуемых системах не превышала ПДК железа в воде (0,3 мг•л–1) и составляла (0,096–0,183) мг•л–1. Незначительное вымывание железа из образцов может быть связано с тем, что фаза железа включена в матрицу композита. Таким образом, показано, что в процессе фотодеградации красителей в присутствии Fe-содержащих металлокерамических композитов не происходит загрязнение растворов железом. Это не требует дополнительных стадий очистки и минимизирует затраты.
Выводы
1. Изучены оптические свойства растворов красителей в зависимости от рН и установлены оптимальные условия (область рН, λ) для их контроля после каталитического эксперимента методом СФ.
2. Наибольшая степень деколоризации растворов красителей достигается при использовании композитов на основе нитрида бора с добавкой щавелевой кислоты, что связано с проявлением оптических свойств матрицы, красителей и оптимальными условиями (рН~5) для работы фотоактивной ферриоксалатной системы.
3. Методом сканирующей СФ установлено, что деколоризация растворов красителей происходит в результате деградации последних.
Исследования проведены при поддержке проекта РФФИ № 16-03-00635 а.



