Цианиды, несмотря на высокую токсичность и стоимость реагента цианистого натрия, по-прежнему широко используются в промышленности: ежегодно более 1 млн тонн этого вещества идет для нанесения гальванопокрытий, переработки металлов, производства органических химикатов, пластика и др. Так, высокотоксичные цианистые соединения присутствуют в промышленных стоках значительного числа рудообогатительных фабрик, гальванических цехов, металлургических и металлообрабатывающих заводов, газогенераторных станций, газовых и коксохимических производств [4]. Для обезвреживания указанных стоков по-прежнему широко используются методы с использованием «экологически небезопасных» или «экологически грязных» реагентов окислителей – гипохлориты, хлорная известь, жидкий хлор, сернистый газ и т.д. [3, 12, 14]. В связи с этим приоритетной целью экологизации производств в аспекте охраны окружающей природной среды является разработка и внедрение малоотходных технологий, формирование замкнутых технологических циклов, а также разработка и внедрение экологически безопасных технологий обезвреживания образующихся высокотоксичных стоков.
Проблема переработки жидких техногенных цианидсодержащих стоков может быть решена с использованием перспективных комбинированных окислительных процессов (Advanced Oxidation Processess – АОPs), в основе которых лежат реакции окислительной деструкции, инициированные генерируемыми in situ активными формами кислорода – высокореакционными кислородсодержащими радикалами [7, 8]. Для генерирования свободных радикалов широко используется комбинация экологобезопасных окислителей с физическим воздействием (ультрафиолетовое излучение, ультразвук) или с катализаторами (металлы переменной валентности, TiO2) [1, 10].
В последнее десятилетие из AOPs наиболее интенсивно применяются фотохимические методы с использованием экологически безопасных окислителей и/или катализаторов [15]. В качестве первичных окислителей при реализации AOP-процессов все чаще используются неорганические пероксосоединения (пероксид водорода, персульфаты), поскольку они являются источниками для образования вторичных более мощных и высокореакционноспособных окислителей – гидроксильных •OH и сульфатных анион-радикалов SO4-•. Для проведения фотохимических процессов применяют различные источники излучения (от коротковолновой УФ до инфракрасной области). На практике в качестве источников УФ-излучения широкое распространение получили ртутные газоразрядные лампы. Использование УФ-излучения получает все большее распространение для деструкции токсичных загрязнителей различной природы, в том числе и для обезвреживания цианистых соединений [9]. Ранее было использовано УФ-излучение в сочетаниях с пероксидом водорода, с катализатором TiO2 для деструкции устойчивых цианистых соединений, в том числе и гексацианоферратов [8, 11, 13]. Исследования деструкции устойчивых цианистых соединений с помощью ультрафиолетового излучения в комбинации с персульфатом ранее не проводились.
Целью настоящей работы явилось исследование фотохимического окисления устойчивых цианистых соединений, на примере гексацианоферратов, с применением УФ-излучения в присутствии экологически безопасного окислителя персульфата, его сравнительная оценка с уже известным способом использования пероксида водорода и разработка энергоэффективного комбинированного метода обезвреживания высокотоксичных сточных вод, содержащих устойчивые цианистые соединения.
Материалы и методы исследования
Объектом исследования выбраны гексацианоферраты [Fe(CN)6]4- и [Fe(CN)6]3-, поскольку являются одними из наиболее устойчивых (Кн = 1•10-35, 1•10-42 соответственно) цианистых соединений. Исследования фотохимических превращений гексацианоферратов проводили на модельных водных растворах K3[Fe(CN)6] с начальной концентрацией 100 мг/л (0,47 ммоль•л-1), приготовленных на дистиллированной воде (c = 2 мкСм/см). В работе использовали реагенты (гексацианоферрат калия, пероксид водорода, персульфат калия) марки «х.ч.». Содержание гексацианоферратов контролировали стандартным фотометрическим методом на фотометре КФК-3 [5]. Значения величин рН контролировали на универсальном иономере рН 150М [6]. Для подщелачивания растворов использовали 0,1 N раствор NaOH.
Исследования основных кинетических закономерностей фотохимического окисления K3[Fe(CN)6] с использованием разных окислительных систем ({УФ/S2O82-}, {УФ/H2O2}) осуществляли в проточном трубчатом фотореакторе с термостатированием (25 °С). Объем обрабатываемого раствора составлял 300 мл, скорость циркуляции υ = 0,5–0,6 л/мин. В качестве источника УФ излучения использовали ртутную газоразрядную лампу высокого давления ДРТ-400 с полихроматическим спектром излучения с максимумом лучистого потока при 365 нм, интенсивностью излучения 1,88 мВт/см2, которую определяли актинометрическим методом с ферриоксалатом калия [2].
Результаты исследования и их обсуждение
На первом этапе проведено сравнительное исследование кинетики окисления гексацианоферратов при прямом фотолизе и комбинированной обработке сочетанием прямого фотолиза с окислителями (S2O82-, H2O2) (рис. 1).
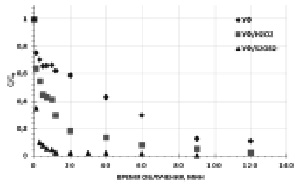
Рис. 1. Кинетические зависимости фотохимического окисления гексацианоферратов. [K3[Fe(CN)6]]0 = 0,47 мМ, [S2O82-]0 = [H2O2]0 = 4,7 мМ, рНисх = 6,2
Так, скорость окисления K3[Fe(CN)6] при прямом фотолизе составила W0 = 3××10-5 М×мин), в то время как при комбинированной УФ обработке в присутствии H2O2 (окислительная система УФ/H2O2) за счет дополнительного образования ·ОН радикалов вследствие диспропорционирования пероксида водорода по реакции
Н – О – О – Н + hv > 2•ОН,
значение W0 увеличилась в 1,7 раза – 5,2×10-5 М×мин. При сочетании же прямого фотолиза с S2O82- наблюдали почти трехкратное увеличение начальной скорости до 8,7·10-5 М×мин и фиксировали полную деструкцию K3[Fe(CN)6] через 90 мин экспозиции.
Увеличение эффективности окисления гексацианоферратов в присутствии персульфата обусловлено высокой окислительной способностью образующихся сульфатных анион-радикалов SO4-• по реакции
-SO3-O-O-SO3- + hv > 2SO4-•.
При этом необходимо учитывать образование дополнительного количества SO4-• в результате диспропорционирования персульфата ионами Fe3+ и Fe2+, выделившимися при деструкции K3[Fe(CN)6]:
Fe3+ + S2O82-> 2SO4-• + Fe2+
Fe2+ + S2O82-> SO4-• + SO42- + Fe3+,
а также •ОН в результате взаимодействия SO4-• с водой:
H2O + SO4-• > •OH + H+ + SO42-.
Кроме этого, известно, что окислительная система {S2O82-/ Fe3+} из-за сходства механизмов относится к Фентон-подобным системам.
Таким образом, можно заключить, что фотохимическое окисление с использованием окислителей – S2O82- и H2O2 ведет к глубокой конверсии исходного вещества, к снижению продолжительности обработки, что целесообразно для применения в области очистки сточных и оборотных вод различных производств. При этом окислительная система {УФ/S2O82-} более эффективна, чем {УФ/H2O2}. Сульфатные анион-радикалы являются реальной альтернативой гидроксильным радикалам, так как обладают более высоким окислительно-восстановительным потенциалом (Е0Н2О2 = 1,77В, Е0S2O82- = 2,5 – 3,1В), высокой реакционной способностью к большинству загрязнителей окружающей среды, по сравнению с пероксидом водорода имеют меньшую чувствительность к рН, а источники их образования, соли персульфаты, являются твердыми веществами, не теряющими своей активности длительное время, легко дозируются, что весьма удобно при использовании в технологиях обезвреживания.
Показатель кислотности среды рН является основным регулируемым параметром, существенно влияющим на эффективность протекания окислительных процессов. Известно, что цианидсодержащие сточные воды (СВ) гальванических цехов имеют рН среды в достаточно широком интервале от 2,8 до 11,5, а СВ и оборотные растворы золотоизвлекательных фабрик – 10–11. На примере модельных водных растворов гексацианоферратов рассмотрены прямой фотолиз и фотохимическое окисление с использованием окислительных систем – {УФ/S2O82-} и {УФ/H2O2} при повышенных значениях рН. На рис. 2 представлены кинетические зависимости фотохимического окисления гексацианоферратов при рН = 11.
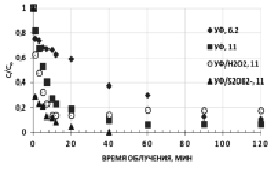
Рис. 2. Кинетические зависимости окисления K3[Fe(CN)6] при различных рН. [K3[Fe(CN)6]]0 = 0,47 мМ, [S2O82-]0 = [H2O2]0 = 4,7мМ
Полученные данные подтверждают эффективность комбинированных окислительных систем в щелочной среде. Причем действие окислительной системы {УФ/S2O82-} также более эффективно по сравнению с {УФ/H2O2}. Кроме того, по возрастающей остаточной концентрации исходного вещества установили, что в присутствии H2O2 процесс фотохимической деструкции K3[Fe(CN)6] при рН 11 носит обратимый характер, из-за образования интермедиатов, ингибирующих дальнейшую фотодеструкцию, либо накопления свободных CN- ионов с последующим связыванием их в исходный комплекс вследствие снижения концентрации вторичных окислителей – •ОН:
[Fe(CN)6]3- + H2O × [Fe(CN)5(H2O)]2- + CN-.
Проведена сравнительная оценка влияния фотохимического воздействия при деструкции гексацианоферратов разными окислительными системами {УФ/S2O82-}, {УФ/Н2О2} (таблица).
Деструкция K3[Fe(CN)6] в разных окислительных системах
|
Окислительная система |
Wo*10-5, М*мин |
τ1/2, мин |
D*50, мДж/см2 |
D**90, мДж/см2 |
Wo*10-5, М*мин |
τ1/2, мин |
D*50, мДж/см2 |
D**90, мДж/см2 |
|
рНисх = 6,2 |
рНисх = 11 |
|||||||
|
S2O82- (темновой) |
5,0 |
3,0 |
– |
– |
2,8 |
150 |
– |
– |
|
Н2О2 (темновой) |
0,85 |
> 150 |
– |
– |
0,52 |
> 150 |
– |
– |
|
{УФ} |
3,0 |
27,5 |
3102 |
13536 |
4,4 |
5,2 |
586,6 |
4512 |
|
{УФ/S2O82-} |
8,7 |
1,0 |
112,8 |
338,4 |
7,6 |
0,64 |
72,2 |
1241 |
|
{УФ/Н2О2} |
5,2 |
6,0 |
676,8 |
5640 |
6,3 |
2,75 |
310,2 |
13536 |
Примечание. * – доза УФ-излучения, тр
Так, сравнение начальных скоростей окислительной деструкции K3[Fe(CN)6] в темновых экспериментах показывает 5–6-кратную разницу между воздействием разных окислителей S2O82- и Н2О2. При дополнительном фотохимическом воздействии начальные скорости значительно увеличивались: для S2O82- – в 1,7–2,7 раза, для Н2О2 – 6–12 раз. При этом 50 % деструкция (t1/2) K3[Fe(CN)6] достигается при действии комбинированной окислительной системы {УФ/S2O82-} через 1 мин при рН 6,2 и через 0,64 мин при рН 11. В окислительной системе {УФ/Н2О2} преобладающий вклад в окислительную деструкцию гексацианоферратов вносит фотолиз, поскольку t1/2 составляло 6 мин (рН6,2) и 2,75 мин (рН 11), в то время как в темновых экспериментах t1/2 > 150 мин. В окислительной системе {УФ/S2O82-} взаимодействие носит аддитивный характер.
Далее нами проведена оценка доз УФ- излучения, требуемого для разложения 50 % и 90 % загрязнителя (D50, D90) в зависимости от рН обрабатываемого раствора (рис. 3).
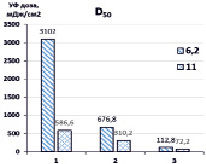
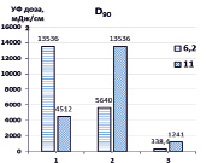
Рис. 3. Дозы УФ-излучения ртутной лампой, необходимые для деструкции 50 % и 90 % гексацианоферратов при различных рН. 1 – УФ, 2 – {УФ/H2O2}, 3 – {УФ/S2O82-}. [K3[Fe(CN)6]]0 = 0,47 мМ, [S2O82-]0 = [H2O2]0 = 4,7 мМ
Максимальные дозы D50 (3102 мДж/см2) требуются при прямом фотолизе УФ (рН 6,2), тогда как в присутствии окислителей необходимые дозы значительно снижались и составляли 678,8 мДж/см2 для {УФ/H2O2} и 112,8 мДж/см2 {УФ/S2O82-}. При этом при повышенных значениях рН требуются существенно меньшие дозы D50 УФ-излучения – при прямом фотолизе УФ (586,6 мДж/см2), в присутствии H2O2 – 310,2 мДж/см2, S2O82- – 72,2 мДж/см2. Дозы D90 УФ-излучения, необходимые для разложения 90 % K3[Fe(CN)6], значительно выше при прямом фотолизе и в системе {УФ/H2O2}, поскольку лимитирующей стадией деструкции гексацианоферратов является окисление цианид-ионов, высвободившихся из внутренней сферы комплекса, вторичными окислителями – гидроксильными радикалами до менее токсичных цианатов, в свою очередь, гидролизующихся до ионов аммония и диоксида углерода, и образование нерастворимых гидроксосоединений железа (II, III). В комбинированной системе {УФ/S2O82-} соответственно D90 УФ-излучения значительно ниже, поскольку в реакциях окисления участвуют кроме гидроксильных еще и сульфатные анион-радикалы.
По удельной энергоэффективности, скорости и продолжительности процесса обработки рассматриваемые окислительные системы можно выстроить в следующий ряд {УФ/S2O82-} > {УФ/H2O2} > {УФ}. Кроме того, следует отметить, что при использовании S2O82- процесс фотохимического окисления K3[Fe(CN)6] носит необратимый характер.
На основании полученных данных нами впервые предложен эффективный способ обезвреживания устойчивых цианистых соединений, в том числе гексацианоферратов, с использованием комбинированной окислительной системы {УФ/ S2O82-}.
Заключение
Изучены кинетические закономерности фотохимического окисления устойчивых цианистых соединений, на примере гексацианоферратов, комбинированной обработкой сочетанием прямого фотолиза с персульфатом (окислительная система {УФ/S2O82-}), пероксидом водорода (окислительная система {УФ/H2O2}). Показана возможность реализации процессов окисления в широком диапазоне рН среды. По удельной энергоэффективности, скорости и продолжительности процесса обработки рассматриваемые окислительные системы можно выстроить в следующий ряд {УФ/S2O82-} > {УФ/H2O2} > {УФ}. Эффективная деструкция гексацианоферратов в комбинированной системе {УФ/S2O82-} обусловлена высокой окислительной способностью сульфатных анион-радикалов SO4-•, образующихся вследствие фотолиза персульфата и его диспропорционирования ионами Fe3+ и Fe2+, выделившимися при деструкции [Fe(CN)6]3-, а также образованием дополнительного количества •ОН радикалов в результате взаимодействия SO4-• с водой. Разработанный способ может быть рекомендован для очистки сточных вод, содержащих высокотоксичные цианистые соединения в местностях с повышенной солнечной активностью. Следовательно, существует возможность осуществления процесса обезвреживания цианидсодержащих сточных вод за счет действия естественных природных факторов.



