Возрастающая полирезистентность патогенных микроорганизмов и особенно их госпитальных штаммов стала одной из наиболее грозных проблем здравоохранения многих стран мира [2, 7, 13]. Если в 1970-е гг. впервые были замечены микроорганизмы, устойчивые к целым группам антибактериальных препаратов, то в конце 1990-х гг. уже появились штаммы, приобретшие устойчивость ко всем известным тогда антибиотикам. Казалось бы, с открытием антибиотиков такие тяжелые инфекционные процессы, как сепсис, перитонит, гангрена стали совершенно управляемыми, однако уже сегодня, вследствие предопределенной генетически высокой приспосабливаемости бактерий к условиям среды, они опять уносят жизни миллионов людей.
Генетический аппарат бактерий достаточно прост и включает всего лишь одну хромосому, содержащую порядка 3000 генов, и плазмиды – содержащие не более пары сотен генов, которые, однако, очень мобильны. Многие из этих участков ДНК, являясь транспозонами, легко перемещаются из плазмиды в плазмиду или непосредственно в хромосому, что обеспечивает их быстрое распространение внутри популяций, видов и даже между различными видами бактерий. Эти процессы в ходе борьбы за существование, наряду со спонтанными мутациями, являются основными причинами появления приобретенной устойчивости микроорганизмов к еще вчера высокоэффективным препаратам [6, 13]. Изменения проницаемости клеточной стенки, модификация мишени, выработка ферментов являются основными общепризнанными причинами постепенно развивающейся устойчивости микроорганизмов к антибактериальным препаратам [6, 13]. В частности, хорошо известно [3], что применение большинства лекарственных средств класса бета-лактамов в терапии современных внутрибольничных инфекций сопряжено с высоким риском неудачи, что требует назначения дорогостоящей и не всегда возможной целевой эмпирической комбинированной антибиотикотерапии. В этой связи, очевидно, что поиск новых эффективных методов борьбы с бактериальными инфекциями, и в особенности с их нозомикальными штаммами, обладающими перекрестной резистентностью, является одним из несомненных приоритетов отечественного здравоохранения.
Антибактериальная фотодинамическая терапия (ФДТ) представляет собой принципиально отличную от антибиотикотерапии стратегию лечения множества заболеваний, основанную на селективном накоплении и удерживании в атипичных или поврежденных клетках человека, а также непосредственно в клетках микроорганизмов окрашенных веществ – фотосенсибилизаторов (ФС). Эти вещества при воздействии видимого света определенной длины волны и соответствующей мощности генерируют активные формы кислорода, что позволяет эффективно инактивировать атипичные клетки и микроорганизмы путем запуска каскада фотохимических реакций [8, 9, 11, 12, 15]. К настоящему времени в клинической практике используется ряд ФС для диагностики и лечения онкологических заболеваний, гнойно-воспалительных заболеваний ЛОР-органов, обработки ран и т.д. [8, 9, 11, 12, 15]. В отличие от антибиотиков противомикробное действие ФДТ не снижается со временем, а у патогенов не развивается устойчивости к ней [11, 15]. Бактерицидный эффект при этом лимитируется зоной лазерного облучения сенсибилизированных тканей, что позволяет избежать при проведении ФДТ генерализации побочных эффектов, наблюдаемых при применении антибиотиков и антисептиков. Заживление происходит по типу естественных репаративных процессов, поэтому метод является наиболее органосохраняющим, а также легко переносимым, что позволяет повторять лечение при необходимости многократно.
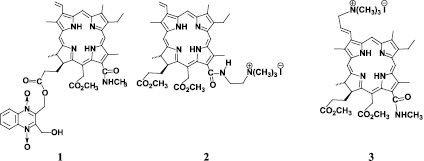
Вместе с тем использование существующих фотосенсибилизаторов для антибактериальной ФДТ имеет свои недостатки. В меру нашего понимания данной проблемы важнейшими из них являются высокая стоимость лечения, длительная остаточная фототоксичность для ряда препаратов, таких как «Фотогем» и «Фотосенс», недостаточная степень чистоты ряда ФС, часто представляющих собой смесь родственных соединений [8, 9]. Нами был синтезирован, очищен и идентифицирован ряд соединений хлоринового типа (соед. 1–6) с целью разработки препаратов для антибактериальной ФДТ. С целью моделирования внутриклеточного транспорта была изучена их способность к генерации синглетного кислорода, распределение между псевдолипидной и водной фазами [4, 5, 16].
В настоящей работе представлены результаты лабораторного исследования антимикробной активности полученных препаратов в отношении дрожжеподобных микроскопических грибов (Candida аlbicans ССМ 8261 АТСС 90028), грам-положительных (Staphylococcus aureus 6538-Р АТСС = 209-Р FDA), грам-отрицательных (Escherichia coli М-17) бактериальных штаммов.
Материалы и методы исследования
Синтез, очистка и идентификация препаратов
Изученные фотосенсибилизаторы (соед. 1–6): 1 – 17(3)-(2,3-дигидроксиметил-1,4-хиноксалин)-13(1)-N-метиламид хлорина е6, 2 – 13(1)-(N′N′′N′′′-триметиламиноэтил)амид хлорина е6 йодид; 3 – 3(2)-(N′N′′N′′′-триметиламинометил)-13(1)-N-метиламид хлорина е6 йодид; 4 – 3(1),3(2)-бис-(N′N′′N′′′-триметиламинометил)-13(1)-N-метиламид хлорина е6 дийодид; 5 – 3(2)-(N′N′′N′′′-триметиламинометил),13(1)-(N′N′′N′′′-триметиламиноэтил)амид хлорина е6 дийодид и 6 – 3(1),3(2)-бис-(N′N′′N′′′-триметиламинометил),13(1)-(N′N′′N′′′-триметиламиноэтил)амид хлорина е6 трийодид были получены путем химической модификации хлорофилла, а точнее, его производного метилфеофорбида а, выделенного экстракцией из сине-зеленой водоросли Spirulina Platensis [1, 10, 14]. Очистку препаратов проводили путем колоночной хроматографии, а также перекристаллизацией. Спектральную идентификацию полученных соединений проводили методами масс-спектрометрии, ядерного магнитного резонанса и электронной спектроскопии. Подробная методика синтеза и идентификации соединений будет описана позднее в специализированной статье.
Растворы ФС готовились следующим образом. Препараты 2–6 готовились путем непосредственного растворения заданного количества вещества в воде для достижения концентрации 10–4 моль/кг. Нерастворимый в воде ФС 1 предварительно был растворен в небольшом количестве ацетона, содержащем расчетное количество ТВИН 80. Затем ацетон был выпарен под вакуумом при температуре 50 °С и постоянном перемешивании. Далее к полученной вязкой жидкости под действием ультразвука (40 кГц; 70 Вт) постепенно добавлялось расчетное количество 10 % водного раствора этанола до образования мицеллярного раствора ФС с содержанием ПАВ 1 мас. %. Проведенный анализ показал, что полученный раствор оставался стабильным в течение 2–3 недель.
Методика подготовки посевной дозы тест-культур
Суточные культуры тест-штаммов на скошенном мясопептонном агаре смывали физиологическим раствором и доводили до концентрации 500 млн микробных клеток в 1 мл (5 единиц по оптическому стандарту мутности). Посевную дозу 1000 клеток в 1 мл готовили из исходной стандартной взвеси многократным разведением.
Посев тест-культур на плотные питательные среды
На плотные питательные среды проводили посев описанных тест-культур. В чашки Петри с плотной питательной средой вносили 1 мл (1000 клеток) тест-культуры бактерий или грибов. Посев Staphylococcus aureus проводили в чашки Петри с желточно-солевым агаром (ЖСА), Escherichia coli – в чашки Петри со средой Эндо, Candida albicans – в чашки Петри со средой Сабуро. На подсушенные среды с тест-культурой накладывали исследуемые образцы, представляющие собой обработанные водным раствором соответствующего ФС кусочки фильтровальной бумаги, размером 7,5*7,5 мм. Через полчаса проводили сеанс ФДТ. Далее чашки Петри инкубировали 24 часа в термостате при 37 °С. О результатах испытаний судили по степени угнетения зоны роста тест-культуры вокруг исследуемых образцов.
Посев тест-культур в жидкую питательную среду
В этой серии экспериментов в каждую лунку четырех стандартных луночных планшетов вносили 0,5 мл мясопептонного бульона с тест-культурой микроорганизмов (посевная доза 1000 клеток) и 0,5 мл раствора фотосенсибилизатора. Через полчаса инкубации проводили сеанс ФДТ. Далее планшеты выдерживали 24 ч при температуре 37 °С. Для подтверждения наличия бактерицидных свойств у исследуемых образцов проводился высев из всех лунок на чашки Петри с плотной питательной средой для подсчета колониеобразующих единиц (КОЕ).
Моделирование ФДТ in vitro
Моделирование антибактериальной ФДТ проводили в затемненном помещении при комнатной температуре путем облучения чашек Петри или планшетов с тест-культурами с помощью специального светодиодного источника видимого света («БМЦ», Минск) с регулируемой мощностью излучения и водяным охлаждением. Максимальная мощность излучения светодиодного планшета 0,2 Вт/см2, площадь засвечиваемой поверхности 100 см2, диапазон длин волн падающего света 660 ± 15 нм. Мощность излучения, расстояние до образца и время воздействия подбирались таким образом, чтобы обеспечить равномерное засвечивание исследуемых бактериальных культур, сообщив им дозу излучения 40 Дж/см2 за время проведения обычной физиотерапевтической процедуры в клинике ~15 мин.
Результаты исследования и их обсуждение
Антибактериальная ФДТ на плотных питательных средах
Результаты проведенных исследований показали, что при нанесении красителей на фильтровальную бумагу и помещении ее на плотную питательную среду с микроорганизмами, не все исследуемые образцы после проведенного облучения подавляют рост тест-культур: Staphylococcus аureus, Escherichia coli и грибов Candida albicans. В первой серии экспериментов при нанесении одной капли раствора ФС концентрацией 0,0001 моль/кг на фильтровальную бумагу, относительно высокую активность в отношении золотистого стафилококка продемонстрировали образцы 2, 3, 4 (рисунок), показавшие зоны задержки роста на среде ЖСА 15, 14 и 14 мм соответственно. В отношении Escherichia coli и грибов Candida albicans какой-либо антибактериальной активности установить не удалось.


а а?


б б?


в в?
Рост колоний Staphylococcus aureus (а, а?), Candida Albicans (б, б?) и Escherichia coli (в, в?) на питательных средах, содержащих ФС (нумерация на рисунке соответствует номерам соединений) до (а, б, в ) и после однократного облучения (а?, б?, в?).видимым светом с дозой 40 Дж/см2. Нумерация секторов соответствует номерам соединений 1–6
Во второй серии экспериментов исследуемые образцы наносили на фильтровальную бумагу путем погружения ее в раствор ФС и далее раскладывали в чашки Петри со средами ЖСА, ЭНДО, Сабуро, содержащими тест-культуры. И в этом случае была подтверждена незначительная активность ФС в отношении микроорганизмов. Лишь образцы 3 и 4 показали зону задержки роста (по 12 мм) в отношении золотистого стафилококка. Был сделан вывод, что при нанесении красителя на бумагу он достаточно сильно связывается с целлюлозой, что наряду с использованием в экспериментах плотной питательной среды ослабляет диффузию ФС и накопление его в достаточном количестве в микробных клетках. Отсюда следует, что использование, например, любых текстильных материалов, пропитанных растворами препаратов, при нанесении на раневую поверхность для проведения ФДТ может оказаться неэффективным из-за недостаточного увлажнения раны и малого времени инкубации. Для плотных сред это время должно быть, по-видимому, значительно больше 30 минут.
Результаты испытаний образцов в жидкой питательной среде
В эксперименте с жидкими питательными средами перед проведением ФДТ смешивали в равных количествах раствор ФС с концентрацией 0,0001 моль/кг и мясопептонного бульона, содержащего исследуемую тест-культуру. Далее раствор выдерживали при комнатной температуре в течение получаса и проводили сеанс ФДТ. Оценивали как темновую, так и световую токсичность исследуемых препаратов с рабочей концентрацией 0,00005 моль/кг.
Как видно из рисунка, до облучения образцы 1 и 2 дали сплошной рост культуры стафилококка и, таким образом, не обладали темновой цитотоксичностью (собственным антибактериальным действием), остальные образцы роста не показали. После облучения образец № 1 – дал рост 43 КОЕ, образец № 2 – не дал роста, что демонстрировало их высокую антимикробную активность после облучения сенсибилизированной культуры (95,7 и 100 % эффективность – соответственно), остальные образцы не дали роста.
При исследовании темновой цитотоксичности в отношении грибов Candida albicans образцы 1, 2, 4 не дали роста, то есть фактически обладали темновой цитотоксичностью. Наоборот, образцы, обладавшие темновой цитотоксичностью в отношении стафилококка 3, 5, 6 дали рост – 30, 12 и 8 КОЕ соответственно. После сообщения препаратам дозы 40 Дж/см2 рост дал только образец 3 (6 КОЕ), что демонстрировало прекрасный антимикробный эффект (80 % у образца № 3 и 100 % у образцов № 5 и 6, которые не дали роста).
Изучение антибактериальной активности ФС в отношении грамотрицательного патогена – кишечной палочки привело к весьма неожиданным результатам. Как видно, до облучения все образцы дали сплошной рост культуры E. coli. После облучения образец 1 продемонстрировал хорошее антимикробное действие, дав рост 30 КОЕ (эффективность 97 %). В остальных случаях был зафиксирован сплошной рост. Очевидно, что наблюдаемая картина связана исключительно с уникальным строением внешней оболочки грамотрицательных бактерий, имеющих внешнюю липополисахаридную мембрану. Как видно, лишь один самый гидрофобный препарат (1) оказался в состоянии преодолеть липополисахаридный слой и проявить выраженную антибактериальную активность. Остальные положительно заряженные и значительно более гидрофильные ФС, которые в принципе могли бы проникнуть в клетку через пориновые каналы, во время проведения эксперимента находились, по-видимому, на внешней поверхности мембраны, что и предопределило отсутствие антибактериального действия.
Выводы
Проведенное нами исследование антибактериальной активности пяти ФС хлоринового ряда в отношении фирмикутных бактерий Staphylococcus aureus, грациликутных бактерий Escherichia coli и грибов Candida albicans показало, что использование ФС, адсорбированных на твердых поверхностях, в случае плотных питательных сред в целом малоэффективно. По результатам испытаний установлено, что лишь моно- и дизаряженные ФС (соед. 2 и 5) демонстрируют достаточно высокую активность в отношении золотистого стафилококка. В отношении остальных микроорганизмов активности практически не обнаруживается.
При использовании жидких питательных сред показано, что катионные ФС соед. 2–6) в зависимости от величины заряда и положения заряженной группы в молекуле ФС обнаруживают как темновую, так и световую токсичность в отношении Staphylococcus aureus и Candida albicans при очень незначительных концентрациях порядка 0,00005 моль/кг. В ряде случаев после облучения удается достичь 100 % гибели всех микроорганизмов. Однако в случае кишечной палочки заряженные ФС оказались неэффективными, хотя в работах [14, 15] отмечается, что именно катионные ФС должны проявлять антимикробную активность в отношении грамотрицательных микроорганизмов, что и было зафиксировано, в частности, для синегнойной палочки [15]. По-видимому, в нашем случае необходимо использовать более концентрированные растворы ФС и значительно увеличить время инкубации, дав возможность препаратам в достаточном количестве проникнуть внутрь микробной клетки. Увеличение дозы светового излучения также должно повысить эффективность ФДТ.
Среди исследованных соединений лишь гидрофобное диоксидиновое производное хлорина е6 (соед. 1) обнаружило достаточно эффективное действие в отношении всех трех видов микроорганизмов при малой темновой токсичности, что позволяет на данном этапе считать его достаточно перспективным для проведения антибактериальной ФДТ.
Работа выполнена при поддержке Российского научного фонда – проект № 15-13-00096.



