В работе основные закономерности процесса окислительного осаждения поливалентных металлов исследовали на примере окислительно-восстановительных переходов ионов марганца. Суть работы заключалась в разработке эффективных технологических параметров процесса окислительного осаждения из водных растворов ионов марганца Мn2+ в виде дисперсной фазы МnО2 с использованием хлорсодержащих окислителей. В качестве хлорсодержащих окислителей использовали: раствор хлорной извести и электролизный гипохлоритный раствор, полученный при электрообработке растворов хлорида натрия (различной концентрации).
Процесс окисления ионов марганца (II) суспензией хлорной извести Са(ОСl)2 до марганца (IV) в общем случае протекает по схеме:
Мn2+ + Са(ОСl)2 > СаСl2 + МnО2 v
Хлорная известь, содержащая анион слабого электролита (Кк (НСlО) = 5•10–8), в водном растворе гидролизуется с образованием хлорноватистой кислоты, которая под воздействием прямого солнечного света, а также в результате взаимодействия с восстановителем (ионами Мn2+) преобразуется в соляную кислоту и атомарный кислород, который и участвует в процессе окисления марганца (II) до марганца (IV) по схеме [1, 6, 8]:
Са2+ + 2ОСl– + 2Н2О > Са2+ + 2ОН– + 2НОСl;
НОСl > НСl + О•;
Мn2+ + О• > МnО2v.
В общем случае процесс окисления марганца (II) электролизными гипохлоритными растворами до марганца (IV) протекает по схеме [2, 7]:
Мn2+ + СlО– + 2ОН– > Сl– + МnО2v + Н2О;
Мn2+ + НСlО + Н2О > Сl– + МnО2v + 3Н+.
Образующиеся гипохлорит-ионы и хлорноватистая кислота в процессе электролиза раствора хлорида натрия при взаимодействии с ионами Мn2+ восстанавливаются до хлорид-ионов и атомарного кислорода, действия которого аналогичны, как и в случае с растворами хлорной извести [6]. Поэтому очевидно, что и в первом и во втором случае в качестве окислителя выступает атомарный кислород, образующийся в процессе восстановления гипохлорит-ионов и хлорноватистой кислоты. Поэтому эффективность используемых окислителей напрямую будет зависеть от количества образующего атомарного кислорода в рассматриваемых реагентах. В дальнейшем хлор и его кислородные соединения будем называть общепринятым термином «активный хлор» [9, 12].
С целью определения эффективности применения первого и второго реагента-окислителя при окислении марганца (II) были проведены сравнительные исследования по определению оптимальной продолжительности обработки марганецсодержащих растворов данными окислителями, а также по определению фактического расхода каждого окислителя на извлечение 1 мг марганца (II) из растворов в виде осадка MnО2.
Результаты проведенных исследований показали, что оптимальное время протекания процесса окисления для раствора хлорной извести – 30 минут с момента начала реакции. Тогда как полное количественное извлечение марганца (II) из раствора в виде осадка MnО2 с использованием электролизных кислородосодержащих соединений хлора, полученных электрообработкой растворов хлорида натрия, наблюдалось после протекания процесса окисления в течение 3 минут.
Экспериментальный расчет фактического расхода окислителя на извлечение 1 мг Mn2+ в виде осадка MnО2 показал, что при использовании в качестве реагента-окислителя растворов хлорной извести в фактический расход «активного хлора» составил 3,35 мг, тогда как расход «активного хлора» в случае использования электролизных растворов составил 2,41 мг. Расчёт расхода реагента окислителя, необходимого для полного извлечения заданной концентрации ионов Mn (II) из исследуемого раствора проводили с использованием диаграммного метода, предложенного М.И. Лапшиным и И.Г. Нагаткиным. Суть метода заключается в определении хлороемкости раствора путем построения графической зависимости концентрации введенного «активного хлора» от концентрации остаточного «активного хлора» в растворе [6].
Значительная разница в количественном расходе реагента-окислителя на извлечение 1 мг Mn2+ и скорости протекания реакции может объясняться тем, что количество «активного хлора» в хлорной извести весьма незначительное (30–36 %). Замедление скорости гидролиза хлорной извести происходит благодаря известной стойкости гипохлорита кальция, а также следует учитывать, что техническая хлорная известь содержит много неактивных примесей, снижающих ее ценность как окислителя [5, 6]. Кроме того, процесс гидролиза хлорной извести, протекающий с образованием «активного хлора» протекает медленнее, чем процесс гидролиза молекулярного хлора, образующийся в процессе электролиза:
Сl2 + Н2О > НСl + НОСl.
Таким образом, на данном этапе проведения исследований была однозначно установлена целесообразность использования в качестве реагента-окислителя только электролизных растворов, содержащих «активный хлор».
С целью выбора оптимальных условий взаимодействия электролизных растворов «активного хлора» с раствором, содержащим ионы Mn2+, в работе были рассмотрены два способа контакта окислителя с марганецсодержащим раствором:
- в первом случае рассматривался вариант реагентного осаждения Mn (II) электролизными растворами «активного хлора». Для этого водный раствор окислителя предварительно получали в электролизере бездиафрагменного типа путем электрообработки растворов хлорида натрия. Далее полученный раствор «активного хлора» вводили в водную систему, содержащую ионы Mn2+;
- во втором случае рассматривался вариант электрокоагуляционного извлечения Mn (II), протекающий в результате окисления ионов Mn2+ «активным хлором» до нерастворимых форм и последующего электрокоагуляционного осаждения коллоидных хлопьев марганца в виде дисперсной фазы. Для этого в раствор, содержащий ионы Mn2+, предварительно вводили хлорид-ионы в виде раствора хлорида натрия и затем проводили электролиз всей системы (при аналогичных первому случаю параметрах работы электролизера).
Необходимо учитывать, что окислительная активность хлорсодержащих окислителей, полученных путем электрообработки растворов в значительной степени зависит от условий проведения процесса электролиза. Так, при электролизной обработке низкоконцентрированных растворов NaCl (концентрация хлорид-ионов менее 300 мг/дм3) степень превращения хлорид-ионов в «активный хлор» достаточно невысокая (2–5 %) и количество окислителя образующегося окислителя мало [3, 4]. Также следует отметить, что при нагревании раствора хлорида натрия увеличивается вероятность протекания побочных процессов, приводящих к образованию хлорат-ионов, которые обладают значительно меньшей окислительной активностью, чем ионы СlО– и НСlО [10, 11].
В ходе экспериментальных исследований было установлено, что окислительное осаждение ионов марганца (II) из раствора в виде осадка МnО2 возможно в достаточно широком интервале рН от 4,5 до 10,5. Однако, основываясь на данных проведенного теоретического анализа особенностей химических превращений кислородсодержащих соединений хлора при разных значениях рН раствора, можно сделать вывод, что процесс окислительного осаждения ионов марганца (II) целесообразно проводить в диапазоне рН системы от 7,0 до 7,6, т.к. данный диапазон рН характеризуется наивысшей окислительной активностью кислородных соединений хлора (рисунок).
Такие особенности изменения окислительной активности хлорсодержащих окислителей объясняются тем, что указанные соединения, являясь сопряженными кислотой и основанием (HClO + H2O; H3O+ + ClO–; ClO– + H2O; HClO + OH–), образуют в указанном диапазоне рН метастабильную систему, способную генерировать ряд соединений и частиц, обладающих гораздо большим окислительным действием, нежели хлорноватистая кислота: ClO•– гипохлорит-радикал; Cl• – хлор-радикал; O• – атомарный кислород; ОН• – радикал гидроксила. Катализаторами реакций с участием хлоркислородных соединений будут ионы H+ и OH–, существующие в воде также приблизительно в равных количествах при значениях рН, близких к нейтральному.
Активные радикалы СlО• могут способствовать реакциям образования атомарного кислорода и ОН• радикала
2СlО− + СlО• + ОН− > 3Сl– + ОН• + 3/2О2
(процесс, определяющий скорость разложения гипохлорита);
ОН− + ОН• > Н2О + О•
(быстрый процесс выделения атомарного кислорода);
ОН• + СlО− > СlО• + ОН–
(менее вероятный процесс продолжения побочного развития цепи в сильнощелочной среде).
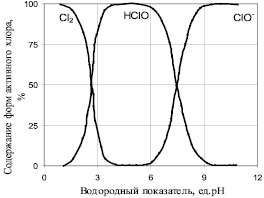
Содержание форм активного хлора в растворе при различных значениях рН [12]
В присутствии ионов металлов переменной валентности, помимо процесса восстановления «активного хлора» до хлорид-ионов могут так же протекать процессы восстановления хлоратов до ионов Cl− [12]. Поэтому можно предположить, что атомарный кислород можно получить каталитическим разложением «активного хлора» во всем диапазоне рН, в котором хлор находится в растворе в виде кислородных соединений. Реакции с участием кислорода также зависят от кислотности среды. В щелочной среде скорость переноса кислорода в 50 раз меньше, чем в нейтральной и слабокислой средах, что в итоге отражается на процессе окисления [1, 11]. Этим объясняются выводы ряда авторов о том, что окислительные процессы в гипохлоритных растворах протекают с участием преимущественно хлорноватистой кислоты [1, 9, 10, 12].
Таким образом, можно констатировать, что окислительный процесс во многих случаях происходит с разложением «активного хлора» на атомарный кислород и хлорид-ион. Атомарный кислород участвует в окислительном процессе, а хлорид-ион остается в растворе. Присутствие катионов Mn2+ оказывает катализирующее действие на процесс восстановления «активного хлора», что значительно ускоряет время протекания процесса.
Полученные в работе кинетические зависимости процесса окислительного осаждения показали, что в случае реагентного осаждения Mn (II) электролизными растворами «активного хлора», оптимальным временным интервалом протекания процесса окислительного осаждения будет 3 минуты с момента начала реакции. При электрокоагуляционном осаждении Mn (II) процесса полного осаждения фиксируется после 30 секунд с момента начала реакции.
Таким образом, очевидно, что процесс окислительного осаждения ионов марганца (II) из растворов в виде осадка MnО2 протекает с большей скоростью при электролизной обработке всей модельной системы, содержащей изначально ионы марганца (II) и необходимую концентрацию хлорид-ионов, т.е в случае электрокоагуляционного осаждения.
На основании проведенных исследований было установлено, что фактический расход реагента-окислителя зависит от способа взаимодействия марганецсодержащего раствора с реагентом-окислителем (при исходно равных концентрациях хлорид-ионов – 300 мг/дм3). Так, при введении реагента-окислителя в марганецсодержащую модельную систему в виде электролизного гипохлоритного раствора на извлечение 1 мг марганца (II) из раствора, в виде осадка MnО2 фактически расходовалось 2,41 мг «активного хлора». В случае процесса электрокоагуляции на извлечение 1 мг марганца (II) из фактически расходовалось 1,32 мг «активного хлора».
Следовательно, более эффективно и при меньшем расходе реагента-окислителя процесс окислительного осаждения ионов марганца (II) протекает при электролизной обработке всей модельной системы, содержащей изначально необходимую концентрацию хлорид-ионов.
Такая особенность поведения ионов марганца (II) в растворах гипохлоритов может объясняться тем, что образующийся «активный хлор» в присутствии ионов Mn2+ отличается высокой окислительной активностью. Марганец в данном случае выступает как катализатор процесса восстановления «активного хлора», приводящего к образованию атомарного кислорода и хлорид-ионов. Поэтому при электролизной обработке всей модельной системы, содержащей изначально ионы марганца (II) и необходимую концентрацию хлорид-ионов, существенно снижается время протекания процесса и количество расходуемого реагента-окислителя.
Выводы
Проведенные исследования подтвердили эффективность использования метода окислительного осаждения в присутствии хлорсодержащих окислителей для количественного извлечения из растворов ионов Mn2+ в виде дисперсной фазы. Максимальные показатели извлечения достигают 99,9 %.
Согласно проведенным исследованиям были установлены рациональные технологические параметры окислительного осаждения ионов марганца хлорсодержащими окислителями:
– процесс окислительного осаждения более эффективно проводить путем электролизной обработки водных растворов, содержащей изначально ионы марганца (II) и необходимую концентрацию хлорид-ионов;
– диапазон рН водных растворов поддерживается в интервале от 7,0 до 7,6;
– время электрообработки водной системы – 30 секунд;
– концентрация хлорид-ионов в растворе не менее 300 мг/дм3;
– расход на осаждение ионов марганца (II) хлорсодержащего окислителя рассчитывается из соотношения 1:1,32 мг.
При этом следует отметить, что применение электролизных гипохлоритных растворов в качестве реагента-окислителя для извлечения марганца (II) из растворов имеет ряд следующих преимуществ:
– процесс окисления характеризуется высокой скоростью протекания;
– процесс окисления обеспечивает использование безопасного реагента;
– для полного количественного извлечения марганца требуется незначительный расход реагента-окислителя ввиду высокой окислительной способности растворов, образующихся в процессе электролиза;
– возможность проводить окисление всего объема сточной воды без создания зон с повышенной концентрацией реагента благодаря его дозированной и пропорциональной обрабатываемому потоку воды подаче;
– отсутствует вторичное загрязнение воды, т.к. для получения гипохлоритных растворов методом электролиза возможно использование оборотной воды с определенным исходным содержанием хлоридионов, а при недостаточной их концентрации в оборотной воде (для извлечения заданного содержания марганца) возможно дополнительное введение хлорида натрия в оборотную воду, подаваемую в электролизер;
– стоимость производства гипохлорита натрия на месте в несколько раз дешевле покупки и транспортировки уже готового продукта;
– компактность и простота используемой аппаратуры;
– возможность автоматизации процесса.
Кроме того, гипохлоритный раствор, полученный электрохимическим методом из водных растворов хлорида натрия, не токсичен, легко отдает активный кислород, имеет небольшую молекулярную массу и малые размеры, благодаря чему легко проходит через клеточные мембраны и, следовательно, может окислять токсины, находящиеся не только в растворе, но и в клеточных структурах, что дает возможность использовать полученные растворы не только для извлечения марганца, но и для обеззараживания бытовых стоков.



