Одним из методов анализа, позволяющих исследовать равновесия в растворах, а также проводить достаточно точные определения веществ в различных материалах, является спектрофотометрия. Изучение реакций комплексообразования органических реагентов с различными ионами металлов, в том числе и многовалентных, остается актуальным и по сей день, поскольку вносит определенный вклад в развитие химии координационных соединений, а также имеет практическое применение при идентификации и количественном определении лекарственных препаратов [3, 4, 5, 8]. Целью работы явилось исследование возможности количественного спектрофотометрического определения аминокапроновой кислоты по реакции с фталексоном SA в присутствии ионов празеодима.
В работе использована аминокапроновая кислотa, являющаяся ингибитором кининов (биогенных полипептидов, образуемых в организме из α-глобулинов под влиянием калликреина). Обладает антиаллергическим действием, угнетает образование антител, повышает детоксикационую функцию печени. Применяют для остановки кровотечений при хирургических вмешательствах и различных патологических состояниях, при которых повышена фибринолитическая активность крови и тканей [9].
Раствор фталексона SA (ФТSA) (10-3 М) готовили по точной навеске препарата с учетом влажности, стабилизировали несколькими кристаллами HgI2 и разбавляли до концентрации 2·10-4 непосредственно перед работой. Раствор соли (10-2 М) празеодима (III) готовили из препарата Pr(NO3)3 марки «х.ч.» и разбавляли до рабочей концентрации 2·10-4 М. Фармацевтический препарат аминокапроновой кислоты использовали в виде раствора помещенного во флакон объемом 100 мл, содержание основного вещества в растворе 50 г. Молярная концентрация аминокапроновой кислоты в исходном растворе 3,817 моль/л. Исходный раствор препарата перед работой не разбавляли. В работе использовали аммиачно-ацетатные и солянокисло-ацетатные буферные смеси. рН в готовых аналитических системах контролировали на лабораторном иономере И-130 и с помощью универсальной индикаторной бумаги. Все растворы готовили на бидистилляте. Фотометрировали на спектрофотометре ПЭ-5400В в кювете с расстоянием между светопропускающими гранями 1 см. Все опыты проводились не менее чем в трех повторах, данные для градуировочной кривой получали приготовлением растворов не менее чем в пяти повторах.
С целью идентификации комплексных соединений в системе ФТSA – Pr получены абсорбционные кривые красителя и его же в присутствии ионов Pr в широком диапазоне кислотности среды с рН от 2 до 10. При рН 4, 5 они приведены на рис. 1–2.
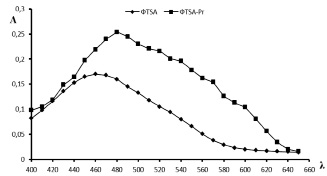
Рис. 1. Абсорбционные кривые ФТSA и системы ФТSA-Pr при рН 4
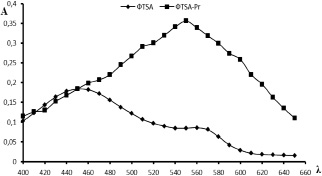
Рис. 2. Абсорбционные кривые ФТSA и системы ФТSA-Pr при рН 5
Таблица 1
Основные спектрофотометрические характеристики системы ФТSA – Pr(III)
|
рН |
?max реагента, нм |
λmax системы, нм |
Δ λ,нм |
|
2 |
450 |
460 |
10 |
|
3 |
460 |
470 |
10 |
|
4 |
460 |
480 |
20 |
|
5 |
450 |
550 |
100 |
|
6 |
560 |
560 |
0 |
|
7 |
560 |
560 |
0 |
|
9 |
560 |
560 |
0 |
Основные спектрофотометрические характеристики двойной системы представлены в табл. 1.
Анализ абсорбционных кривых показал, что комплексообразование ионов празеодима (III) с ФТSA происходит при рН 5. Простейшее соотношение компонентов реакции в составе комплекса устанавливали методом изомолярных серий (рис. 3).
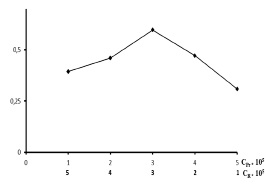
Рис. 3. Определение состава методом изомолярных серий
Таблица 2
Основные спектрофотометрические характеристики комплекса ионов Pr с ФТSA
|
рН |
λR, нм |
λк, нм |
Δλ, нм |
Pr:R |
λRx- |
ε·10-4 |
|
5 |
450 |
550 |
100 |
1:1 |
560 |
2,86 |
Так как комплекс моноядерный, молярный коэффициент светопоглощения установлен по методу Н.П. Комаря [6]. Основные спектрофотометрические характеристики комплекса ионов Pr с ФТSA приведены в табл. 2.
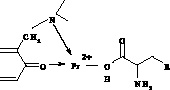
Согласно спектрофотометрическим характеристикам, полоса поглощения комплекса находится в длинноволновой области видимой части спектра (550 нм). Учитывая глубину окраски комплекса, а также простейшее стехиометрическое соотношение (1:1) компонентов в его составе, структуру координационного узла можно представить в виде следующих наиболее вероятных схем (рис. 4).
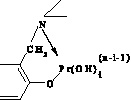
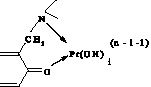
а) б)
Рис. 4. Возможные структуры координационного узла: а) образование комплекса происходит по кислороду ОН-группы и третичному азоту иминодиацетатной группировки бензольного кольца; б) образование комплекса происходит по кислороду хиноидного кольца и третичному азоту иминодиацетатной группировки
Для выяснения химизма реакции и уточнении структуры координационного узла, был использован метод В.А. Назаренко [10], который позволяет определить форму комплексообразователя и лиганда, число отщепляемых протонов, рассчитать константу равновесия реакции, константы нестойкости и устойчивости образующихся соединений, заряд комплекса и сделать вывод о структуре координационного узла.
Образование комплекса наблюдается в слабокислых средах. Согласно литературным данным о состоянии празеодима [7] и реагента (рКдисс) [2] при рН 4–5 наиболее вероятно, что комплексообразователь находится в форме негидролизованного трёхзарядного катиона, а краситель – в виде трёхзарядного отрицательного аниона, то есть уже диссоциирован по трём кислотным группировкам, не входящим в π-электронную систему красителя. Тогда уравнение реакции празеодима с фталексоном SA можно записать в виде упрощенной схемы:
Н6R3- + Pr3+ - PrH6-nRх + nH+.
Откуда
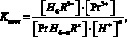
где [H6R3–] – равновесная концентрация лиганда;
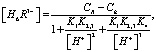
[Pr3+] – равновесная концентрация ионов неодима;
[Pr3+] = CNd – Ck,
[PrH6–nRx] – равновесная концентрация комплексных частиц;
CPr – общая концентрация ионов металла; Ck – равновесная концентрация комплекса.
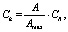
где А – оптическая плотность, CR – общая концентрация реагента.
Обозначим через В отношение произведения равновесных концентраций неодима и реагента к равновесной концентрации комплекса:
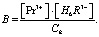
Тогда [B] = f[H+], а –lgB должен быть линейной функцией рН. Таким образом, в случае правильности выбранной схемы комплексообразования в данном интервале рН графическая зависимость –lgB–рН должна быть линейной, а значение тангенса угла наклона этой прямой к оси абсцисс должно быть целочисленным. Данные и результаты расчета, проведенного по выше представленным формулам (табл. 3, рис. 5), подтвердили предполагаемую схему образования комплекса (зависимость –lgB-pH линейная, тангенс угла наклона к оси абсцисс имеет целочисленное значение); число отщепляемых протонов (tgφ = n) равно 2. Значение рКнест комплекса вычисляли по уравнению
ρKнест. = – lgB – n•ρH + ρK + ρK2,3 + ρK4.
Kнест. = –antlgρKнест..
Уточненное уравнение реакции взаимодействия Pr c ФТSA при рН 5
Pr3+ + H6R3- - PrH4R2- + 2H+.
n = 2; рКнест. ср = 10,09; βср = 1,73·1010.
Таблица 3
Влияние Н+ на комплексообразование ионов празеодима (III) c фталексоном SA
|
рH |
A |
[H+]·105 |
Ck·105 |
[H6R3-]·1010 |
[Pr3+]·105 |
B·1010 |
–lgB |
pKнест |
|
4,25 |
0,253 |
5,19 |
1,25 |
2,16 |
1,25 |
3,6 |
9,44 |
9,3 |
|
4,5 |
0,304 |
3,19 |
1,5 |
0,454 |
1 |
1 |
10,04 |
10 |
|
4,75 |
0,354 |
1,95 |
1,75 |
0,067 |
0,75 |
0,934 |
10,7 |
10,03 |
|
5,0 |
0,398 |
0,757 |
1,97 |
0,0063 |
0,53 |
0,348 |
11,95 |
10,46 |
|
5,25 |
0,402 |
0,538 |
1,99 |
0,00081 |
0,51 |
0,245 |
12,4 |
10,62 |
Учитывая спектрофотометрические характеристики комплекса и результаты расчета, связанные с установлением химизма его образования, можно предположить, что координационный узел в процессе взаимодействия празеодима с ФТSA образуется по кислороду хиноидного кольца реагента и третичному азоту иминодиацетатной группировки. Согласно работе А.И. Черкесова и В.Н. Рыжова [11], такая структура комплексов фталексонов с ионами многовалентных металлов обуславливают их высокую прочность, что согласуется с результатом расчета β = 1,73·1010. Схему комплексообразования в исследуемой системе можно представить в виде
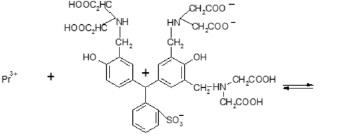
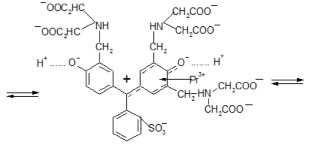
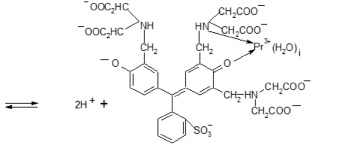
Схема комплексообразования
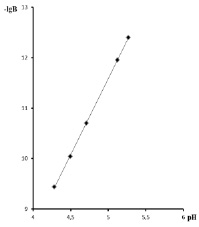
Рис. 5. Влияние Н+ на комплексообразование ионов празеодима (III) c фталексоном SA
С целью исследования возможности применения красителя и изученной системы в качестве реагента на аминокапроновую кислоту получены спектры светопоглощения ФТSA и системы ФТSA – аминокапроновая кислота (Amin) в достаточно широком диапазоне кислотности среды. Анализ их показал, что аминокапроновая кислота не влияет на спектральные характеристики ФТSA. Однако происходит повышение оптической плотности раствора (ΔА = 0,1 – 0,15), что говорит об увеличении концентрации соответствующей формы реагента в растворе в присутствии фармацевтического препарата.
Абсорбционные кривые системы ФТSA-Amin и тройной системы ФТSA-Pr-Amin при рН 4 приведены на рис. 6. Анализ их показывает, что введение аминокапроновой кислоты в систему R-Pr в слабокислых средах смещает полосу поглощения в длинноволновую область видимой части спектра (Δλ = 70 нм). В наибольшей степени это выражено при рН 4. На основании этого можно рекомендовать систему ФТSA-Pr в качестве реагента при идентификации аминокапроновой кислоты. Основные спектрофотометрические характеристики тройной системы приведены в табл. 4.
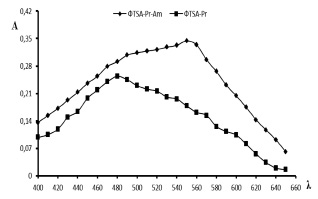
Рис. 6. Абсорбционные кривые системы ФТSA-Pr и тройной системы ФТSA-Pr-Amin при рН 4
Таблица 4
Основные спектрофотометрические характеристики системы ФТSA – Pr – Amin
|
рН |
λФTSA-Pr |
λ ФТSA–Pr–Amin |
Δλ |
|
3 |
460 |
460 |
0 |
|
4 |
480 |
550 |
70 |
|
5 |
550 |
550 |
0 |
|
6 |
560 |
560 |
0 |
Наблюдаемую цветную реакцию можно объяснить следующим образом. В присутствии аминокапроновой кислоты комплексообразование происходит уже при рН 4, причем полоса поглощения комплекса совпадает с полосой поглощения соединения образующегося в отсутствии лекарственного препарата (λ = 550 нм). По-видимому, это связано с увеличением поляризационной активности комплексообразователя в присутствии аминокапроновой кислоты, которая, будучи активным соединением, влияет на состояние водной фазы и обуславливает, таким образом, наблюдаемое явление (комплекс возникает не при рН 5, а при рН 4). Возможно также, что возникает разнолигандный комплекс празеодима (III) с ФТSA и аминокапроновой кислотой (рис. 7).
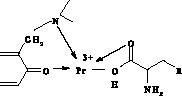
а) б)
Рис. 7. Предполагаемая схема разнолигандного комплекса, где R – С3Н7: а) образование комплекса по кислороду гидроксильной группы, б) образование комплекса по кислороду карбонильной группы
Для исследования возможности количественного спектрофотометрического определения аминокапроновой кислоты по реакции с фталексоном SA в присутствии ионов Pr необходимо было изучить характер зависимости оптической плотности от концентрации фармацевтического препарата в тройной системе.
С этой целью при рН 4 получена серия растворов с постоянной концентрацией металла и реагента и переменной аминокапроновой кислоты, в интервале концентраций от 0,0125 г/мл до 0,1 г/мл. Корреляция точек относительно прямой зависимости A-CAmin оказалась удовлетворительной (рис. 8).
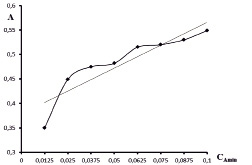
Рис. 8. Зависимость оптической плотности от концентрации аминокапроновой кислоты (г/мл)
Учитывая достаточную корреляцию точек относительно прямой в интервале концентрации аминокапроновой кислоты от 0,025 г/мл до 0,1 г/мл можно применить эту кривую в качестве градуировочного графика при количественном определении аминокапроновой кислоты в водных растворах. Уравнение градуировочного графика рассчитывали по методу наименьших квадратов [1], с учетом дисперсии параметров a и b оно имеет вид
Yi = (0,423 ± 1,323•10–8) + (1,27 ± 2,92•10–6)•xi.
С применением уравнения калибровочного графика было проведено определение аминокапроновой кислоты в водных растворах (табл. 5).
Таблица 5
Определение аминокапроновой кислоты в водных растворах по реакции с ФТSA в присутствии ионов празеодима при рН 4
|
Введено Аmin, мл |
САmin, г/мл |
Найдено, г/мл |
Абсолютная погрешность |
Относительная погрешность, % |
|
0,5 |
0,025 |
0,0255 |
– 0,0005 |
– 2,0 |
|
0,5 |
0,025 |
0,0247 |
0,0003 |
1,2 |
|
0,5 |
0,025 |
0,0245 |
0,0005 |
2,0 |
|
0,75 |
0,0375 |
0,0374 |
0,0004 |
1,1 |
|
0,75 |
0,0375 |
0,037 |
– 0,0005 |
– 1,4 |
|
0,75 |
0,0375 |
0,0376 |
0,0006 |
1,6 |
|
1,0 |
0,05 |
0,0494 |
– 0,0006 |
– 1,2 |
|
1,0 |
0,05 |
0,0495 |
– 0,0005 |
– 1,0 |
|
1,0 |
0,05 |
0,0507 |
0,0007 |
1,4 |
|
1,25 |
0,0625 |
0,0633 |
0,0008 |
1,3 |
|
1,25 |
0,0625 |
0,0635 |
0,001 |
1,6 |
|
1,25 |
0,0625 |
0,0618 |
– 0,0007 |
– 1,1 |
|
1,5 |
0,075 |
0,074 |
– 0,001 |
– 1,4 |
|
1,5 |
0,075 |
0,0738 |
– 0,0012 |
– 1,6 |
|
1,5 |
0,075 |
0,0735 |
– 0,0015 |
– 2,0 |
|
1,75 |
0,0875 |
0,0883 |
0,0008 |
1,0 |
|
1,75 |
0,0875 |
0,0886 |
0,0011 |
1,2 |
|
1,75 |
0,0875 |
0,089 |
0,0015 |
1,7 |
|
2,0 |
0,1 |
0,0991 |
– 0,0009 |
– 1,0 |
|
2,0 |
0,1 |
0,1016 |
0,0016 |
1,6 |
|
2,0 |
0,1 |
0,102 |
0,002 |
2,0 |
Заключение
Как показывает таблица, ошибка определения лежит в пределах допустимой, что позволяет рекомендовать систему ФТSA-Pr в качестве реагента при количественном спектрофотометрическом определении фармацевтического препарата аминокапроновой кислоты в водных растворах в слабокислых средах (рН 4).



