Зерно является древнейшим продуктом питания человека и кормом для сельскохозяйственных животных. Зерновой ворох, поступающий от комбайнов на зерноочистительные пункты, кроме полноценного зерна содержит различные сорные примеси. Одной из этих примесей являются склероции спорыньи, которые содержат ядовитые вещества, вызывающие различные заболевания у людей, животных и птиц [2].
Основные физико-механические свойства (скорость витания, толщина, ширина и длина) зерна основных зерновых культур (пшеницы, ячменя, ржи и овса) и склероций спорыньи схожи. Использование воздушно-решетно-триерных машин, пневмосортировальных столов, фотосепараторов и других устройств не дает положительных результатов при очистке зернового материала от данных примесей из-за близости их свойств со свойствами очищаемой культуры [4–9, 11].
Однако зерна основных зерновых культур (пшеницы, ячменя, ржи и овса) имеют удельную массу 1200…1500 кг/м3, а склероции спорыньи – 900…1150 кг/м3. Поэтому очистка семян от склероций спорыньи, отличающихся плотностью от зерна, возможна в растворе соли [3, 10].
Для очистки зернового материала по удельному весу мокрым способом с надлежащей эффективностью выделения склероций спорыньи требуется приготовление солевого раствора необходимой плотности.
Цель исследования – определение возможности применения водных растворов неорганических солей для выделения склероций спорыньи из зернового материала.
Материал и методы исследования
С целью выделения склероций спорыньи из озимой ржи мокрым способом были рассмотрены водные растворы хлористого натрия (NaCl), хлористого кальция (CaCl2), хлористого калия (КCl) и сернокислого калия (К2SO4). Данные неорганические соли для анализа водных растворов были выбраны исходя из хорошей растворимости в воде, доступности их приобретения вследствие массового производства, а также отсутствия токсического влияния на семенную и пищевую ценность зерна. Общий вид хлористого натрия (NaCl), хлористого кальция (CaCl2), хлористого калия (КCl) и сернокислого калия (К2SO4) в россыпи приведен на рис. 1 [1].


а б


в г
Рис. 1. Общий вид хлористого натрия (а), хлористого кальция (б), хлористого калия (в) и сернокислого калия (г) в россыпи
Хлористый натрий, или хлорид натрия (NaCl), представляет собой белые кристаллы соленого вкуса, но с различными примесями, его цвет может принимать голубой, фиолетовый, розовый, желтый или серый оттенок. Хлорид натрия в значительном количестве содержится в морской воде, создавая ее соленый вкус. В пищевой промышленности и в кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль и по составу добавок – йодированная или фторированная. Хлорид натрия имеет слабые антисептические свойства – 10…15 % содержание соли предотвращает размножение гнилостных бактерий. В медицине водный раствор хлорида натрия (0,9 %) применяется как средство для выведения токсических веществ, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов, для обработки местно гнойных ран. В промышленности из хлорида натрия получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. В коммунальном хозяйстве хлорид натрия, смешанный с другими солями и разведенный с песком или глиной, применяется как антифриз против гололеда. Им посыпают дороги, хотя это отрицательно влияет на лакокрасочное покрытие транспортных средств и на кожаную обувь людей.
Хлористый кальций, или хлорид кальция, (CaCl2) – кальциевая соль соляной кислоты. Зарегистрирован в качестве пищевой добавки E509, имеет вид бесцветных кристаллов либо несколько белесоватого цвета. Его химико-физические свойства характеризуются хорошей растворимостью в воде и этиловом спирте. Применение хлористого кальция в России является регламентированным. В странах Европейского союза данную добавку также признали безопасной и официально допустили ее к использованию при изготовлении лекарственных препаратов и некоторых продуктов. Список продуктов, в состав которых включают хлорид кальция, довольно велик, но наиболее часто его добавляют в молочные и кисломолочные продукты, такие как творог, сыры, сливки, как сухие, так и питьевые, а также пастеризованное молоко. Хлористый кальций довольно интенсивно применяют не только в пищевой индустрии, но также и в сфере фармацевтики. Его включают в состав медикаментов, действие которых направлено на предотвращение кровотечений и противоаллергические препараты. Полезные свойства хлористого кальция важны для поддержания некоторых функций в организме человека: оказывает положительное воздействие на работу миокарда, помогает в формировании костной ткани, нормализует свертывание крови, предотвращает развитие воспалительных заболеваний, обладает способностью повышать стойкость организма от различного рода инфекциям. Однако, несмотря на большое количество положительных качеств, хлористый кальций способен принести пользу только в случае грамотного его употребления. Суточная доза этого вещества не должна быть более 350 мг.
Хлористый калий, или хлорид калия (КCl), является наиболее распространенным калийным удобрением. По виду это маленькие кристаллы белого с серым оттенком или розового цвета без запаха, они имеют большую гигроскопичность. Хлорид калия разрешено применять в качестве пищевой добавки (E508) в большинстве стран мира, в том числе в Российской Федерации и Евросоюзе, он не имеет запаха, обладает горько-соленым вкусом, растворим в воде и не растворим в этаноле. Согласно официальным данным, пищевая добавка E508 является нетоксичной и не представляет угрозы для здоровья человека. Допустимое суточное употребление не ограничено. Хлорид калия быстро усваивается в организме. В пищевой промышленности Е 508 используется для изготовления пастеризованных и стерилизованных сливок, молочных консервов – сгущенного и сухого молока и сливок, соли с пониженным содержанием натрия для диетического питания, овощных консервов, колбасных изделий и сыров в качестве стабилизатора, кондитерских изделий в качестве загустителя и желирующего агента. В медицинской практике раствор хлорида калия в виде инъекций применяется для восполнения недостатка калия, при нарушении сердечного ритма. Противопоказан при заболеваниях почек.
Сернокислый калий, или сульфат калия (К2SO4), представляет собой мелкие кристаллы белого цвета с желтоватым оттенком. В Европейском союзе допущен в качестве использования как пищевая добавка E515. Сульфат калия Е515 имеет вид белых или бесцветных кристаллов, а также кристаллического порошка, наделенного специфическим горько-соленым вкусом. Добавка хорошо растворяется в воде и практически нерастворима в этаноле и щелочных концентрированных растворах. Сульфат калия содержится в целом ряде продуктов. Его находят в свекле, масле из пророщенных зерен пшеницы, морской капусте, миндале, сыре, шпинате, нежирной говядине, апельсинах, лимонах, бананах и свежих овощах, которые обычно покрывают зеленые листья. В пищевой индустрии добавка Е515 чаще всего применяется как заменитель соли. Кроме того, сульфат калия выступает как регулятор кислотности в напитках, питательная среда в процессе приготовления дрожжей жидкой консистенции, а также ржаных заквасок, тоже как источник питания минералами. Сульфат калия необходим организму как поставщик кислорода клеткам. Он в ответе за энергетический баланс человека. При недостаточном содержании Е515 можно наблюдать потерю волос, сухость кожи, появление перхоти, утомляемость. Тем не менее обращаться с веществом нужно осторожно. Попадание в глаза сульфата калия приводит к механическому раздражению и воспалению. Попадание на кожные покровы Е515 становится причиной раздражения. Если употребить чрезмерное количество добавки в пищу, то высока вероятность расстройства желудка и раздражения всего пищеварительного тракта. Изредка постоянное употребление пищевой добавки заканчивается отравлением организма. Вдыхание вещества грозит раздражением и воспалением дыхательных путей. В сельском хозяйстве сульфат калия используется в качестве ценного удобрения для дерново-подзолистых почв, бедных калием и другими минеральными веществами. По сравнению с другими это более дорогое удобрение. Добавка Е 515 фигурирует в производстве стекла, красителей. В аналитической химии вещество применяется в процессе перевода труднорастворимых химических соединений в легкорастворимые.
Плотность ρ водных растворов рассматриваемых неорганических солей и их процентных концентраций ωc при температуре раствора 20 °С получена в виде массива дискретных значений согласно электронной справочной таблице [12, 13], в котором промежуточные значения рассчитаны с помощью стандартного метода интерполяции по двум крайним значениям. Обработка массива полученных дискретных значений зависимости плотности р водных растворов рассматриваемых неорганических солей от их процентных концентраций ωc осуществлена с помощью персонального компьютера применением стандартной программы по статистической обработке данных Microsoft Excel 2013.
|
|
|
|
а |
б |
|
|
|
|
в |
г |
Результаты исследования и их обсуждение
В результате обработки массива дискретных значений зависимости плотности ρ водных растворов хлористого натрия (NaCl), хлористого кальция (CaCl2), хлористого калия (КCl) и сернокислого калия (К2SO4) от массовой доли ωc растворенной соли получены регрессионные модели:
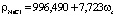 , r = 0,999; (1)
, r = 0,999; (1)
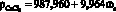 , r = 0,997; (2)
, r = 0,997; (2)
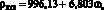 , r = 0,999; (3)
, r = 0,999; (3)
 , r = 0,999. (4)
, r = 0,999. (4)
Данные регрессионные модели описываются линейными уравнениями. Коэффициенты r корреляции данных уравнений близки к 1,0, что свидетельствует о высоком приближении теоретических моделей табличным данным.
Полученные зависимости (1), (2), (3) и (4) представлены на рис. 2 с использованием редактора векторной графики CorelDraw 12.
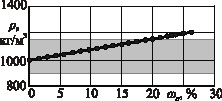
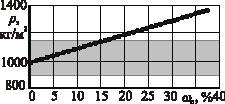
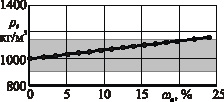
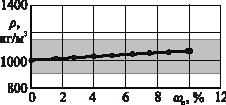
Рис. 2. Зависимость плотности р раствора от массовой доли DANCING ωc растворенной соли: а – раствор хлористого натрия (NaCl); б – раствор хлористого кальция (CaCl2); в – раствор хлористого калия (КCl); г – раствор сернокислого калия (К2SO4);  – пределы варьирования удельной массы склероций спорыньи
– пределы варьирования удельной массы склероций спорыньи
Из рисунка следует, что максимальная плотность ρ раствора хлористого натрия (NaCl) составляет 1203 кг/м3 при концентрации ωc растворенной соли 26,3 %, хлористого кальция (CaCl2) – 1370 кг/м3 при ωc = 37,3 %, хлористого калия (КCl) – 1162 кг/м3 при ωc = 24,0 %, сернокислого калия (К2SO4) – 1081 кг/м3 при ωc = 10,0 %. Причем при одинаковой плотности р содержание соли в водных растворах сернокислого калия (К2SO4) и хлористого кальция (CaCl2) меньше, чем в водных растворах хлористого натрия (NaCl) и хлористого калия (КCl). Так, при плотности р водного раствора 1080 кг/м3 содержание соли в растворах сернокислого калия (К2SO4) и хлористого кальция (CaCl2) составляет 10,0 и 9,4 % соответственно, в растворах хлористого натрия (NaCl) и хлористого калия (КCl) 11,0 и 12,5 % соответственно.
Из этих показателей следует, что в водных растворах хлористого кальция (CaCl2), хлористого натрия (NaCl) и хлористого калия (КCl) все склероции спорыньи, характеризующиеся удельной массой 900…1150 кг/м3, будут всплывать на поверхность, а зерна основных зерновых культур (пшеницы, ячменя, ржи и овса), характеризующиеся удельной массой 1200…1500 кг/м3, – тонуть и выпадать на дно емкости. Водный раствор сернокислого калия (К2SO4), имеющий максимальную плотность 1081 кг/м3, не способен выделять склероции спорыньи с удельной массой выше плотности раствора, а потому применение этого раствора ограничено.
Выводы
Показатели растворимости в воде хлористого калия (КCl), хлористого натрия (NaCl) и хлористого кальция (CaCl2) позволяют довести плотность раствора до 1162, 1203 и 1370 кг/м3 соответственно, что выше максимальной удельной массы склероций спорыньи, равной 1150 кг/м3. Водные растворы данных неорганических солей позволяют всплытием на поверхность отделять склероции спорыньи от зерна основных зерновых культур (пшеницы, ячменя, ржи и овса), которое будет тонуть и выпадать на дно емкости из-за большей удельной массы, равной 1200…1500 кг/м3. Растворимость сернокислого калия (К2SO4) в воде по сравнению с хлористым калием (КCl), хлористым натрием (NaCl) и хлористым кальцием (CaCl2) ниже, наибольшая плотность его водного раствора ниже максимальной удельной массы склероций спорыньи, что ограничивает возможность использования водного раствора сернокислого калия (К2SO4) для выделения склероций спорыньи.