Биополимеры полисахаридной структуры – важнейший класс природных соединений, находящих практическое использование в различных областях науки и техники [10].
Сегодня микробные полисахариды находят широкое применение в самых различных сферах человеческой деятельности, от медицины до металлургии. Наиболее известным является ксантан – внеклеточный полисахарид бактерии Xanthomonas Campestris. Ксантан используют как добавку, улучшающую качество самых различных продуктов и технологических операций. Чаще всего его применяют для повышения нефтедобычи, при буровых работах, для повышения урожайности, а также в пищевой, фармацевтической и косметической промышленности [5].
Известно, что ксантан состоит из двух D-глюкопиранозильных звеньев, двух D-маннопиранозильных звеньев и звена D-глюкопиранозилуроновой кислоты [9], степень ветвления и ацетилирования полисахарида зависит от штамма продуцента, благодаря чему биополимер приобретает различные характеристики и свойства. В чистом виде ксантан представляет собой мягкий пушистый порошок белого или кремового цвета. Неорганические элементы составляют около 5,5 % [7]. Процентный состав нейтральных и кислых сахаров зависит от способа выделения ксантана [12], поэтому для его использования в пищевой, медицинской и косметической промышленности важно контролировать количество нейтральных и кислых сахаров.
Для определения кислых сахаров в образце ксантана используют карбазол-серный метод, основанный на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул полисахаридов концентрированной серной кислотой. Данный метод обладает рядом недостатков, таких как длительность подготовки эксперимента, использование вредных и концентрированных кислот и щелочей [6].
Существующие методы анализа, такие как фенол-серный, карбазол-серный методы и др., не всегда обладают хорошей воспроизводимостью результатов, трудоемки, дорогостоящи и часто малопригодны для использования в надлежащей лабораторной практике [2, 11, 8]. На сегодняшний день отсутствуют комплексные подходы по исследованию ксантана инструментальными методами анализа для его использования в медицинской, пищевой и технической сферах. В этой связи востребованными являются комплексные экспериментальные исследования, обладающие удовлетворительными валидационными параметрами.
Цель работы – исследование химического состава ксантана инструментальными методами анализа, а именно определение нейтральных и кислых сахаров.
Материалы и методы исследования
В качестве модельного объекта исследования использовался коммерческий образец пищевого ксантана («Company Plasma Product Specification», Китай).
Измерения оптической плотности проводили на УФ-спектрофотометре Cary 60 (Agilent Technologies, Германия) в кварцевых кюветах 10 мм.
Регистрацию ИК-спектров проводили на ИК-спектрометре Agilent 660 FTIR (Agilent Technologies, Германия).
Определение нейтральных сахаров в пересчете на глюкозу в ксантане
При определении нейтральных сахаров в пересчете на глюкозу в образце ксантана использовали фенол-серный метод, основанный на реакции взаимодействия оксиметилфурфурола с фенолом в концентрированной серной кислоте [4]. Сначала под воздействием концентрированной серной кислоты глюкоза дегидратируется в течение 45 минут до образования оксиметилфурфурола. А далее при действии фенола на оксиметилфурфурол образуется ауриновый краситель, имеющий спектр поглощения в видимой области. Для определения нейтральных сахаров готовили растворы с концентрациями 20 мг/см3, 50 мг/см3, 80 мг/см3, 100 мг/см3. Затем к полученным растворам добавляли по 5 см3 воды и проводили измерение оптической плотности при 483±2 нм [16].
Определение кислых сахаров в пересчете на глюкуроновую кислоту в ксантане
При определении кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана использовали карбазол-серный метод, основанный на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул концентрированной серной кислотой [15]. Для определения кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана готовили раствор с концентрацией 100 мг/см3. Измерение оптической плотности проводили при 525 ± 2 нм [16].
Результаты исследования и их обсуждение
Определение структуры ксантана
Для установления структуры ксантана и его идентификации использовали метод ИК-спектроскопии.
В качестве стандартного вещества был использован ксантан («Sigma-Aldrich», США) с высокой стабилизирующей активностью, высокой растворимостью, высокой вязкостью даже при маленьких концентрациях.
На рис. 1 представлены ИК-спектры стандартного вещества ксантана и исследуемого образца ксантана.
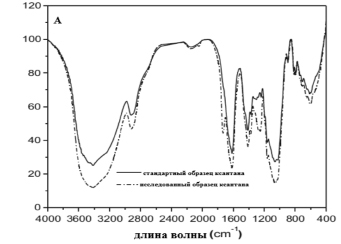
Рис. 1. ИК-спектры стандартного и исследуемого образцов ксантана
При сравнении стандартного образца ксантана и исследуемого образца ксантана очевидно, что некоторые полосы поглощения образца коммерческого ксантана и стандартного образца ксантана совпадают, что указывает на идентичность стандартного образца ксантана исследуемому.
Так, на ИК-спектре имеется область отпечатков пальцев при 1200–850 см-1, которая соответствует области «отпечатков пальцев» пектиновых веществ как для стандартного образца ксантана, так и для исследуемого образца.
Кроме того, ИК-спектр исследуемого образца ксантана показывает наличие свободных, а также неэтерифицированных карбоксильных групп.
Кроме того, имеются полосы поглощения 1416, 1331 и 1240 см-1, которые являются областью «отпечатков пальцев» глюкуроновой кислоты, которые характерны как для стандартного образца ксантана, так и для исследуемого образца. Использованный метод ИК-спектроскопии позволяет судить о том, что ксантан является кислым сахаром, содержащим глюкуроновую кислоту.
Определение глюкозы и глюкуроновой кислоты является обязательным этапом контроля образца ксантана, для установления его состава, также по количеству процентного содержания глюкозы в образце ксантана, говорит о том, что при его получении источником углеродного питания являлись глюкоза и глюкуроновая кислота [3, 13].
Определение нейтральных сахаров
Определение нейтральных сахаров в образцах ксантана проводили при помощи фенол-серного метода. В основу количественного определения нейтральных сахаров в пересчете на глюкозу в исследуемом образце положена реакция взаимодействия оксиметилфурфурола с фенолом в среде серной концентрированной кислоты. Сначала под воздействием концентрированной серной кислоты глюкоза дегидратируется в течение 45 минут до образования оксиметилфурфурола. А далее при действии фенола на оксиметилфурфурол образуется ауриновый краситель, имеющий в видимой области спектра максимум поглощения λmax 483–485 нм [16].
Для точного определения процентного содержания нейтральных сахаров в пересчете на глюкозу в образце ксантана использовали только свежеприготовленные растворы глюкозы, а также раствор 5 % фенола, т.к. раствор фенола достаточно быстро окисляется на свету. Использовали метод сравнения со стандартным раствором глюкозы.
На рис. 2 представлена зависимость величины оптической плотности оксиметилфурфурола от времени его формирования.
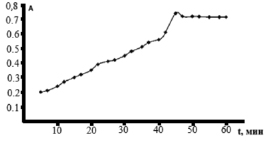
Рис. 2. Зависимость величины оптической плотности оксиметилфурфурола от времени его формирования
Замечено, что оксиметилфурфурол формируется в концентрированной серной кислоте в течение 45 мин (рис. 2), тогда как образование ауринового красителя при действии фенола происходит сразу при внесении фенола в реакционную среду. Формирование оксиметилфурфурола завершается к 45 мин и сохраняется величиной постоянной.
На рис. 3 представлен спектр поглощения в видимой области ауринового красителя, с концентрацией стандартного раствора глюкозы 25 мг/см3. Полоса поглощения ауринового красителя соответствует 489 нм.
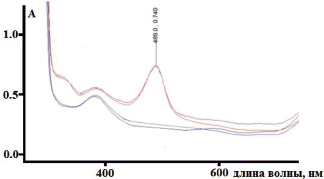
Рис. 3. Cпектр поглощения в видимой области ауринового красителя с концентрацией глюкозы 0 мг/см3 (1), 25 мг/см3 (2)
На рис. 4 представлен градуировочный график зависимости оптической плотности раствора глюкозы от ее концентрации при 489 нм. Прямолинейная зависимость наблюдалась в области концентраций глюкозы от 0,1 до 1,0 мг/см3.
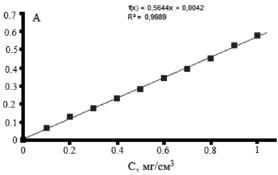
Рис. 4. Зависимости оптической плотности раствора глюкозы от ее концентрации в растворе
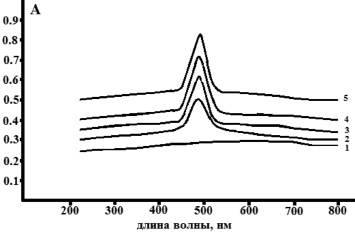
Рис. 5. Спектр поглощения в видимой области исследуемых растворов ксантана разных концентраций: 0 мг/см3 (1), 20 мг/см3 (2), 50 мг/см3 (3), 80 мг/см3 (4), 100 мг/см3 (5)
На рис. 5 представлен спектр поглощения в видимой области исследуемых образцов ксантана, разных концентраций.
Содержание нейтральных сахаров в пересчете на глюкозу в образце ксантана составило 52,0 ± 3 %. Известно, что содержание нейтральных сахаров в пересчете на глюкозу в образцах ксантана может варьироваться от 35 до 80 %.
Таким образом, рабочими условиями для количественного определения нейтральных сахаров в пересчете на глюкозу в образце ксантана являются:
– время выдерживания в концентрированной серной кислоте 45 мин;
– максимум поглощения ауринового красителя при 485 нм;
– свежеприготовленные 5 % раствор фенола и раствор глюкозы в день эксперимента.
Определение глюкуроновой кислоты
Для увеличения селективности определения глюкуроновой кислоты в образце ксантана и уменьшения влияния нейтральных сахаров на результаты определения глюкуроновой кислоты карбазол-серным методом разрушение полимерной молекулы проводили концентрированной серной кислотой в присутствии сульфаминовой кислоты, которая препятствует реакции карбазола с альдозами, образовавшимися при гидролизе полисахаридов.
На рис. 6 представлена зависимость оптической плотности комплекса карбазола с кислыми сахарами при λ = 525 нм от концентрации глюкуроновой кислоты в стандартных растворах. Прямолинейная зависимость наблюдалась в области концентраций глюкуроновой кислоты от 0,03 до 0,5 мг/см3. Общее содержание глюкуроновой кислоты в исследуемом образце ксантана определяли по методу градуировочного графика. Содержание глюкуроновой кислоты в исследуемом образце ксантана в пересчете на % составило 24,79 ± 1,24 %. Известно, что содержание глюкуроновой кислоты в образце ксантана составляет от 5 до 40 %.
Следует отметить, что данная методика трудоемка, длительна, требует использования вредных концентрированных кислот и щелочей и занимает 6 ч. Кроме того, результаты плохо воспроизводятся.
В связи с этим в качестве альтернативы определения кислых сахаров в ксантане предложен метод потенциометрического титрования раствором 0,1 Н KOH [16].
Потенциометрическое титрование образца ксантана проводили в водном растворе. Методика заключалась в следующем: навеску ксантана 0,0100 г растворяли в 10 мл воды в стакане для титрования емкостью 50 мл. Для непрерывного перемешивания использовали магнитную мешалку. Электрохимическая ячейка состояла из стеклянного и хлоридсеребряного электродов. В качестве титранта использовали 0,1 Н раствор щелочи KOH. Измерение рН производили через каждые 0,2 мл добавки титранта. Точку эквивалентности определяли по методу Грана [1, 14].
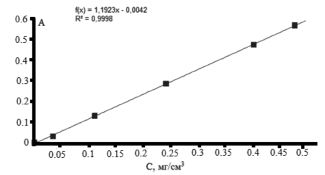
Рис. 6. Зависимость оптической плотности комплекса карбазола с кислыми сахарами при λ = 525 нм от концентрации глюкуроновой кислоты в стандартных растворах
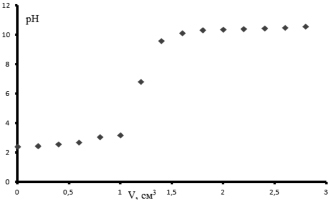
Рис. 7. Кривая потенциометрического титрования образца ксантана
На рис. 7 представлена кривая потенциометрического титрования образца ксантана.
При использовании потенциометрической индикации конечной точки титрования возникают трудности, связанные с отсутствием четко выраженных перегибов на кривых титрования функциональных групп кислотного характера, что требует последующей математической обработки результатов, такой как построение кривых Грана [14, 15]. Все кривые потенциометрического титрования образца ксантана обработаны по методу Грана.
На рис. 8 представлен пример определения конечной точки титрования по методу Грана образца ксантана (зависимость величины G от объема титранта):
G = (W + V)·10-Е – для кислой среды;
G = (W + V)·10(E-14) – для щелочной среды,
где V – объем титранта, мл; E – значения потенциала, В; W – начальный объем пробы, мл.
На основании рис. 8 конечная точка титрования равна объему 1,2 мл, что соответствует количеству глюкуроновой кислоты 23,13 ± 1,6 мг/см3.
Сравнительное содержание глюкуроновой кислоты в образце ксантана, полученное потенциометрическим титрованием и карбазол-серным методом, представлено в таблице.
Сравнительное содержание глюкуроновой кислоты в образце ксантана методом потенциометрического титрования и карбазол-серным методом
|
Название |
Потенциометрическое титрование, мг/см3 |
Карбазол-серный метод, мг/см3 |
|
Ксантан |
23,12 ± 1,16 |
24,79 ± 1,24 |
Согласно таблице количество глюкуроновой кислоты, определенное двумя методами, согласуется между собой, однако результаты определения глюкуроновой кислоты карбазол-серным методом имеют завышенные значения, что связано с мешающим влиянием нейтральных сахаров на результаты определения глюкуроновой кислоты. Метод потенциометрического титрования может быть использован для определения количества свободных неэтерифицированных карбоксильных групп, т.к. достаточно прост в исполнении, нет необходимости в использовании дополнительных реактивов.
Заключение
Методом ИК-спектроскопии проведена идентификация структуры образца ксантана. Выявлено, что ксантан содержит кислые сахара. Подобраны рабочие условия определения нейтральных сахаров в пересчете на глюкозу в образце ксантана фенол-серным методом. Количество нейтральных сахаров в пересчете на глюкозу в исследуемом образце ксантана составило 52,0 ± 3 %. Проведено сравнительное определение кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана карбазол-серным методом и потенциометрическим титрованием. Количество кислых сахаров в пересчете на глюкуроновую кислоту в исследуемом образце ксантана составило 24,79 ± 1,24 мг/см3.



