Разработка актуальных технологий рационального природопользования является важным направлением развития хозяйственной деятельности человека. В растениеводстве эти технологии основываются на выявлении устойчивых взаимосвязей в системе «растение – природные и антропогенные факторы», которые позволяют разрабатывать методы прогнозирования и управления продуктивностью агроценозов. Виноградарство, как одна из наиболее ресурсозатратных отраслей сельского хозяйства, нуждается в новых технологиях рационального природопользования, основанных на использовании современных научных знаний и методов исследований. Одним из этапов онтогенеза виноградного растения, влияющих на реализацию продукционного потенциала, является закладка и дифференциация эмбриональных соцветий [10].
Наиболее заметное влияние на закладку эмбриональных соцветий и формирование урожая винограда оказывают температурные условия среды, в частности сумма активных температур за вегетационный период. Учитывая продолжительность периода и динамику формирования зачаточных соцветий при различных погодных факторах среды в пределах одного и того же года, часто наблюдается разнокачественность глазков по длине однолетнего вызревшего побега, что является важным биологически показателем, определяющим длину обрезки [1].
Различная степень закладки эмбриональных соцветий является одной из главных причин колебаний урожайности виноградных насаждений по годам. Направленным воздействием приемов агротехники можно в той или иной степени воздействовать на закладку и дифференциацию эмбриональных соцветий [5].
Таким образом, определение эмбриональной плодоносности зимующих глазков является важным инструментом регулирования продукционного потенциала виноградных насаждений.
В виноградарстве существует два способа определения эмбриональной плодоносности винограда – метод проращивания одноглазковых черенков в искусственных условиях [2] и вариации метода микроскопирования при 12–16 кратном увеличении и обособлении зачаточных соцветий [4]. Оба метода подразумевают деструктуризацию объекта исследований без возможности его дальнейшего использования, а также проверки результатов альтернативными методами.
В то же время, в международной практике для исследования внутренних структур растительных организмов используются различные методы интроскопических исследований, которые оставляют объект исследований в первозданном виде, не разрушая его. Из последних достижений следует отметить, что с 2011 г. в зарубежных литературных источниках встречаются работы по изучению внутренних структур виноградного растения с использованием реконструктивной томографии. В 2011 г. коллектив ученых из Калифорнии в исследованиях сосудистой системы ксилемы использовал рентгеновский томограф, применение которого позволило получить объемную модель сосудистой системы для автоматизированного количественного анализа проводящей системы ксилемы [13]. В 2012 г. удалось построить объемную модель места срастания подвойно-привойных компонентов саженца, что позволило изучить процесс дифференциации клеток проводящей системы в месте соприкосновения трансплантатов [15].
В целом же рентгенография для изучения внутренней структуры растений и семян древесных пород, как за рубежом, так и в нашей стране используется достаточно давно [14].
Так, работы ученых ФГБНУ «Агрофизический научно-исследовательский институт» и ГНУ «Всероссийский научно-исследовательский институт растениеводства» показали, что рентгенография является одним из наиболее перспективных методов регистрации скрытых дефектов у растительных организмов, позволяющим визуализировать все его внутренние формообразующие структуры, а следовательно, и их плотностные, объемные и линейные аномалии [6, 11]. В свою очередь, технология микрофокусной рентгенографии служит наиболее объективным, точным и быстрым способом регистрации скрытых дефектов [3, 7, 8].
Нами применялся принципиально новый подход в оценке эмбриональной плодоносности зимующих глазков винограда, основанный на использовании нового направления интроскопического метода исследований в виноградарстве – цифровой микрофокусной рентгенографии.
Материалы и методы исследования
Для нашего исследования использовалась специализированная установка, созданная в результате цикла работ по микрофокусной рентгенографии растений – рентгеновский микроскоп РМ-01.
Рентгеновский микроскоп РМ-01 позволяет получать снимки объектов исследований с увеличением до тысячи раз. С этой целью объект съемки размещается в специальном держателе, который в автоматическом режиме обеспечивает его перемещение в горизонтальной плоскости (по двум координатам), по вертикали, а также вращение вокруг оси. Визуализация рентгеновского изображения осуществляется с помощью приемника изображения, построенного по схеме «экран–оптика–ПЗС» [9]. Возможно также использование более чувствительного приемника на основе пластины с фотостимулируемым люминофором.
В разработке методики участвовали сорта винограда разного эколого-географического происхождения, произрастающие на Российской ампелографической коллекции генетических ресурсов винограда, содержащей 4911 единиц сохраняемого генофонда.
Подбор сортов осуществлялся таким образом, чтобы охватить сорта с разными коэффициентами плодоношения и плодоносности, а также с разной формой и величиной глазков.
Для получения наиболее информативных снимков черенки винограда располагают таким образом, чтобы узел с глазком и расположенным с противоположной стороны усиком размещался перпендикулярно потоку рентгеновского излучения для лучшего отображения глазка (рис. 1).
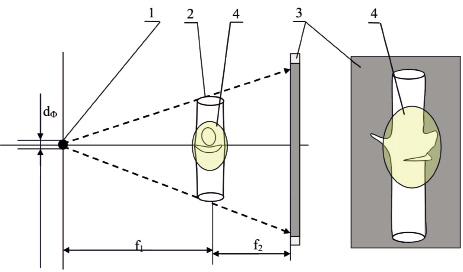
Рис. 1. Схема съемки черенка винограда: 1 – точечный источник излучения; 2 – черенок винограда; 3 – приемник изображения; 4 – глазок винограда
Для анализа глазков оказалось (с учетом параметров использовавшейся аппаратуры) достаточным прямое геометрическое увеличение изображения объектов на рентгеновских снимках в 3–5 раз.
Результаты исследования и их обсуждение
В процессе исследований для повышения информативности снимков значительное внимание было уделено оптимизации режимов съемки объектов исследования. Экспериментальные исследования показали, что получение резких и контрастных снимков обеспечивают следующие режимы работы аппаратуры: напряжение 22 кВ, ток трубки 100 мкА, экспозиция 2 с. Указанные параметры съемки позволяют с наибольшей точностью получить информацию о размере, форме и плотности составляющих объект деталей. Снимки анализируются визуально или автоматически с помощью программы распознавания и количественной оценки [12].
Полученные снимки позволяли определять наличие или отсутствие (рис. 2, 3) зачатков соцветий, которые представляли собой конусообразные или овальные уплотнения (рис. 4–6).
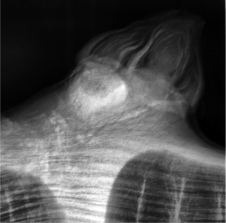
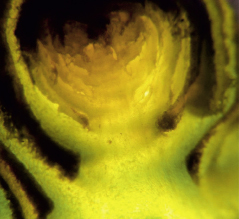
Рис. 2. Рентгеновский снимок и снимок через микроскоп виноградного глазка без зачатков соцветий

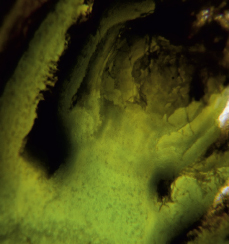
Рис. 3. Рентгеновский снимок и снимок через микроскоп виноградного глазка без зачатков соцветий
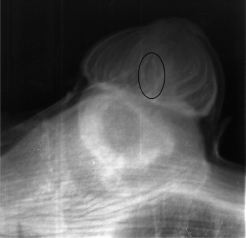
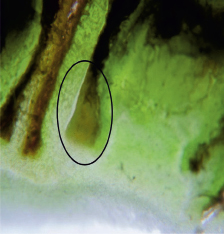
Рис. 4. Рентгеновский снимок и снимок через микроскоп виноградного глазка с зачатком соцветия (обведен)
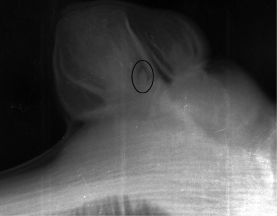
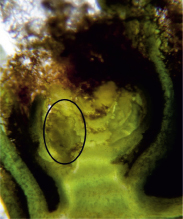
Рис. 5. Рентгеновский снимок и снимок через микроскоп виноградного глазка с зачатком соцветия (обведен)
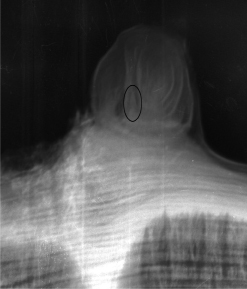
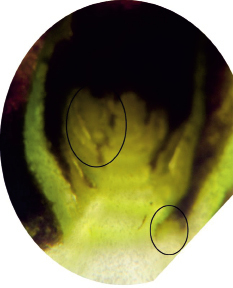
Рис. 6. Рентгеновский снимок и снимок через микроскоп виноградного глазка с зачатком соцветия (обведен)
Проведение определения эмбриональной плодоносности методом микрофокусной рентгенографии так же, как в традиционном варианте, подразумевает определение коэффициента плодоношения и плодоносности центральных почек зимующих глазков.
Также следует при определении эмбриональной плодоносности проводить учеты по сохранности глазков винограда.
Таким образом, предварительный анализ эмбриональной плодоносности позволяет прогнозировать длину обрезки и устанавливать нагрузку кустов, тем самым наиболее рационально использовать потенциал виноградного куста и получать стабильные урожаи винограда.
Выводы
Предложенная методика определения эмбриональной плодоносности позволяет не только упростить работу, но и снизить трудозатраты, а также уменьшить срок анализа за счет более оперативного получения результатов по сравнению с традиционными способами.
Экспериментальная проверка методики показала, что в большинстве случаев, для определения эмбриональной плодоносности, достаточно съемки с трехкратным или пятикратным увеличением изображения.
Предложенная методика, за счет таких преимуществ, как скорость и большая объективность, в перспективе может заменить собой традиционные методы оценки эмбриональной плодоносности.



