В южных районах Республики САХА на данный момент существуют месторождения с непростыми горно-геологическими характеристиками, в частности россыпи, залегающие на большой глубине и находящиеся в криолитозоне. Данные месторождения состоят из глинистых песков и в большом объеме содержат тонкодисперсное золото. Поэтому изучение разрушения мерзлых суглинков с целью полного извлечения полезного компонента становится одной из важнейших задач.
Кроме того, разработка теоретического фундамента усиления процесса дезинтеграции мерзлых глинистых песков на основе применения явления, объясняющего процесс денудации этих грунтов в водной среде, является актуальной. Ответ на эту проблему позволит улучшить гидравлический способ разработки мерзлых осадочных пород, увеличить извлечение полезного компонента при обогащении.
При нивации на денудацию многолетнемерзлых суглинках и супесях в водной среде нами учитывались результаты исследования по изменению естественного электрического поля, подтверждающие наличие с процессом теплоотдачи от воды мерзлой горной породе процессов водной фильтрации в поверхностный слой образца суглинка и эффекта электроосмоса.
Исходя из вышесказанного, предполагаем, что скорость денудации многолетнемерзлых суглинков при контакте с соляным раствором должна увеличиваться в сравнении с дистиллированной водой за счет процесса электроосмоса. Для этого нужно обеспечить соответствующий знак ионов в водном растворе. Движение жидкости внутрь образца суглинка в этом случае будет происходить за счет подвижности ионов под действием градиента электрического потенциала естественного электрического поля.
В нашем случае нарушение целостности образцов мерзлых суглинков и супесей в растворах солей происходит, в первую очередь, за счет действия двух механизмов: фильтрации и электроосмотического течения.
Фильтрация водного раствора солей в образец происходит за счет градиента давления на концах пор и трещин. Это происходит при совместном действии капиллярных сил, которые зависят от величины энергии поверхностного натяжения жидкости и радиуса пор, и вакуумного эффекта, связанного с фазовым уменьшением объема при таянии льда. Это усиливает подток раствора солей в образовавшиеся пустоты.
При замораживании суглинков и супесей между центральной областью образца и его поверхностью образуется разность потенциалов. В результате под действием естественного электрического поля возникает движение ионов солей, что объясняется присутствием электроосмотического течения.
В качестве воздействующего фактора для экспериментальных исследований нами были выбраны водные растворы солей хлорида натрия (NaCl) и хлорида цинка (ZnCl2). Полярность ионов данных солей возле поверхности минеральных частиц в двойном электрическом слое соответствует полярности естественного электрического поля в образце мерзлых суглинков и супесей. Кроме того, использование данных солей может позволить оценить влияние радиуса ионов на скорость процесса электроосмоса.
Электроосмотическое перемещение жидкости в грунтах определяется неравномерным распределением ионов в сечении пор. Силы, вызывающие движение воды, действуют только в рыхлосвязанном слое [6, 7]. Поэтому остальная объемная часть воды в порах движется как одно целое, потому что за пределами этого слоя сил нет. В образце источником движения будет служить поверхность частиц. В процессе фильтрации поверхность частиц, наоборот, препятствует скольжению жидкости и тормозит ее движение. Движение же свободной воды происходит по слою связанной воды [4].
К уменьшению толщины гидратных оболочек вокруг минеральных частиц как раз приводит применение вместо воды раствора электролита. При этом уменьшается и толщина слоя рыхлосвязанной воды в порах. В свою очередь будет увеличиваться коэффициент фильтрации, так как ионы электролита более эффективно нейтрализуют заряд поверхности минеральных частиц по сравнению с молекулами воды. В результате происходит увеличение эффективного сечения пор [2, 3, 5].
При экспериментальных исследованиях с применением водного раствора хлорида цинка сила разрушения образцов фактически оставалась постоянной при различных концентрациях соли.
Объясняется это тем, что ион Zn2+ имеет больший радиус, чем ионы H+ и Na+. В результате их замещения происходит увеличение толщины прочносвязанной части двойного электрического слоя и одновременно уменьшение толщины рыхлосвязанной части. Большая валентность иона Zn2+ по сравнению с ионом Na+ приводит к тому, что в случае раствора ZnCl2 рыхлосвязанный слой будет сохраняться даже при высокой концентрации соли.
Процесс разрушения мерзлых песчано-глинистых образцов в водном растворе ZnCl2, сопровождающийся изменением объема образца, также обусловлен строением и энергетикой кристаллической решетки. Во льду атомы водорода непрерывно перемещаются в пространстве между каждой парой атомов кислорода. Данное смещение происходит в результате вращения молекул и флуктуаций колебаний. Для совершения атомом водорода скачка из одного положения в другое ему необходимо преодолеть упругое силовое поле узла кристаллической решетки. Скачок атомов водорода и изменение молекул отражаются на поляризации локального участка. Разрушение мерзлой породы происходит интенсивнее на локальных участках и распространяется в направлении минимальных сил связей и максимальных напряжений. Водный раствор ZnCl2 не может увеличить разрыв всех этих связей и нарушить структуру образца в сравнении с поверхностными водами. При малых концентрациях ZnCl2 происходит замещение молекул воды ионами. Увеличение концентрации приводит к упорядоченности гидратов (рис. 1).
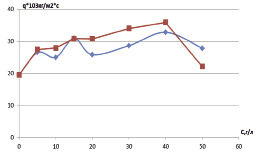
Рис. 1. Зависимость силы дезинтеграции мерзлых суглинков при различных концентрациях хлорида цинка в водном растворе
Обменные процессы в данном случае обусловлены переходом катионов в породу.
Важнейшей характеристикой, определяющей активность электролита ZnCl2 в водной среде, является ионная сила:
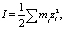 (1)
(1)
где I – ионная сила;
mi – концентрация каждого иона;
zi – валентность.
Ионная сила зависит от концентрации ионов и их валентности, а поведение электролита и активность раствора определяется физико-химической природой раствора.
Также существует эффект адсорбционного ослабления мерзлого образца, с проникновением водного раствора ZnCl2 в глубь образца в микротрещины по плоскостям скольжения. Влияние сил сцепления ведет к «залечиванию» зоны разрушения за счет выжимания адсорбционных пленок. Использование водного раствора хлорида цинка, также как дистиллированной воды, не увеличивается при дезинтеграции мерзлых суглинков. Это объясняется сохранением рыхлосвязанного слоя в двойном электрическом слое.
Поэтому неявно выраженное увеличение силы разрушения мерзлых суглинков и супесей в водных растворах ZnCl2 и наоборот увеличение дезинтеграции при применении водных растворов NaCl можно объяснить воздействием обменных катионов.
Если диффузный слой ионов оказывается подавленным и катионы и анионы равномерно распределены по сечению пор, то электроосмотическое движение воды в глинистых горных породах, поровый раствор которого представлен раствором электролита NaCl с концентрациями более 50 г/л, не происходит.
Увеличение коэффициента фильтрации при фильтрации водных растворов солей в суглинки и супеси в сравнении с обыкновенной водой отмечалось некоторыми учеными, что и было принято нашим вниманием [2]. Исходя из этого, можно предположить, что сила дезинтеграции мерзлых суглинистых и супесчаных пород в водных растворах солей должна увеличиваться по сравнению с таковой в дистиллированной воде.
Скорость проникновения в образец растворов солей будет влиять на силу дезинтеграции мерзлых суглинистых и супесчаных пород, которая слагается из скорости фильтрации (Vф) и скорости электроосмотического течения (Vэ):
Vо = Vф + Vэ. (2)
Закон Дарси подчиняет себе фильтрацию в полностью водонасыщенных грунтах при ламинарном режиме движения:
Vо = Kф*grad(p), (3)
где Vф – скорость фильтрации; Kф – коэффициент фильтрации; grad (p) – градиент давления на пути фильтрации L.
С помощью возникающего на границе раздела «твердое тело – жидкость двойного электрического слоя» объясняется механизм электроосмотического движения жидкости. Согласно теории д.э.с. электроосмотическое течение под действием приложенного электрического поля описывается выражением:
Vэ = Kэ*grad(p) =
= 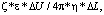 (4)
(4)
где Vэ – скорость электроосмотического течения; Kэ – коэффициент электроосмоса; grad (p) – градиент электрического потенциала; ?U – электрическое напряжение; ?L – расстояние между точками; ? – вязкость раствора; ? – диэлектрическая проницаемость раствора; p – электрокинетический потенциал.
Электрокинетические свойства грунта, геометрия порового пространства и свойства порового раствора описываются с помощью коэффициента электроосмоса (Kэ). Значение Kэ для широкого диапазона грунтов от глин до среднезернистых песков изменяется в узких пределах (от 1•10-5 до 8•10-5 см2/В•с), тогда как Кф при этом изменяется в миллионы раз.
В ходе экспериментальных исследований были получены зависимости силы дезинтеграции мерзлых суглинков при различных концентрациях хлорида натрия в водном растворе при температурах образцов –17 °С и –3 °С и постоянной температуре растворов во всех экспериментах +10 °С.
Скорость дезинтеграции образцов в растворах NaCl в зависимости от концентрации возрастает, имеет максимум при концентрации соли 30–40 г/л и затем убывает (рис. 2).
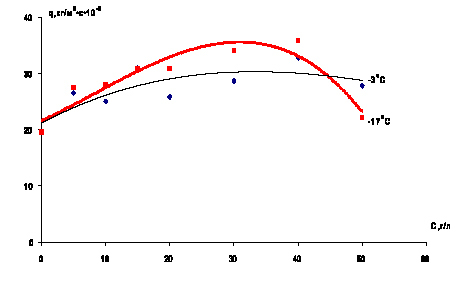
Рис. 2. Зависимость силы дезинтеграции мерзлых суглинков при различных концентрациях хлорида натрия в водном растворе
Скорость движения воды при фильтрации в глинах значительно меньше, чем при электроосмосе [1, 8].
Как показали экспериментальные исследования, состав обменных катионов в минералах и катионный состав взаимодействующего с ними раствора электролита оказывают большое влияние на физико-химические обменные процессы в грунтах. Кроме того, необходимо отметить, что более мелкие ионы удерживаются менее прочно по сравнению с более крупными, т.е. энергия поглощения катионов возрастает в соответствии с их валентностью, и среди обменных катионов одной валентности энергия поглощения возрастает вместе с увеличением их радиуса. Но существует и исключение, которое составляют ион К+ и ион Н+, энергия обмена которых выше энергии обмена других ионов.
Уменьшение ζ-потенциала происходит с ростом концентрации электролита и при концентрации электролита 0,5–1 н электрокинетический потенциал становится равным нулю.
Величина ζ-потенциала определяется толщиной рыхлосвязанного слоя воды где электрокинетический потенциал представляет разность потенциалов между прочносвязанным и рыхлосвязанным слоями воды около поверхности твердого тела. Уменьшению ζ-потенциала способствуют повышение концентрации электролита в растворе, а также повышение температуры.
Радиус ионов, составляющих слой, приблизительно равен толщине прочносвязанной части двойного электрического слоя. При этом заряд и концентрация ионов, входящих в рыхлосвязанную часть двойного слоя, определяется толщиной рыхлосвязанного слоя при данной температуре. Толщина же рыхлосвязанной части двойного слоя достигает в разбавленных растворах нескольких тысяч ангстрем, а в концентрированных растворах уменьшается до десятков и единиц ангстрем.
В условиях максимального развития рыхлосвязанного слоя наблюдается наибольшая величина ζ-потенциала, что можно увидеть лишь при некоторой оптимальной концентрации электролита в очень разбавленных растворах. Например отрицательный ζ-потенциал бывает у глинистых минералов, в частности каолин, который может достигать – 40 мВ.
В результате экспериментальных исследований можно констатировать факт, что коэффициент фильтрации у воды будет меньше, чем у водного раствора хлорида натрия, и разница будет зависеть от содержания в породе глинистой фракции.
Поэтому влияние водных растворов хлорида натрия с большими концентрациями приведет к увеличению интенсивности разрушения мерзлых песчано-глинистых пород на 20 % по сравнению с использованием дистиллированной воды.



