Многие свойства и функции аминокислот (АК) зависят от их способности взаимодействовать с водой. Одни из АК легко образуют различные комплексы с молекулами воды, структура других, напротив, содержит различные молекулярные фрагменты (гидрофобные группы), препятствующие взаимодействию АК с водой. Именно гидрофильность или гидрофобность АК, характеризующие их сродство к воде, играют определяющую роль в таких важных процессах жизнедеятельности, как усвоение аминокислот и выведение продуктов реакции из организма, а также обеспечивают сворачиваемость белков [1–3].
Важным аспектом исследования АК в водном растворе является их структура. Как известно, в водном растворе АК в соответствии со своей амфотерной природой могут иметь разную ионную форму при разных рН. Поскольку в нейтральном водном растворе все АК, независимо от их гидрофильности или гидрофобности, имеют цвиттер-ионную форму, то возникает необходимость определить, как гидрофильность влияет на колебательные спектры АК.
Для решения этой задачи необходимо в первую очередь определить, какой использовать метод для анализа гидрофильности вещества. В настоящее время существуют различные экспериментальные и теоретические методы исследования этого свойства. В частности, предлагаются различные статистические модели расчета гидрофобной и гидрофильной гидратации, методы молекулярной динамики для исследования структурных и энергетических характеристик гидратации вещества, используется методика расчёта энергии сольватации малых гидрофобных частиц и вычисления потенциала их взаимодействия и т.д. [4].
Несомненно, спектральные методы являются одними из самых широко используемых традиционных методов исследования взаимодействия вещества с водой. Межмолекулярное взаимодействие вещества с водой приводит к смещению частот валентных колебаний, участвующих в образовании водородных связей, и изменению интенсивности соответствующих полос поглощения.
Цель данной работы – определить влияние гидрофильности на колебательные спектры цвиттер-ионных форм серина (Ser) и треонина (Thr).
Метод расчёта
Оптимизация структуры АК и их комплексов с молекулами воды, а также расчёт колебательных спектров проводился по программе Gaussian-09 с использованием метода DFT в приближении B3LYP и базисного набора 6-311++g(d,p) [5].
Для характеристики межмолекулярного взаимодействия (ММВ) можно использовать два метода: метод эффективного учёта ММВ (например, с помощью модели самосогласованного реактивного поля SCRF), либо непосредственный учёт ММВ, который предполагает образование молекулярных комплексов АК с молекулами воды. Цвиттер-ионные формы всех АК, независимо от их гидрофобности или гидрофильности, стабилизируются первым методом. При этом для алифатических аминокислот, а также цистеина и метионина, обладающих свойством гидрофобности, наблюдается хорошее согласие экспериментальных и вычисленных колебательных спектров. Очевидно, что для АК, обладающих свойством гидрофильности, возможно образование водородных связей с молекулами воды, что окажет влияние на колебательные спектры и приведёт к значительному изменению спектров по сравнению со спектрами, вычисленными только с помощью метода эффективного учёта ММВ. Основной критерий проявления гидрофильности цвиттер-ионных форм Ser и Thr в водном растворе сравнение вычисленных и экспериментальных колебательных спектров рассматриваемых АК.
Результаты исследования и их обсуждение
Наиболее целесообразно выполнять расчёт ИК-спектров Ser и Thr, поскольку спектры КР менее чувствительны к проявлению водородных связей. Кроме того, анализ проявления гидрофильности ограничить спектральной областью 600–1700 см-1, что связано с наличием экспериментальных колебательных спектров водных растворов Ser и Thr для этой области. Большинство колебаний в области 600–1700 см-1 являются деформационными, которые значительно меньше подвержены влиянию водородных связей и для большинства молекул редко бывают характеристичными. Именно поэтому влияние водородных связей на колебательный спектр в рассматриваемой области будет иметь индивидуальный характер и давать однозначный ответ о характере взаимодействия Ser и Thr с молекулами воды.
Молекулярные диаграммы Ser и Thr, а также комплексы Ser с шестью (Ser:6w) и Thr с семью (Thr:7w) молекулами воды приведены на рис. 1.
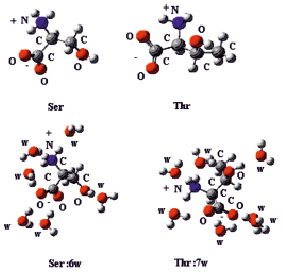
Рис. 1. Молекулярные диаграммы цвиттер-ионных форм Ser, Thr и комплексов Ser с 6 и Thr с 7 молекулами воды
Образование водородных связей между Ser, Thr и молекулами воды приводит к конформационному изменению АК. В комплексе Ser:6w наблюдается уменьшение СС, СN+ и увеличение CO- длин связей на 0,3 %; изменение валентных углов не превышает 3-5 град. Длины водородных связей N+Н…Оw, O-…HOw и ОН…Ow равны 2.86, 2.74 и 2.80 A, соответственно. Для комплекса Thr:7w структурные изменения носят аналогичный характер.
Вычисленные в гармоническом приближении значения частот нормальных колебаний Ser и комплекса Ser:6w приведены в табл. 1.
Таблица 1
Вычисленные (nр, cм-1) значения частот и интенсивностей спектров ИК (IИК, км/моль) Ser и комплекса Ser:6w
|
№ |
Ser |
Ser:6w |
||||
|
νр |
IИК |
Отнесение |
νр |
IИК |
Отнесение |
|
|
10 |
667 |
15,2 |
δ(CCN+) |
634 |
26,3 |
δ(CCN+) |
|
11 |
764 |
9,0 |
ω(COO-) |
775 |
127,2 |
τ(COH) |
|
12 |
833 |
97,0 |
τ(COH) |
785 |
49,1 |
ω(COO-) |
|
13 |
934 |
57,9 |
ν(C-C) |
993 |
21,1 |
ν(C-C) |
|
14 |
976 |
53,2 |
ν(CN+) |
1000 |
13,4 |
ν(CN+) |
|
15 |
1027 |
49,2 |
ω(CH2) |
1046 |
23,0 |
ω(N+H3) |
|
16 |
1088 |
87,5 |
ν(CO) |
1090 |
42,8 |
ν(CO) |
|
17 |
1100 |
56,7 |
ω(N+H3) |
1169 |
17,2 |
τ(N+H3) |
|
18 |
1139 |
30,5 |
τ(N+H3) |
1195 |
9,0 |
ω(СH2) |
|
19 |
1255 |
1,1 |
τ(СH2) |
1249 |
8,7 |
δ(COH) |
|
20 |
1273 |
69,4 |
δ(COH) |
1328 |
83,4 |
τ(CH2) |
|
21 |
1325 |
126,0 |
ν(COO-) sym |
1342 |
76,1 |
δ(CH2) asym |
|
22 |
1353 |
89,4 |
δ(CH2) asym |
1380 |
73,7 |
δ(CH) |
|
23 |
1358 |
61,9 |
δ(CH) |
1405 |
68,5 |
ν(COO-) sym |
|
24 |
1428 |
526,6 |
δ(N+H3) sym |
1477 |
15,1 |
ω(CH2) |
|
25 |
1475 |
30,0 |
ω(CH2) |
1510 |
6,1 |
δ(CH2) sym |
|
26 |
1520 |
5,2 |
δ(CH2) sym |
1596 |
114,4 |
δ(N+H3) sym |
|
27 |
1623 |
114,4 |
δ(N+H3) asym |
1655 |
374,1 |
ν(COO-) asym |
|
28 |
1665 |
47,9 |
δ(N+H3) asym |
1724 |
28,7 |
δ(N+H3) asym |
|
29 |
1670 |
736,8 |
ν(COO-) asym |
1733 |
54,3 |
δ(N+H3) asym |
Примечание: ν – валентные колебания связи; δ – деформационные колебания; w – веерные, t – крутильные колебания.
Влияние водородных связей на колебательный ИК-спектр Ser приводит к следующим характерным изменениям:
1) наблюдается уменьшение интенсивности (в ~ 2 раза) полосы поглощения, относящейся к валентному колебанию n(COO-);
2) частоты деформационных колебаний d(N+H3) смещаются в высокочастотную область на 150-200 см-1.
В результате образования водородных связей Ser с молекулами воды наблюдается изменение частот и интенсивностей полос поглощения по сравнению с частотами и интенсивностями ИК-спектра, вычисленного методом SCRF (рис. 2, б), что приводит к хорошему согласию с экспериментальным спектром Ser (рис. 2, а и в).
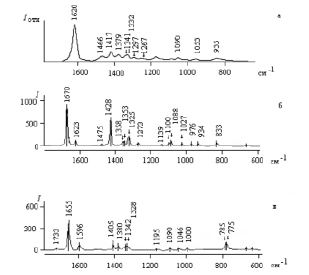
Рис. 2. Экспериментальный (а) [6] и вычисленные ИК-спектры Ser (б) и комплекса Ser:6w (в) в водном растворе
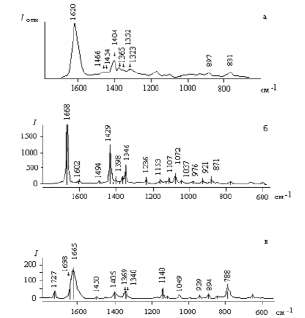
Рис. 3. Экспериментальный (а) [6] и вычисленные ИК-спектры Thr (б) и комплекса Thr:7w (в) в водном растворе
Результаты расчёта частот нормальных колебаний и интенсивностей полос поглощения ИК-спектра Thr и комплекса Thr:7w приведены в табл. 2.
Таблица 2
Вычисленные (nг, cм-1) значения частот и интенсивностей спектров ИК (IИК, км/моль) Thr и комплекса Thr:7w
|
№ |
Thr |
Thr:7ω |
||||
|
νр |
IИК |
Отнесение |
νр |
IИК |
Отнесение |
|
|
13 |
660 |
18,8 |
δ(CCN+) |
651 |
31,1 |
δ(CCN+) |
|
14 |
768 |
21,3 |
δ(CCC) |
788 |
122,1 |
δ(CCC) |
|
15 |
839 |
7,0 |
δ(CCC) |
846 |
9,0 |
δ(CCC) |
|
16 |
871 |
97,0 |
ω(COO-) |
894 |
35,5 |
ω(COO-) |
|
17 |
921 |
60,6 |
ω( N+H3) |
939 |
28,9 |
ν(CN+) |
|
18 |
976 |
34,8 |
ν(CN+) |
986 |
10,5 |
ω( N+H3) |
|
19 |
1037 |
43,4 |
ν(C-C) |
1049 |
36,9 |
ν(C-C) |
|
20 |
1072 |
121,6 |
τ(COH) |
1114 |
14,5 |
τ(COH) |
|
21 |
1107 |
67,4 |
τ(N+H3) |
1140 |
84,1 |
τ(СH3) |
|
22 |
1124 |
32,0 |
τ(СH3) |
1168 |
11,3 |
τ(N+H3) |
|
23 |
1153 |
52,0 |
ν(CO) |
1186 |
11,2 |
ν(CO) |
|
24 |
1236 |
65,8 |
δ(COH) |
1295 |
6,3 |
δ(CH) |
|
25 |
1285 |
4,4 |
δ(CH) |
1340 |
30,8 |
δ(COH) |
|
26 |
1346 |
278,3 |
ν(COO-) sym |
1369 |
40,0 |
δ(CH) |
|
27 |
1364 |
65,5 |
δ(CH) |
1376 |
20,5 |
ν(COO-) sym |
|
28 |
1382 |
22,8 |
δ(CH) |
1402 |
23,1 |
δ(CH) |
|
29 |
1398 |
73,5 |
ω(CH2) |
1405 |
33,3 |
ω(CH2) |
|
30 |
1416 |
20,0 |
δ(CH3) sym |
1450 |
13,3 |
δ(CH3) sym |
|
31 |
1429 |
510,5 |
δ(N+H3) sym |
1495 |
10,8 |
δ(CH3) asym |
|
32 |
1487 |
8,7 |
δ(CH3) asym |
1502 |
6,5 |
δ(CH3) asym |
|
33 |
1494 |
22,7 |
δ(CH3) asym |
1601 |
15,3 |
δ(N+H3) sym |
|
34 |
1602 |
53,6 |
δ(N+H3) asym |
1665 |
190,8 |
ν(COO-) sym |
|
35 |
1668 |
707,7 |
ν(COO-) sym |
1698 |
79,7 |
δ(N+H3) asym |
|
36 |
1670 |
85,7 |
δ(N+H3) asym |
1727 |
50,4 |
δ(N+H3) asym |
Примечание: ν – валентные колебания связи; δ – деформационные колебания; w – веерные, t – крутильные колебания.
Влияние внутримолекулярной водородной связи между полярной группой N+H3 и связью ОН приводит к тому, что частота деформационного колебания d(N+H3) в спектре Thr выше частоты валентного n(COO-) колебания. Образование водородных связей Thr с молекулами воды приводит к ещё бoльшему (на ~ 50–150 см-1) смещению частот деформационных колебаний d(N+H3) в высокочастотную область. Так же, как и в спектре Ser, наблюдается уменьшение интенсивности полос поглощения, относящихся к валентному колебанию n(COO-), но оно более существенно от 3, 5 до 10 раз (табл. 2).
Изменения, наблюдающиеся в ИК-спектре комплекса Thr:7w (рис. 3, б, в), приводят к хорошему согласию с экспериментальным спектром Thr, измеренным для водного раствора (рис. 3, а).
Выводы
Таким образом, расчёт частот и интенсивностей ИК-спектров поглощения комплексов гидроксиаминокислот показал, что при расчёте колебательных спектров Ser и Thr в водном растворе недостаточно выполнять расчёты только методом эффективного учёта ММВ. Необходимо одновременно использовать и метод эффективного учёта ММВ, и метод непосредственного учёта ММВ за счёт образования молекулярных комплексов АК с молекулами воды, что подтверждается хорошим согласием экспериментальных и вычисленных ИК-спектров Ser и Thr и является результатом их гидрофильности.



