Гуминовые вещества входят в состав органического вещества многих природных объектов: вод, почв, осадочных отложений водоемов и твердых горючих ископаемых. Макромолекулы гуминовых веществ отличаются содержанием большого числа разнообразных функциональных групп, из которых преобладают кислородсодержащие карбоксильные и гидроксильные группы. Это определяет характер взаимодействия этих соединений с различными типами органических и неорганических веществ, например с ионами металлов, углеводов, аминов, в том числе и биогенных, и позволяет в определенных рамках рассматривать гуминовые вещества как своеобразные сорбенты, способные связывать вещества как силами физической природы, так и химически взаимодействовать с последними [1].
Одним, наиболее активным компонентом гуминовых веществ можно считать гуминовые или гумусовые кислоты, представляющие собой единый комплекс органических соединений темно-бурого, а в сухом виде – глубокого черного цвета с раковистым блестящим изломом. Основу структуры гуминовых кислот составляют ароматические кольца типа бензола, нафталина или гетероциклические – типа фурана, пиридина, индола и других соединений. Структурные фрагменты соединены между собой различными группам (-О-, -N-, -СН2-, -С-С-). Боковые цепи содержат преимущественно карбоксильные (-СООН) и гидроксильные группы фенолов (-ОН) с участием метоксильных, карбонильных, амидных групп и их комбинации [2]. Широкий спектр функциональных групп обеспечивает комплексообразующие и окислительно-восстановительные свойства гуминовых кислот [3]. Целью настоящего исследования является изучение зависимости относительной вязкости растворов гумата калия от рН среды, как косвенного показателя внутримолекулярных изменений.
Гуминовые кислоты являются практически не растворимыми в большинстве известных чистых растворителей, в том числе и в воде. Вместе с этим следует отметить, что в гидратированном виде они могут образовывать вполне устойчивые коллоидные системы, например, при достаточно долгом центрифугировании образца в дистиллированной воде, даже в кислой среде. Кроме этого, простое механическое диспергирование образца гуминовой кислоты, лишенной гидратной оболочки, приводит к тому, что визуально неизменная дистиллированная вода изменяет свой уровень рН среды с исходного 6,8 до 3,5 при 273 К. В щелочной среде происходит ионизация карбоксильной группы, а в области высокой щелочности и гидроксильных групп фенольных фрагментов. Образующуюся при этом систему принято называть гуматом, а в частном случае, если растворителем выступает водный раствор гидроксида калия – гуматом калия.
Образование раствора гумата калия возможно в широком диапазоне как уровней рН среды, так и гидромодулей растворитель – растворяемое вещество. Однако, изучая свойства растворов гумата калия, необходимо быть совершенно уверенным в том, что раствор содержит именно гумат калия и не содержит свободной щелочи, не вступившей в реакцию нейтрализации с кислыми функциональными группами. В своей работе мы добивались максимально возможного растворения образца почвенной гуминовой кислоты в разбавленном растворе гидроксида калия с точно установленным титром. В дальнейшем определялись плотность получаемого раствора стандартной процедурой, массовая концентрация полученного раствора по выпариванию растворителя в мягких условиях и максимальная растворимость гуминовой кислоты в растворе гидроксида калия при 273 К.
При максимальном насыщении раствора гидроксида калия происходит конкурентное насыщение более активных карбоксильных групп, а гидроксильные фенольные фрагменты остаются свободными. Естественно предположить, что при повышении уровня рН среды произойдет в определенный момент нейтрализация фенольной составляющей гуминовых кислот. Строение мицеллы при этом изменяется и, как следствие, некоторые физические свойства, в частности вязкость раствора. Учитывая, что растворы гуминовых кислот являются растворами высокомолекулярного соединения, а по своей сути полиамфолитами, возможно определение изоэлектрической точки растворов, что важно для понимания многих почвенных процессов.
Материалы и методы исследования
В качестве объекта эксперимента были выбраны гуминовые кислоты черноземов, расположенных в Ростовской области, которые извлекались методом экстракции с последующим осаждением, очисткой, установлением точного микроэлементного состава прибором фирмы «Carlo ErbaInstruments». Извлечение образцов гуминовых кислот производилось с предварительной декальцинацией почвы раствором хлороводородной кислоты с массовой долей хлороводорода в рабочем растворе 3 %. Образец почвы подготавливался в соответствии со стандартными процедурами, обрабатывался кислотой в течении суток, затем отмывался дистиллятом до нейтральной среды в промывных водах и высушивался на воздухе до воздушно-сухого состояния. Навеску подготовленной почвы обрабатывали 0,1 н раствором NaOH на кипящей водяной бане в течение 6 часов при гидромодуле 1:20 [4–6]. После охлаждения и отстаивания системы декантировали надосадочную жидкость и подвергали ее центрифугированию при 6000 оборотах ротора центрифуги в течение 15 минут для отделения нерастворимых частиц и разрушения коллоидов алюминиевых соединений. Темно-коричневую жидкость подкисляли 10 %-ным раствором соляной кислоты до уровня рН среды 1–2. Осадку давали уплотняться в течение 12 часов, отделяли центрифугированием при указанных выше режимах, промывали дистиллятом до нейтральной среды промывных вод. Не давая высыхать повторно, растворяли в водном растворе гидроксида натрия указанной выше концентрации, но без нагревания, центрифугировали, придерживаясь прежних режимов, повторно осаждали тем же осадителем и вновь отделяли осадок центрифугированием. Полученный образец гуминовой кислоты высушивался первоначально на воздухе, затем в сушильной камере при температуре 60 °С и охлаждался в эксикаторе над концентрированной серной кислотой. Найдено: содержание гуминовой кислоты в воздушно-сухом образце почвы – 4,52 %. Элементный анализ образца: зольных элементов не содержится, С – 52,46 %, Н – 6,75 %, О – 35,59 %, N – 5,2 %.
Получение раствора гумата калия. Навеску препарата гуминовой кислоты заливали точно определенным объемом раствора гидроксида калия 0,045 н концентрации, слегка нагревали при постоянном помешивании и оставляли при комнатной температуре на сутки. По истечении указанного времени раствор вновь слегка нагревали до 55 °С, выдерживали в течение 1 часа и при постоянном перемешивании охлаждали до комнатной температуры (22 °С), полученный раствор центрифугировали при 8000 оборотах ротора центрифуги в течение 10 минут. Фугат сливали, а осадок обрабатывали раствором хлороводородной кислоты, промывали до нейтральной среды, высушивали и взвешивали. По разнице масс определяли массу гуминовой кислоты, которая может быть максимально растворена при данных температурных условиях в использованном растворителе. Найдено: 1 грамм КОН максимально растворяет 0,788 г гуминовой кислоты при комнатной температуре. Параллельно определялась концентрация образовавшегося в растворе гумата калия методом испарения растворителя при температуре 60 °С из точно измеренного объема раствора. Рассчитанные в эксперименте данные не противоречили друг другу, практически численно совпадая и образуя раствор гумата калия с массовой концентрацией вещества 13,38 г/л. Полученный раствор обладал интенсивно-черным цветом, не позволяющим проводить турбодиметрические исследования, при 18 °С имел плотность равную 1,007 г/см3. Исходный раствор для работы разбавляли дистиллированной водой до содержания гумата калия 2,141 г/л. При этом отмечено смещение рН показателя от 5,96 единиц до 7,76, то есть произошло смещение из слабокислой области в область слабощелочных значений, что вполне объясняется увеличением степени гидролиза при разбавлении. Полученный раствор делили на отдельные порции, в которые вводили раствор гидроксида калия 0,045 н концентрации по каплям под контролем рН-метра. Отмечено, что равновесие рН показателя раствора устанавливается не сразу, а в течение некоторого промежутка времени, в связи с чем точные значения рН показателя устанавливали по истечении суток, когда волатильности показаний не было. Явление волатильности рН показателя, по-видимому, может быть объяснено статистической вероятностью взаимодействия гидроксильных ионов и источников свободных протонов молекул гуминовых кислот, в качестве которых выступают конкурирующие доноры протонов карбоксильные и гидроксогруппы фенолов. Между этими частями молекулы в течение некоторого времени устанавливается равновесие, связанное со статистически возможной первоначальной ионизацией фенольных групп, а затем с перемещением ионизации по месту карбоксигрупп, как более кислотноактивных. В это время происходит изменение рН среды из более основной в сторону более кислой среды, устанавливаемое в течение нескольких часов. Для каждого образца определялась плотность пикнометрическим методом. Методом капиллярной вискозиметрии в вискозиметре Оствальда определялось время истечения в трехкратной повторности для каждого образца. Результаты усреднялись, значительных колебаний в значениях отмечено не было. Относительную вязкость вычисляли по формуле
η = η0(ρt/ρ0t0),
где η – коэффициент вязкости полученного раствора, η0 – вязкость дистиллированной воды при температуре измерения, ρ – плотность определяемого раствора, t – время истечения данного раствора через капилляр вискозиметра, ρ0 – плотность дистиллированной воды при данной температуре, t0 – время истечения дистиллированной воды через капилляр вискозиметра.
Полученные результаты отражены в таблице.
Зависимость относительной вязкости раствора гумата калия от уровня рН – среды раствора при 18 °С
|
№ образца |
Уровень рН среды образца |
Время истечения – t, с |
Среднее значение времени истечения – t, с |
Плотность раствора, г/см3 |
Рассчитанная относительная вязкость – η |
|
1 |
7,76 |
9,5; 9,5; 9,6 |
9,53 |
1,0030 |
0,6716 |
|
2 |
8,03 |
10; 10; 10 |
10,00 |
1,0030 |
0,7050 |
|
3 |
8,30 |
9,9; 9,8; 9,8 |
9,83 |
1,0028 |
0,6927 |
|
4 |
8,86 |
9,9; 9,9; 9,9 |
9,90 |
1,0026 |
0,66257 |
|
5 |
9,22 |
9,9; 9,9; 9,9 |
9,90 |
1,0024 |
0,6970 |
|
6 |
9,52 |
9,9; 10; 10 |
9,96 |
1,0022 |
0,7150 |
|
7 |
10,00 |
10; 10; 10 |
10,00 |
1,0020 |
0,7000 |
|
8 |
10,33 |
10; 10; 10 |
10,00 |
1,0018 |
0,7000 |
|
9 |
10,82 |
9,9; 9,8; 9,8 |
9,83 |
1,0016 |
0,6920 |
|
10 |
11,10 |
9,9; 9,9; 9,9 |
9,90 |
1,0014 |
0,6970 |
|
11 |
11,50 |
9,9; 9,9; 9,9 |
9,90 |
1,0012 |
0,6970 |
|
12 |
12,00 |
10; 10; 10,1 |
10,03 |
1,0011 |
0,7300 |
Поскольку все исходные растворы являлись глубоко окрашенными, визуально степень прозрачности определить было невозможно, нами была предпринята попытка проведения микрокристаллоскопического исследования изучаемых растворов путем выпаривания растворителя в щадящих условиях с последующей визуальной оценкой вырастающих кристаллов. Все образцы давали примерно одинаковую картину: в поле зрения микроскопа при разных увеличениях фиксировали хаотично разбросанные кристаллические структуры в виде древовидных кристаллов, помещенных в систему аморфного пленкообразного вещества.
Результаты исследования и их обсуждение
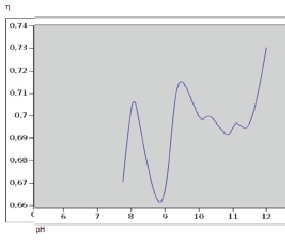
Рис. 1. Зависимость коэффициента вязкости раствора гумата калия от рН среды раствора
Изучив зависимость относительной вязкости от рН среды раствора гумата калия, представленную на рис. 1, можно отметить неоднозначный характер такой зависимости. Так, в области рН среды, равной 8,86 единиц, четко проявляется пик минимальной относительной вязкости, что может соответствовать изоэлектрической точке гумата калия в данных условиях. В области значений рН от 10 и практически до 11,5 коэффициент вязкости выходит на некоторую синусоиду, соответствующую, по-видимому, активному связыванию гидроксогрупп фенолов, подвергающихся значительному гидролизу. В области значений выше 11,5 относительная вязкость начинает существенно возрастать из-за подавления гидролитических процессов и формирования крупных ассоциатов как межмолекулярного характера, так и формированием внутримолекулярных связей электростатического характера.
В области рН 8,86 наблюдается экстремальное падение относительной вязкости раствора, вслед за которым резкий рост, показывающий пространственные флуктуации молекул.
Поскольку гуминовые кислоты рассматриваются как высокомолекулярные полифункциональные вещества, содержащие разные по характеру функциональные группы, то их можно характеризовать в растворах в виде гумата калия как полиамфолиты, на длинных цепях которых силами разного характера удерживаются нейтральные молекулы гуминовой кислоты, или по крайней мере отдельные участки гуминовых кислот, например малополярные центральные части такой молекулы [7, 8]. При удалении от минимального значения коэффициента вязкости, что может быть рассмотрено как изоэлектрическая точка полиамфолита в данных условиях, в молекуле с увеличением значения рН показателя растет суммарный отрицательный заряд, располагаемый преимущественно по поверхности молекулы, а внутрь системы проникают и удерживаются молекулы воды, формируя объемную гидратированную систему [1]. В растворе возникают силы взаимного отталкивания одноименно заряженных участков полимерной молекулы, приводящего в итоге к изменению положения заряженных участков и формированию новых связей в пределах агрегатов, что и позволяет химически сорбировать на молекуле гумата калия дополнительных не ионизированных в данных условиях молекул гуминовой кислоты, и, как следствие, молекула начинает разворачиваться с возможным изменением зарядов отдельных участков, что сопровождается верификацией значений рН среды в неизменных внешних условиях. Макромолекула гуминовой кислоты оказывается разными своими частями в тех слоях жидкости, которые движутся с разными относительными скоростями, и сама на себе испытывает действие момента сил, приводящих ее к вращательному движению относительно длинной оси, что в итоге выливается в относительный рост вязкости раствора (рис. 2).
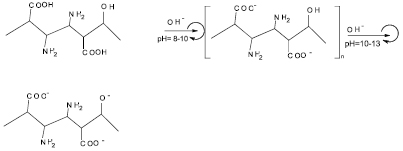
Рис. 2. Изменение молекулы гуминовой кислоты в зависимости от рН среды
Кроме этого возникает статистическая вероятность неполного насыщения кислых групп в пределах одной молекулы и одновременное насыщение кислых групп другой молекулы, что может формировать сорбцию нейтральных молекул с формированием комплекса гумат калия – гуминовая кислота. Результатом таких процессов может быть формирование аномалий относительной вязкости, связанной с установлением некоторого динамического равновесия. Для выяснения наличия вышеуказанных комплексов на стеклянные пластинки наносили образцы подготовленных для исследования вязкости комплексов и подвергали их кристаллизации в мягких условиях испарения растворителя. Полученные микропрепараты исследовались под микроскопом под увеличением в 40, 120 раз. Во всех препаратах наблюдалась одна и та же картина: в центре поля зрения четко определяется кристаллическая структура древовидной, сильно разветвленной формы, предположительно кристаллы истинного гумата калия, просвечивающиеся через проходящий свет, не имеющие цвета (рис. 3). По краю кристаллической структуры заметно наличие неструктурированного вещества в виде сплошной массы некристаллического (аморфного) характера отчетливого коричневого цвета, предположительно неионизированной сорбированной гуминовой кислоты, образованной в результате коагуляции устойчивой дисперсной системы, условно называемой раствором гумата калия (рис. 4, 5). Наблюдаемое явление подтверждается ИК-спектрами образцов. Наряду с фиксируемыми пиками карбоксилат- ионов в области 1400 и 1404 см-1 – симметричные колебания, 1634 и 1630 см-1 – асимметричные колебания, регистрируются характеристические полосы с максимумами поглощения в области 1238, 1252, 1254 см-1, характерные для колебаний связей С=О в карбоксигруппах и деформационные колебания ОН-групп в недиссоциированных карбоксильных группах.
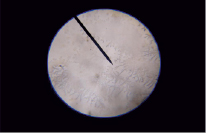
Рис. 3. Кристаллы гумата калия
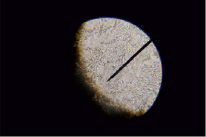
Рис. 4. Кристаллы гумата калия на границе с неионизированной гуминовой кислотой. Указатель направлен в сторону границы раздела
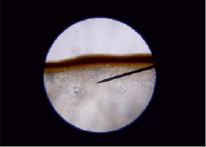
Рис. 5. Граница раздела кристаллической фазы и аморфной гуминовой кислоты
Анализируя полученные в ходе эксперимента данные, можно прийти к нескольким важным выводам:
1. Гуминовые кислоты в природных объектах (почвах, лечебных грязях и пр.) обладают, несомненно, буферными свойствами, дополняемыми агрегационными способностями, что приводит к образованиям специфических конгломератов, выполняющих важные свойства.
2. Описываемый в литературе гумат калия представляет собой межмолекулярный комплекс истинной соли, заключенной в оболочку аморфной нейтральной гуминовой кислоты.



