В последние годы, как в России, так и за рубежом активно ведутся исследования механизмов образования активных метаболитов кислорода и их роли в биологических системах, что подтверждается наличием огромного количества выпускаемых публикаций [1, 2]. Накопление активных форм кислорода и развитие окислительных процессов сдерживает мощная система антиоксидантной защиты, включающая низкомолекулярные антиоксиданты и ферменты [2]. Важнейшим ферментом первой линии антиоксидантной защиты является супероксиддисмутаза (СОД), которая катализирует реакцию дисмутации супероксидного анион-радикала. В результате работы СОД образуется пероксид водорода. Основным внутриклеточным ферментом, который разлагает токсичный для клеток пероксид водорода на воду и молекулярный кислород, является каталаза, работающая в составе второй линии защиты. Этот фермент обладает абсолютной субстратной специфичностью, то есть способен взаимодействовать только с одним строго определенным субстратом – пероксидом водорода. Каталаза известна как фермент, очень сильно ускоряющий реакцию. Одна молекула каталазы может расщепить до 40 миллионов молекул пероксида водорода в секунду. Такая высокая скорость реакции необходима для удаления активного кислорода, чтобы предохранить компоненты клеток от окислительного действия, поэтому каталаза принадлежит к числу наиболее интенсивно изучаемых ферментов [2].
Каталаза широко распространена в тканях животных, растений и микроорганизмах, за исключением облигатных анаэробов. В тканях живых организмов она обладает довольно высокой активностью, в том числе и в слоевищах лишайников [3, 4]. Изменение активности каталазы лишайников является в некоторой степени показателем реакции растительного организма на комплекс как абиотических, так и техногенных воздействий.
Известны различные методы определения активности каталазы: газометрический по Варбургу, химические методы (титриметрический по А.Н. Баху и А.И. Опарину, в котором остаточный пероксид водорода титрируется с перманганатом или излишек перманганата измеряется колориметрически [5]). Известна также спектрофотометрическая методика измерения активности каталазы в биологических жидкостях, основанная на способности пероксида водорода образовывать с солями молибдена стойкий окрашенный комплекс [6]. Полярографический метод [7] достаточно точный, однако требует специального оборудования, работа которого сопряжена с применением химически вредных соединений. Все эти методы не затрагивают быстрого реакционного периода, который длится меньше минуты, и имеют ряд недостатков. При газометрическом методе требуется учитывать постоянную объема сосуда, необходимы приспособления для механического взбалтывания прибора. Недостатками титриметрического способа являются необходимость постоянной проверки титров перманганата калия и пероксида водорода, кроме того, для окрашенных растворов трудно определить окончание титрования. В целом вышеперечисленные методы достаточно сложны и трудоемки, требуют использования дополнительных реагентов или специального оборудования. Кроме того, для каждого исследуемого объекта требуется адаптация применяемой методики сообразно его особенностям.
Мы для своих исследований выбрали простой в аппаратурном исполнении и чувствительный спектрофотометрический метод. Метод основан на взаимодействии каталазы с пероксидом водорода и дальнейшем измерении кинетики реакции ферментативного окисления. Цель работы: оптимизация и корректировка спектрофотометрического метода определения активности каталазы для лишайников.
Материалы и методы исследования
Активность ферментов, участвующих в обмене веществ и находящихся в микобионте лишайников, неодинакова и зависит от видовых особенностей [2], поэтому объектами исследования выбраны два вида кустистых лишайников, наиболее распространенных в биотопах Северо-Западного региона России. Из почвенных лишайников изучался вид Cladonia stellaris, из эпифитных – Usnea florida. Отбор образцов лишайников производился в весенний и летний периоды 2016 г. на территории Устьянского района Архангельской области на три пробных площадках (на каждой два участка) в сосняках-брусничниках с одинаковым составом древостоя. Пробы лишайников отбирались весом 100–150 г на пяти равноудаленных точках одного участка в сухую, недождливую погоду. В лаборатории образцы очищали с помощью пинцета от посторонних загрязнителей (мхов, хвои и пр.), обмывали деионизированной водой для удаления с поверхности пылевидных частиц и высушивали до воздушно-сухого состояния. Поскольку природный материал неоднороден и очень вариабелен, обращали особое внимание на его усреднение. Подготовленные пробы упаковывали в бумажные пакеты и хранили до начала химического анализа в сухом помещении при комнатных условиях. Для анализа отбирались преимущественно целые, неповрежденные, наиболее крупные слоевища. Такие талломы считаются условно взрослыми. Определение видов лишайников проводилось по стандартным методикам с использованием определителя [8].
Активность каталазы изучали на спектрофотометре UV-1800, Shimadzu. Навеску растительного материала около 200 мг растирали в фарфоровой ступке с небольшим количеством фосфатного буфера (0,05 М, рН 7), количественно переносили в мерную колбу на 25 см3, доводили буферным раствором до метки. Полученный экстракт каталазы настаивали в течение 10 минут, затем центрифугировали при 4000 об/мин в течение 5 минут.
Активность каталазы в полученных вытяжках оценивалась кинетическим методом по начальной скорости реакции ферментативного окисления пероксида водорода в течение 30 секунд в расчете на 1 г сухой массы лишайника (е.о.п./c·г). В кювету спектрофотометра (длина оптического пути 1 см) вносили 2 см3 ферментной вытяжки и 1 см3 раствора пероксида водорода концентрацией 30 мМ, а в кювету сравнения – 2 см3 ферментной вытяжки и 1 см3 фосфатного буферного раствора. Оптическую плотность растворов во времени измеряли при длине волны 240 нм. Экспериментальные результаты обработаны методами математической статистики. В ходе обработки определялись: средние арифметические величины, стандартное отклонение, стандартная ошибка средней арифметической. При определении уровня достоверности полученных данных применялся критерий Стьюдента, так как он вполне адекватен всем аспектам исследований. Обработку проводили при доверительной вероятности P = 0,95 %, объем выборки за 2016 г. составил 36 значений, за 2017 г. – 36 значений.
Результаты исследования и их обсуждение
В литературе приведены методики определения каталазной активности различными методами для различных объектов исследования: почвы, растения, биологические жидкости. Мы в своих исследованиях за основу выбрали спектрофотометрические методики, приведенные в работах [9, 10].
За ходом ферментативной реакции следили по расходу субстрата – Н2О2, спектр поглощения которого находится в диапазоне длин волн от 200 до 400 нм. Продукты реакции, кислород и вода, не поглощают свет в этой спектральной области, поэтому поглощение в ультрафиолете (240 нм) – это точное измерение концентрации Н2О2 в реакционной системе: каталаза – пероксид водорода.
В буферированной ферментативной вытяжке лишайников могут присутствовать и другие соединения (водорастворимые фенолы, пигменты и др.), которые могут вносить погрешность в измерение содержания пероксида водорода. Для учета влияния собственной окраски экстрактов в качестве раствора сравнения использовали буферированный раствор экстракта без пероксида водорода. Чтобы минимизировать погрешность результатов, разведение пробы подбирали так, чтобы измеряемая оптическая плотность попадала в диапазон значений 0,5–1,0. Активность каталазы проявляется в диапазоне рН от 5 до 11, причем оптимум находится при рН 6,5–8,5, при котором и изучалась ферментативная реакция.
В таблице приведены средние значения каталазной активности лишайников Cladonia stellaris и Usnea florida с доверительным интервалом. Каталазную активность в лишайниках определяли в свежеотобранных образцах (2016 г.) и через год хранения (2017 г.). Показано, что спектрофотометрический метод позволяет определить активность каталазы в свежеотобранных образцах лишайников с относительной погрешностью 2,1 %. Анализ сезонной динамики каталазной активности показал незначительное увеличение этого показателя в летний период. По-видимому, небольшое снижение влажности в летний период (рисунок) в образцах лишайников распознается растением как стресс и является его защитной реакцией к сохранению гомеостаза, при этом активность каталазы незначительно возрастает. Эта тенденция наблюдается для двух видов проанализированных лишайников (таблица). Кроме того для каталазной активности лишайников наблюдается видовая изменчивость и зависимость от природных условий произрастания (3 различные по условиям пробные площадки), причем различия несколько сглаживаются при длительном хранении образцов.
Одной из важных и интересных особенностей лишайников является их способность находиться в сухом состоянии на протяжении длительного времени. При этом они не погибают, а всего лишь временно приостанавливают свои жизненные функции до первого увлажнения. Как показано в таблице, каталазная активность лишайников значительно снижается при длительном хранении, относительная погрешность метода составила 2,7 %.
Известно, что каталаза относится к ферментам, которые наиболее длительно сохраняют свою высокую активность. Скорость реакции этого фермента лимитируется лишь скоростью диффузии субстрата к активному центру. В нашем эксперименте потеря влаги за год хранения значительна и составляет около 30 % (рисунок).
Каталазная активность образцов лишайников (е.о.п/c·г)
|
Пробные площадки |
Cladonia stellaris |
Usnea florida |
||
|
весенний период |
летний период |
весенний период |
летний период |
|
|
анализ выполнен в 2016 г. |
||||
|
1 |
13,02 ± 0,46 |
14,79 ± 3,85 |
9,16 ± 0,47 |
10,86 ± 3,70 |
|
2 |
16,71 ± 0,04 |
18,53 ± 1,42 |
10,66 ± 1,23 |
13,79 ± 1,54 |
|
3 |
5,29 ± 1,84 |
7,63 ± 0,35 |
5,98 ± 0,17 |
6,69 ± 1,69 |
|
средняя относительная погрешность – 2,1 % |
||||
|
анализ выполнен в 2017 г. |
||||
|
1 |
0,55 ± 0,03 |
0,73 ± 0,10 |
0,73 ± 0,04 |
1,54 ± 0,08 |
|
2 |
1,02 ± 0,26 |
1,24 ± 0,25 |
1,05 ± 0,03 |
2,25 ± 0,33 |
|
3 |
0,36 ± 0,08 |
0,38 ± 0,04 |
0,84 ± 0,03 |
0,87 ± 0,14 |
|
средняя относительная погрешность – 2,7 % |
||||
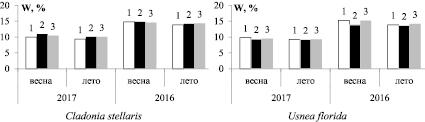
Изменение влажности лишайников в процессе хранения
Можно предположить, что каталаза долгое время сохраняет свою активность и стабильность даже в условиях, неблагоприятных для жизнедеятельности, благодаря иммобилизации с хитин-глюкановым комплексом (ХГК) «клеточной стенки» таллома лишайника.
Лишайники представляют собой особую группу живых организмов, тело (таллом) которых представляет собой связнодисперсную капиллярно-пористую полимерную матрицу, построенную из полисахаридных компонентов различной структуры. Основными соединениями клеточной стенки грибов (грибной компонент составляет 90–98 % биомассы таллома) являются полисахариды, представленные разветвленными глюканами и хитином, которые образуют ХГК. Внутриклеточные ферменты, в том числе каталаза, представляют собой коллоидные частицы и входят в состав клеточной стенки микобионта. Изменение структуры клеточной стенки лишайников (потеря влаги, набухание и др.) влияют на активность фермента и скорость ферментативных реакций.
Ранее была показана способность анионных пероксидаз пшеницы связываться с хитином [11], что подводит к мысли о наличии таких свойств у пероксидаз, а возможно, и каталаз у других видов растений. Исследования, проведённые различными авторами, показывают, что методом направленной иммобилизации фермента с полисахаридами получают значительно более стабильные, а в некоторых случаях и более активные препараты фермента. Из полисахаридов и их производных наибольшую стабильность и активность иммобилизованного ферментного препарата обеспечивает производное хитина – хитозан, как отдельный полисахарид, так и в составе интерполиэлектролитного комплекса [12, 13].
Таким образом, на основании полученных результатов можно предположить, что каталаза стабилизируется при контакте с ХГК. Активность фермента во времени зависит от содержания воды в слоевище. Потеря влаги при длительном хранении значительно снижает активность фермента, а незначительное снижение влажности при сезонной изменчивости повышает каталитическую активность фермента и является защитной реакцией лишайников на стресс.
Работа выполнена при финансовой поддержке ФАНО России в рамках научного проекта комплексной программы УрО РАН № 15-2-5-34 «Новые подходы к комплексной оценке состояния и эволюции лесных и болотных экосистем западного сегмента Арктики» на оборудовании ЦКП КТ РФ «Арктика» ФИЦКИА РАН.



