Залогом успешного и стабильного производства зерна в Поволжье является биоразнообразие возделываемых культур. Среди зерновых культур тритикале является наиболее стрессоустойчивой [1]. Мировые площади под этой культурой достигли 4,14 млн га [2]. Одним из главных ее преимуществ является высокий потенциал продуктивности. Большой интерес к культуре основан и на многоцелевом использовании зерна. Круг отраслей, применяющих зерно тритикале, достаточно широк. Оно востребовано в животноводстве, хлебопекарной, кондитерской и спиртовой промышленности. Наращивание объемов производства зерна в современных условиях возможно только за счет создания принципиально новых сортов этой культуры, адаптированных к жестким условиям региона, что требует достаточно большого генетически разнообразного и адаптированного исходного материала. На создание новых сортов методами традиционной селекции требуется 12–15 лет, из которых 5–7 лет затрачивается для достижения гомозиготности, обеспечивающей отличимость будущего сорта и стабильность его признаков. Биотехнологические методы, основанные на получении гаплоидных растений in vitro, позволяют получать гомозиготы одноэтапно и сокращать сроки создания сортов, отвечающие всем требованиям современного рынка. В различных лабораториях мира гаплоидные биотехнологии являются интегральной частью селекционного процесса у экономически значимых видов растений. На сегодняшний день зарегистрировано около 300 сортов, полученных c использованием различных DH-протоколов, 150 из которых принадлежат Poaceae и их число постоянно увеличивается [3]. Культура пыльников является одним из методов массового получения гаплоидных растений у злаков [4]. Его разновидностью является культура изолированных микроспор [5]. Микроспоровый эмбриогенез (андрогенез) основан на спорофитном развитии микроспор (в отличие от гаметофитного), их делении и формировании эмбриоподобных структур. Регенерация растений из последних приводит к получению растений с гаплоидным числом хромосом. Последующая диплоидизация числа хромосом обеспечивает получение гомозиготных линий (DH-линий). Известны лишь единичные факты получения гаплоидных растений тритикале методом селективной элиминации хромосом при использовании в качестве опылителя кукурузы [6] и дикой злаковой травы Imperata cylindrica [7]. В селекции ржи и тритикале гаплоидия менее востребована из-за низкой частоты получения зеленых растений.
Цель настоящего исследования – изучить эффективность метода культуры пыльников для создания селекционно ценных линий тритикале для условий Поволжья.
Материалы и методы исследования
Для получения гаплоидных растений и DH-линий служили 6 гибридов от скрещивания элитных линий озимого тритикале. № 1 – F2 АД-1//МАГ/Эллада; № 2 – F2 Студент/Патриот//Эллада; № 3 – F2 Валентин/DH-25//МАГ/Корнет; № 4 – F2 МАГ/АД1// Саратовская 8, оз. мягкая пшеница; № 5 – F2 МАГ/АД1//МАГ/Эллада; № 6 – F2 Устинья/DH-30. Донорные растения отбирали на стадии вакуолизированной микроспоры, и срезанные побеги хранили в холодильнике при температуре + 2…5 °С в течение 7–10 суток. Все работы по вычленению и культивированию пыльников проводили в условиях асептики. Колосья стерилизовали раствором коммерческого препарата «Белизна» в течение 8 минут с последующей трехкратной промывкой стерильной дистиллированной водой. По каждому гибриду культивировали около 2 тысяч пыльников. В качестве индукционной питательной среды служили C-17 с добавлением в качестве регуляторов роста 2,4-Д (2 мг/л) и кинетин (0,5 мг/л). Через 6 недель культивирования ЭС размером более 1 мм были помещены на среду для регенерации растений, содержащей в качестве регуляторов роста ИУК (1,0 мг/л) и кинетин (0,5 мг/л). Для сравнительного анализа влияния состава питательных сред были использованы две прописи – N6 и C-17. Цитологический контроль за спорофитным развитием микроспор проводили на временных препаратах с окраской ацетокармином. Эффективность отдельных этапов гаплопродукции оценивали по следующим параметрам: выход эмбриогенных структур (ЭС, как % к общему числу пыльников in vitro), регенерация растений ( % от общего количества эмбриогенных структур), выход зеленых и альбиносных растений ( % от общего количества регенерантов). Гаплоидные растения были обработаны раствором колхицина (0,2 %) с добавлением 8–10 капель ДМСО в качестве мембранотропного агента при комнатной температуре в течение 5 часов для получения удвоенных гаплоидов (DH-линий). Полученные данные обрабатывали методом дисперсионного анализа с применением программ статистического и биометрико-генетического анализа в растениеводстве и селекции «AGROS-2» (версия 09).
Результаты исследования и их обсуждение
Проведенные цитологические исследования установили возможность различных событий при культивировании изолированных пыльников. Основная их часть гибнет на 7-й день культивирования, часть микроспор продолжает гаметофитную программу с последующей дегенерацией вегетативного и генеративного ядер, и лишь немногочисленная популяция клеток переходит на спорофитный путь развития. Последний реализуется на основе различных цитологических возможностей. При равном делении микроспоры расположение поры и двух образующихся ядер соответствует равностороннему треугольнику (рисунок, а). Некоторые микроспоры делятся с формированием вегетативной и генеративной клеток с последующей митотической активностью вегетативной клетки (рисунок, б). В результате серии делений формируются многоклеточные структуры, которые какое-то время находятся внутри оболочки микроспоры (рисунок, в). Интенсивный рост многоклеточных новообразований способствует растяжению и разрыву оболочки микроспоры (рисунок, г) с последующим формированием эмбриоподобных структур (рисунок, д). Последующее культивирование ЭС на среде для регенерации приводит к формированию гаплоидных растений (рисунок, ж, з).
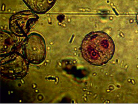
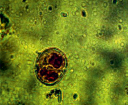
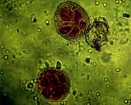
а б в
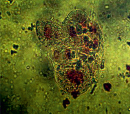

г д



е ж з
Последовательные этапы получения гаплоидных растений в культуре пыльников тритикале: а – равное деление микроспоры, б – деление вегетативной клетки, в – многоклеточные структуры, г – разрыв оболочки, д – общий вид пыльника со спрофитно развивающимися микроспорами, е – эмбриоподобные структуры, ж, з – последовательные стадии регенерации растений
Изучение эффективности получения гаплоидных растений у шести гибридов озимого тритикале показало, что статистически значимые различия между ними наблюдаются как на промежуточных этапах, так и на основном – регенерации зеленых растений. Широкий спектр изменчивости у гибридов выявлен по показателю «выход эмбриогенных структур» – он колебался от 9,0 до 145,4 % с наибольшим значением у межвидового гибрида № 4 – F2 МАГ/АД1// Саратовская 8, оз. мягкая пшеница и № 6 – F2 Устинья/DH-30. На одном пыльнике формировалось от 4,12 до 7,7 шт. эмбриоидов.
Успешность регенерации растений варьировала от 1,9 до 18,4 %, Необходимо отметить, что ранжир гибридов по показателям «выход эмбриогенных структур» и «успешность регенерации растений» не совпадает. Так, у гибрида № 4 – F2 МАГ/АД1// Саратовская 8, с высоким уровнем формирования эмбриогенных структур успешность регенерации растений была самой низкой (1,9 %). Напротив, у гибрида № 1 F2 АД-1//МАГ/Эллада при самой низкой частоте индукции новообразований (2,2 %) успешность регенерации составила 8,1 % и выход зеленых растений был наибольшим (табл. 1).
Генотипическая зависимость основных параметров андрогенеза при культивировании пыльников тритикале была отмечена и в других исследованиях [8]. Полученные данные подтверждают различный генетический контроль индукции андрогенетических структур и регенерации из них растений. Установлено, что по крайней мере три независимых генетических компонента вовлекаются в отзывчивость генотипа – индукция эмбриогенных структур, регенерация растений и регенерация зеленых растений. Эти три составляющие андрогенеза наследуются независимо и имеют полигенный контроль [9, 10]. Идентификация локусов количественных признаков (QTLs) позволила определить области генома, связанные с андрогенетической отзывчивостью тритикале. Индукция эмбриогенных структур контролируется генами на хромосомах 5A, 4R, 5R и 7R. Наиболее высокий процент фенотипической изменчивости (17 %) обусловлен локусом QARSsm-5R-1. Дополнительные маркеры обнаружены на хромосомах 5R, 2B, 7B и 5R. Регенерация как зеленых, так и хлорофиллдефектных растений контролируется генами 4A хромосомы [11].
Всего в опыте получено 1129 гаплоидных растений, в том числе 309 зеленых и 820 хлорофиллдефектных (альбиносных). Степень проявления альбинизма зависела от генотипа. У гибрида № 5 – F2 МАГ/АД1//МАГ/Эллада соотношение зеленых и альбиносных растений составило 1:20 (из 210 полученных регенерантов только 10 были зелеными). В то же время у гибрида № 1 – F2 АД-1//МАГ/Эллада выход зеленых растений был в два раза больше по сравнению с альбиносными. Высокая частота формирования альбиносных растений (31,3–95,2 %) является одним из сдерживающих факторов получения гаплоидных растений в культуре пыльников тритикале. Как известно, альбинизм регенерантов in vitro является общим феноменом для различных видов злаков, у некоторых генотипов до 100 % гаплоидов являются альбиносами [12].
Таблица 1
Эффективность этапов получения гаплоидных растений в культуре пыльников гибридов тритикале
|
Гибрид |
Эмбриогенных структур, шт. % |
Регенерация растений |
Соотношение зеленых растений к альбиносным |
||
|
Всего, шт. ( %) |
Зеленых, шт. ( %) |
Альбиносных, шт. ( %) |
|||
|
1 |
198(9,0) |
16(8,1) |
11(68,7) |
5(31,3) |
2:1 |
|
2 |
701(32,8) |
45(6,4) |
9(20,0) |
36(80,0) |
1:4 |
|
3 |
1267(53,9) |
54(4,3) |
13(24,1) |
41(75,9) |
1:4 |
|
4 |
2735(141,2) |
151(1,9) |
13(8,6) |
138(91,4) |
1:10 |
|
5 |
1624(77,7) |
210(12,9) |
10(4,8) |
200(95,2) |
1:20 |
|
6 |
3547(145,4) |
653(18,4) |
253(38,7) |
400(61,3) |
1:1,6 |
|
Всего |
10072 |
1129(11,2) |
309(27,4) |
820(72,6) |
1:2,1 |
|
Fфакт. |
61843,8* |
718,4* |
96546,5* |
13858,8* |
|
|
НСР |
0,7 |
0,8 |
0,3 |
0,7 |
|
Примечание. № 1 – F2 АД-1//МАГ/Эллада; № 2 – F2 Студент/Патриот//Эллада; № 3 – F2 Валентин/DH-25//МАГ/Корнет; № 4 – F2 МАГ/АД1// Саратовская 8, оз. мягкая пшеница; № 5 – F2 МАГ/АД1//МАГ/Эллада; № 6 – F2 Устинья/DH-30.
Таблица 2
Влияние состава питательных сред, генотипа и их взаимодействия на основные параметры гаплопродукции тритикале
|
Источник изменчивости |
Выход эмбриогенных структур |
Регенерация растений |
Регенерация зеленых растений |
||||||
|
Доля влияния, % |
Fфакт. |
НСР05 |
Доля влияния, % |
Fфакт. |
НСР05 |
Доля влияния, % |
Fфакт. |
НСР05 |
|
|
Генотип |
75,0 |
42,3* |
2,9 |
45,5 |
158,5* |
1,2 |
17,5 |
3,9* |
6,4 |
|
Питательная среда |
3,2 |
106,8* |
1,6 |
– |
– |
– |
7,7 |
12,1* |
6,4 |
|
Взаимодействие генотип x питательная среда |
20,1 |
113,5* |
4,2 |
51,7 |
183,6* |
1,6 |
69,8 |
22,3* |
12,8 |
|
Прочие факторы |
2,7 |
2,8 |
5 |
||||||
Для выявления роли минерального состава питательных сред N-6 и C-17, используемых в большинстве лабораторий для культивирования пыльников тритикале, был использован двухфакторный дисперсионный анализ, который позволил выявить вклад генотипа, питательной среды и их взаимодействия на основные параметры гаплопродукции тритикале.
Формирование эмбриогенных структур обусловлено в основном влиянием генотипа (75 %). Доля влияния состава питательной среды была незначительной (3,2 %), взаимодействие факторов составило 20,1 %.
На показатель «регенерация растений» наибольшее влияние оказали генотип (45,5 %) и взаимодействие генотип x питательная среда (51,7 %). Этот факт свидетельствует о том, что генотипы реагируют различно на состав питательной среды. Вклад питательной среды был статистически недостоверным. Для показателя «регенерация зеленых растений» наибольшей была доля влияния взаимодействия факторов (69,8 %). Вклад генотипа и питательной среды был менее значимым, но статистически достоверным (табл. 2).
Использование метода культуры пыльников позволило за короткий срок создать гомозиготные линии и сформировать на их основе исходный материал для селекции тритикале в засушливых условиях Поволжья. Широкий спектр изменчивости селектируемых признаков отражает многочисленные типы рекомбинаций в микроспорах и дает возможность проведения отборов для ускоренного создания сортов с необходимыми свойствами. На различных этапах селекции изучаются DH-линии, обладающие комплексом селекционно ценных признаков. В то же время необходимо отметить, что генотипическая зависимость всех этапов получения гаплоидных растений и высокий процент альбинизма все еще ограничивают возможность широкого использования этой гаплоидной биотехнологии в селекции.
Выводы
1. Выявлена генотипическая зависимость основных этапов получения гаплоидных растений тритикале. Выход эмбриогенных структур составил 9,0 до 145,4 % от числа культивируемых пыльников, успешность регенерации – 1,9–18,4 %, Главными лимитирующими факторами при получении гомозиготных линий тритикале является низкая частота регенерации растений и высокий процент альбинизма среди регенерантов.
2. Применение двухфакторного дисперсионного анализа позволило выявить долю влияния генотипа, питательной среды и их взаимодействия на основные параметры гаплопродукции тритикале. Формирование эмбриогенных структур обусловлено в основном влиянием генотипа (75 %). Доля влияния состава питательной среды была незначительной (3,2 %), взаимодействие факторов составило 20,1 %. На показатель «регенерация растений» наибольшее влияние оказали генотип (45,5 %) и взаимодействие генотип x питательная среда (51,7 %). Вклад питательной среды был статистически недостоверным. Для показателя «регенерация зеленых растений» наибольший процент фенотипической изменчивости обусловлен взаимодействием факторов (69,8 %). Вклад генотипа и питательной среды был менее значимым, но статистически достоверным.
3. Использование метода гаплоидии позволило за короткий срок создать гомозиготные линии тритикале в качестве исходного материала для селекции тритикале в засушливых условиях Поволжского региона.



