Современной альтернативой топливной энергетике, базирующейся на использовании природных ресурсов – нефти, газа, угля, является водородная энергетика. Молекулярный водород привлекает большое внимание как высокоэнергоемкое топливо, превосходящее все природные ресурсы и экологически чистое, поскольку единственным продуктом его окисления является водяной пар.
Получение водорода путём конверсии органических веществ имеет некоторые ограничения. Водород, получаемый такими неквантовыми способами, содержит высокие концентрации трудноотделяемых примесей: СО, СО2 и др. Для проведения реакций требуется создание высоких температур. При фотостимулированном выделении водорода используют энергию квантов видимого и ультрафиолетового излучения для восстановления водорода из воды. Солнечный свет при этом выступает как возобновляемый источник энергии. Наиболее широко представлен в литературе синтез водорода из воды с применением фотокатализаторов на основе оксидов титана, олова, сульфида кадмия или композиций на их основе: CdS-TiO2, SnO2-TiO2 [1, 2].
В последние годы предложены эффективные фотокатализаторы для генерирования водорода в условиях видимого излучения. Так, авторами изучена композиция на основе нитрида тантала, модифицированного платиной и оксидом магния Pt/MgO/Ta3N5, позволяющая синтезировать молекулярный водород со скоростью 22,4 мкмоль/ч [3]. В работе показано, что графитовый нитрид углерода г-C3N4 является перспективным для производства водорода из воды или водных растворов красителей при воздействии видимого излучения [4]. При использовании ультратонких неметаллических нанолистов г-C3N4 достигается скорость выделения водорода из воды 189,3 мкмоль/ч. Значительно возрастает эффективность синтеза водорода в условиях видимого света и при использовании композитов на основе нитрида углерода Mn0.8Cd0.2S/г-C3N4, W18O49/г-C3N4 [5, 6].
Получать водород можно из растворимых органических загрязнителей: спирты, органические кислоты, галогенсодержащие и др. вещества. При этом будет достигаться одновременная очистка воды и генерирование водорода.
Нами было показано, что железосодержащие композиты на основе нитридов бора и кремния проявляют фотоактивность в процессах деградации растворимых органических веществ (РОВ), в частности щавелевой кислоты, формальдегида, фенольных соединений. Эффективность композитов связана с созданием в растворе различных фотокаталитических систем (фото-Фентона, ферриоксалатная и др.) посредством совмещения гетерогенного и гомогенного катализа. В работе показана возможность применения композитов на основе нитрида бора в совмещённых фотокаталитических процессах деградации РОВ и генерирования водорода [7]. В качестве «расходных» органических реагентов были использованы карбоновые кислоты (муравьиная и щавелевая), гидразин, красители (эозин, флуоресцеин, метиленовый синий).
Цель настоящей работы – синтез и оценка фотокаталитической активности металлокерамических композитов на основе сиалона и нитрида кремния в совмещённых процессах генерирования водорода и деградации РОВ.
Материалы и методы исследования
Объекты исследования: модифицированные композиты на основе сиалона и нитрида кремния, полученные методом самораспространяющегося синтеза (СВС) в отделе структурной макрокинетики Томского научного центра СО РАН. Фазовый состав материалов изучали методом рентгеновской дифракции (РД) на дифрактометре фирмы Shimadzu XRD6000 (Япония, «Shimadzu»). Для изучения морфологии и определения размера частиц исследуемых материалов использовали растровый электронный микроскоп HitachiTM-3000 с приставкой Quantax 70 для микрорентгеноспектрального анализа. Кислотно-основные свойства поверхности композитов исследовали методом Гаммета и Танабе с использованием 16 индикаторов со значениями pKa в интервале –0,29…+12,8 (табл. 1) по методике, описанной в работе [8]. Кривые распределения количества центров адсорбции данной силы (q) строили в координатах qpKa = f(pKa).
В качестве источника УФ излучения использовали ртутную лампу высокого давления ДРЛ-250 с наиболее интенсивной линией при 254 нм. Для выделения водорода использованы водные растворы органических загрязнителей – щавелевой кислоты (ХЧ, ГОСТ 22180-76) и гидразина сернокислого (ЧДА, ГОСТ 5841-74). Содержание щавелевой кислоты в реакционных системах контролировали методом перманганатометрического титрования.
Оценку фотокаталитической активности синтезированных композитов в процессе выделения водорода проводили по разработанной нами методике с использованием экспериментальной установки, которая подробно описана в работе [9]. Контроль газовой смеси и количества молекулярного водорода проводили методом газовой хроматографии на приборе «Кристалл 5000 – 1» (ЗАО СКБ «Хроматэк», 2007).
Результаты исследования и их обсуждение
В работе [7] нами было показано, что высокая фотокаталитическая активность композитов на основе нитрида бора связана с наличием в их составе фазы металлического железа и широкозонных полупроводниковых соединений (Fe3C, MgC2, Al4C3, SiC), обуславливающих керамической матрице оптические свойства. Частичное растворение железа при добавке реагентов-активаторов (Н2О2, Н2С2О4) способствует возникновению гомогенного фотокатализа (системы фото-Фентона, ферриоксалатная).
Таблица 1
Характеристики использованных кислотно-основных индикаторов
|
Индикатор |
рКа |
λмах, нм |
Индикатор |
рКа |
λмах, нм |
|
о-Нитроанилин |
–0,29 |
410 |
Бромкрезоловый пурпурный |
+6,40 |
540 |
|
Кристаллический фиолетовый |
+0,80 |
580 |
п-Нитрофенол |
+7,15 |
360 |
|
Бриллиантовый зеленый |
+1,30 |
610 |
Бромтимоловый синий |
+7,30 |
430 |
|
м-Нитроанилин |
+2,50 |
340 |
Тимоловый синий |
+8,80 |
430 |
|
Метиловый оранжевый |
+3,46 |
460 |
Пирокатехин |
+9,45 |
274 |
|
Бромфеноловый синий |
+4,10 |
590 |
Нильский голубой |
+10,5 |
640 |
|
Метиловый красный |
+5,00 |
430 |
Тропеолин 0 |
+12,0 |
440 |
|
Хризоидин |
+5,50 |
448 |
Индигокармин |
+12,8 |
610 |
Для повышения активности материалов на основе сиалона и нитрида кремния также представляло интерес введение в их состав углеродсодержащих соединений, обладающих полупроводниковыми свойствами. С этой целью состав исходной шихты, содержащей ферросиликоалюминий (ФСА), разбавляли шунгитом. ФСА был получен по «бездымному миниметаллургическому способу получения ферросплавов и лигатур» (СТ ТОО 38397431-001-2006). Он является комплексным раскислителем стали и восстановителем, используется в силикоалюмотермических процессах получения ферросплавов. По результатам химического анализа сплав содержит 60,1 % кремния, 13,3 % алюминия, остальное – железо. Исходный ферросплав представляет собой многофазный материал, состоящий из кремния, высокотемпературного лебоита (FeSi2), а также примесных фаз – Al0.5Fe0.5 и Al2O3. Микрорентгеноспектральный анализ ФСА показал, что алюминий находится в составе твердого раствора на основе FeSi2, образуя две фазы: FeSi2,2Al0,4 и FeSi1,6Al2,2 .
Шунгит является инертной добавкой, поскольку не подвергается азотированию, включает 53–58 % SiO2 и около 30 % углерода и может увеличить глубину протекания реакции, то есть выход сиалона/нитрида кремния и железа, уменьшая долю промежуточных продуктов – силицидов железа. Значительное содержание углерода в шунгите может приводить к образованию карбидов. Долю шунгита в шихте варьировали в интервале 0–30 %. Синтез образцов осуществляли по методике, описанной в работе [10].
Перед проведением процесса СВС исходные порошки сушили в вакуумном сушильном шкафу при температуре 150–200 °С для удаления влаги и летучих примесей. Приготовленную шихту засыпали в газопроницаемые цилиндрические трубки диаметром 40 мм и сжигали в установке постоянного давления при 4 МПа. Воспламенение образцов осуществляли от порошкообразной поджигающей смеси с помощью вольфрамовой спирали, через которую пропускали электрический ток. После прохождения волны горения образец выдерживали в установке в течение 30 мин до полного охлаждения и доазотирования.
Как показали исследования, увеличение доли шунгита более 10 мас. % при азотировании ФСА позволяет перевести нестационарный режим горения в стационарный, а продукт горения представляет собой однородный по всему объему пористый материал. Организовать процесс горения ФСА при разбавлении шихты более 30 мас. % не удалось. С увеличением добавки шунгита скорость распространения волны горения падает. Причём, количество поглощаемого азота заметно уменьшается при увеличении степени разбавления шихты в интервале 10–30 % (рис. 1). По-видимому, разбавление шихты шунгитом приводит к двойному эффекту. С одной стороны, увеличение инертной добавки снижает температуру горения, о чем свидетельствуют термограммы процесса. Уменьшение температуры горения происходит вследствие того, что в процессе азотирования общая реакционная масса увеличивается, а инертный разбавитель не вносит вклад в тепловыделение. С другой стороны, разбавление влияет на характер фильтрации азота в шихте. При увеличении добавки шунгита замедляются процессы спекания в материале, что повышает газопроницаемость образца.
Таким образом, получение продукта с наибольшей глубиной превращения и более однородной макроструктурой достигается при разбавлении шихты шунгитом на 15 мас. % (рис. 1). Фазовый состав продуктов горения существенно зависит от количества инертной добавки.
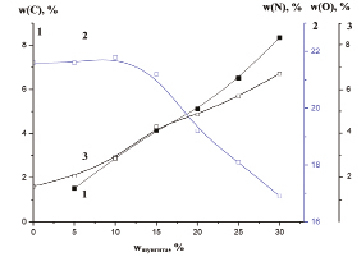
Рис. 1. Зависимость массовой доли ( %) углерода (1), азота (2) и кислорода (3) в продуктах горения ферросиликоалюминия от величины добавки шунгита
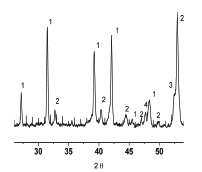 а)
а) 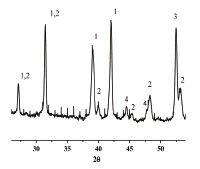 б)
б)
Рис. 2. Фрагменты рентгенограмм композиционных материалов, синтезированных с различными добавками шунгита, мас. %: 0 % – а; 10 % – б (1 – Si3N4 , 2 – β-Si3Al3O3N5 , 3 – Fe2Si, 4 – α-Fe)
На рис. 2 приведены фрагменты рентгенограмм синтезированных образцов. Композиты включают следующие фазы: β-Si3N4, β-Si3Al3O3N5, α-Fe, Fe2Si. Видно (рис. 2, а), что в отсутствие шунгита фаза β-Si3N4 преобладает над фазой β-Si3Al3O3N5. Аналогичная закономерность наблюдается и при небольшой его добавке (5 %). При 10 %-ном разбавлении (рис. 2, б) количество сиалоновой и нитридкремниевой фаз становится практически одинаковым.
При введении в шихту 15 мас. % шунгита рефлексы β-Si3Al3O3N5 значительно преобладают над рефлексами β-Si3N4, а продукты горения практически не имеют в своем составе исходных реагентов. Увеличение рефлекса продукта синтеза – фазы α-железа указывает на более глубокое протекание реакции. Дальнейшее разбавление шихты шунгитом приводит к значительному снижению температуры синтеза и вследствие этого к понижению степени азотирования. При этом в продуктах горения наблюдается значительное количество непрореагировавших исходных компонентов (Fe2Si).
Методом растровой электронной микроскопии установлено, что гранулы образцов, синтезированных с добавками шунгита, имеют округлую форму и представляют собой агломераты частиц с большим разбросом по размерам зерна (1–5 мкм). В образце № 6 наблюдается более равномерное распределение фазы железа по поверхности (2,6–2,7 %), чем в образце № 3 (1,8–2,6 %).
Для идентификации и оценки поверхностных активных центров синтезированных композитов методом Гаммета и Танабэ были исследованы кислотно-основные центры Al2O3 и металлического железа (рис. 3).
В композите № 3 (10 % шунгита), где преобладает фаза Si3N4, наблюдается большее количество основных центров Льюиса (рКа = –0,29) и кислотных центров Бренстеда (рКа 0–7). Причём наибольшее количество центров наблюдается при рКа = 6,4, сформированных фазой металлического железа. Распределение центров адсорбции (РЦА) по поверхности композита № 6 (25 % шунгита) с преобладающей фазой β-Si3Al3O3N5 коррелирует с РЦА на поверхности Al2O3. Это указывает на доминирующее участие алюминия и кислорода в формировании активных центров поверхности.
В табл. 2 представлены результаты получения водорода в процессе деградации гидразина и щавелевой кислоты в присутствии композитов № 3 и 6. Пероксид водорода добавляли для создания фотоактивной системы Фентона, генерирующей суперокислитель – •ОН радикал. Известно, что гидразин может окисляться до диимида, который легко разрушается с образованием Н2: N2H4 + Ox → N2H2 + H2O; N2H2 → N2 + H2. Добавление H2O2 в раствор Н2С22О4 приводит к совмещению систем фото-Фентона/ферриоксалатная, усиливающему синтез •ОН радикалов, вследствие чего происходит окислительное фоторазложение Н2С2О4 с выделением водорода. Более высокая производительность получения водорода из раствора щавелевой кислоты (рКа1 = 1,25; рКа2 = 4,27) может быть обусловлена её хорошей адсорбцией (30–40 %) на бренстедовских кислотных центрах композитов в отличие от гидразина (рКа = 7,97), адсорбция которого практически не происходит. Следует также подчеркнуть, что активность композитов № 3 и 6, синтезированных с добавкой шунгита, выше независимо от природы органического загрязнителя, что может быть связано с наличием карбидов металлов, обуславливающих оптическую активность матрицы в условиях УФ-излучения.
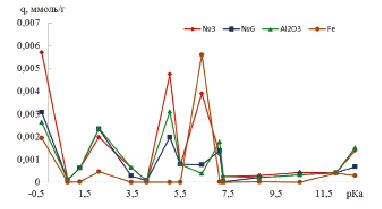
Рис. 3. Распределение центров адсорбции индикаторов на поверхности композитов и их отдельных фазах
Таблица 2
Результаты фотокаталитического генерирования водорода из гидразина и щавелевой кислоты в условиях системы фото-Фентона (mkt = 0,2 г; vр-ра = 20 мл)
|
№ образца |
Состав раствора |
WH2, % |
Скорость выделения Н2, мл/ч |
vH2, мкмоль/г•ч |
|
1 |
0,1 М N2H4 + 0,01 М H2O2 |
0,163 |
0,98 |
218 |
|
0,05 М Н2С2О4+ 0,01 М H2O2 |
0,220 |
1,30 |
295 |
|
|
3 |
0,1 М N2H4 + 0,01 М H2O2 |
0,307 |
1,84 |
411 |
|
0,05 М Н2С2О4+ 0,01 М H2O2 |
0,453 |
2,78 |
620 |
|
|
6 |
0,1 М N2H4 + 0,01 М H2O2 |
0,189 |
1,13 |
253 |
|
0,05 М Н2С2О4+ 0,01 М H2O2 |
0,324 |
1,94 |
433 |
Выводы
1. Методом СВС получены железосодержащие композиты на основе сиалона и нитрида кремния, проявляющие фотокаталитическую активность в процессах получения водорода из растворов щавелевой кислоты и гидразина.
2. Методом рентгеновской дифракции установлен фазовый состав композитов. Применение шунгита в качестве инертной добавки в шихту в количестве 10–15 % способствует полноте реакции азотирования ферросиликоалюминия и выходу нитрида кремния, сиалона и железа. Добавка шунгита приводит к уменьшению промежуточных продуктов – силицидов железа и образованию карбида кремния, обладающего полупроводниковыми свойствами.
3. Индикаторным методом Гаммета и Танабэ проведена идентификация и оценка количества активных центров композитов. Показано, что на поверхности преобладают кислотные центры Бренстеда и основные центры Льюиса.
4. Наибольшая производительность по выделению молекулярного водорода (620 мкмоль/ г×ч) достигнута при использовании раствора щавелевой кислоты в присутствии композита № 3, отличающегося лучшими адсорбционными свойствами.
Работа выполнена в рамках государственного задания ФАНО России (проект V.45.2.7, № АААА-А17-117070420015-6) при частичной поддержке РФФИ (проект № 16-03-00635 а.).



