В последнее десятилетие особое внимание уделяется вопросу синтеза различных биоцидных средств, резистентность микроорганизмов к которым будет развиваться ограниченно или отсутствовать полностью. Широкое применение в медицине находят продукты взаимодействия борной кислоты и органических оксисоединений. Синтез соединений бора с биоцидными свойствами, а также оптимизация процессов их получения, представляет не только практический, но научный интерес.
Для получения комплексного соединения на основе борной и лимонной кислот использовали реактивы: борная кислота «ХЧ», лимонная кислота безводная «ЧДА» ВР2009/E 330, дистиллированная вода. Синтез дилимонноборной кислоты (ДЛБК) проводили по следующей схеме: навески борной кислоты Н3ВО3 в количестве 0,05 моль (3,09 г) и 0,1 моль (21,03 г) лимонной кислоты растворяли при нагревании в 30 мл дистиллированной воды на водяной бане в температурном интервале примерно 50–60 °С. Систему постоянно перемешивали до полного растворения осадка. Раствор медленно охлаждали до комнатной температуры и оставляли для кристаллизации. Выпадение кристаллов наблюдали в течение 2 суток. Полностью сформированный кристаллический осадок отделяли фильтрованием на воронке Бюхнера, промывали и сушили в эксикаторе. Образование кристаллов дилимонноборной кислоты проходило согласно реакции в мольных соотношениях 1:2.
H3BO3 + 2C6H8O7 → Н[B(C6H6O7)2] + 3Н2О
ДЛБК – кристаллическое вещество белого цвета, устойчивое на воздухе, нерастворимо в неполярных растворителях (бензоле, толуоле) и хорошо растворимо в воде.
Спектры регистрировались на на ИК-Фурье-спектрометре FTIR-8400S «Shimadzu», при этом использовался частотный интервал в области 420–4000 см-1. Полученный ИК-спектр дилимонноборной кислоты (рис. 1) сравнивался с исходными спектрами борной и лимонной кислот для выявления характеристичных полос спектра.
Основной полосой поглощения, характеризующей валентные колебания связи В-О для бора с координационным числом, равным четырем, является полоса поглощения при 943 см-1. Данная полоса четко просматривается на спектре, что позволяет утверждать о наличии в комплексном соединении борокислородного тетраэдра. Имеются полосы поглощения в области 1700–1730 см-1, характерные для свободных карбоксильных групп карбоновых кислот. Полоса поглощения в интервале 1056–1092 см-1 соответствует ионизированной группе С–О, находящейся в координированном состоянии. Области 2550–3010 см-1 относятся к валентным колебаниям связанной группы О-Н, данные полосы спектра слабо выражены. В спектре присутствуют пики в области 510– 585 см-1, характерный для ковалентной связи С-С. Наличие нескольких полос поглощения в области 1355–1437 см-1 позволяют сделать вывод об имеющихся деформационных колебаниях в связи СН2. Дицитратоборатный анион в данных комплексных соединениях образован путем бидентатной координации атома бора двумя молекулами лимонной кислоты через атомы кислорода центральной карбоксильной и α-гидроксильной групп [1].
Термический анализ дилимонноборной кислоты проводили на синхронном термоанализаторе STA 449 F1 Jupiter. измерения исследуемых соединений проводились в диапазоне температур от 0 до 1000 °C в атмосфере аргона. На термогравиметрической кривой (ТГ) видно (рис. 2), что масса исследуемого образца не изменяется до 220 °С. Сохранение неизменности массы изучаемого комплексного соединения позволяет сделать вывод об отсутствии в его составе кристаллизационной воды. Известно, что поэтапное отщепление молекул кристаллизационной воды происходит до 200 °С [2]. Выше 230 °С начинается разложение самого лиганда, что на кривой ТГ отражается в виде резкого пика, характеризующего потерю массы до 43 %. Одновременно проводилось измерение количества теплоты в определенном временном интервале. На кривой ДСК наблюдается четко выраженный эндотермический минимум при 251,9 °С, характерный для реакции декарбоксилирования и деструкции основного компонента.
Выше 270 °С происходит горение оставшейся органической части лиганда. На кривой ДСК имеются экзотермические пики, характерные для протекания окислительных процессов в области температур от 400 °С до 1000 °С, данная термическая аномалия не воспроизводится при повторном нагреве образца, что доказывает необратимость фазового перехода. Образовавшаяся масса после сжигания образца составила 16,75 %. В качестве продуктов реакции образовались газообразные вещества: СО, СО2 , Н2О, в твердом остатке – B2О3.
Измерения удельной и молярной электропроводности водных растворов борной и лимонной кислот и их реакционной смеси – дилимонноборной кислоты проводили с помощью цифрового датчика электропроводности при трех температурах 25, 30 и 35 °С, в интервале концентраций 0,1–0,8 моль/л. При изменении температуры в интервале от 25 °С до 35 °С наблюдается увеличение удельной и молярной электропроводности ортоборной кислоты. Данное изменение можно объяснить увеличением подвижности ионов в результате снижения вязкостных характеристик раствора и ослаблением межионного взаимодействия [3] (рис. 3).
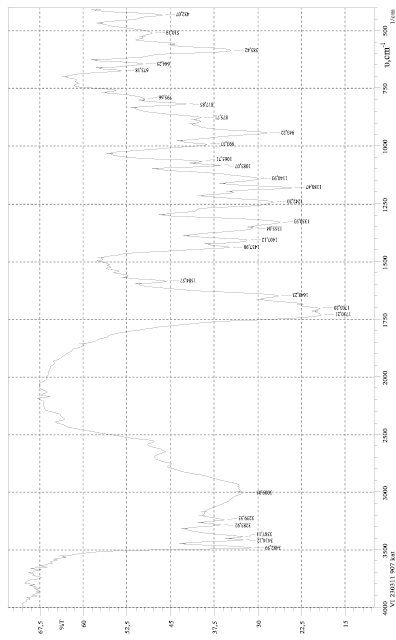
Рис. 1. ИК-спектр дилимонноборной кислоты
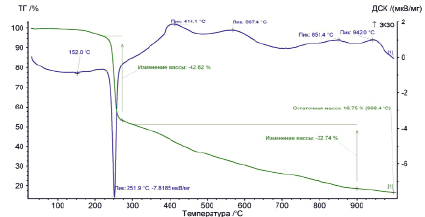
Рис. 2. Термограмма дилимонноборной кислоты
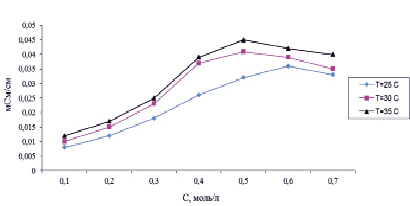
Рис. 3. Зависимость удельной электропроводности борной кислоты от концентрации
При изменении температуры от 25 до 35 °С подвижность ионов и степень диссоциации слабого электролита увеличиваются, что приводит к росту удельной (и молярной) электропроводности лимонной кислот. Лимонная кислота является более сильной, чем борная, и ее электрическая проводимость при одинаковых концентрациях растворов приблизительно на три порядка выше [4].
При измерении удельной электропроводности дилимонноборной кислоты готовили смеси Н3ВО3 и C6H8O7 с различной концентрацией кислот (рис. 4). Концентрации борной и лимонной кислот были равны соответственно: смесь 1 (CH3BO3 = 0,033 моль/л, CC6H8O7 = 0,067 моль/л); смесь 2 (CH3BO3 = 0,067 моль/л, CC6H8O7 = 0,134 моль/л); смесь 3 (CH3BO3 = 0,1 моль/л, CC6H8O7 = 0,2 моль/л).
Электропроводность смеси кислот значительно превышает суммарную электропроводность отдельных компонентов и резко увеличивается при повышении концентраций кислот в растворе. Данный результат свидетельствует об образовании в реакционной смеси сильной комплексной дилимонноборной кислоты, электропроводность которой значительно выше, чем у исходных компонентов. При повышении температуры в исследуемом интервале наблюдается рост удельной электропроводности, причем электропроводность смеси по-прежнему намного больше суммарной электропроводности реагентов.
Изучение процесса образования кристаллов дилимонноборной кислоты было выполнено с использованием поляризационного микроскопа фирмы ZEISS AXIO Scope A1 в проходящем свете в иммерсионных каплях диаметром до 10 мм. Фотографирование производилось на этом же микроскопе по программе Axio Vision Rel 4.8. Рост кристаллов наблюдали в отраженном свете с использованием светлого и темного поля, а также поляризации. Фотографии получены при использовании режимов съемки: николи скрещены и николи параллельны, что позволяет сделать выводы об изотропности или анизотропности формирующихся кристаллов [4].
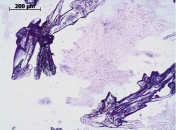
На рис. 5 представлен начальный период кристаллизации комплексной соли дилимонноборной кислоты. Режим съемки – николи параллельны показывает, что кристаллы лимонной кислоты имеют вид перьевых агрегатов, а у борной кислоты – псевдогексагональных чешуек. Так же отчетливо просматривается наличие поликристаллического агрегата, состоящего из мелких кристалликов ДЛБК. Просвечивание кристалла в скрещенных николях позволяет отличить кристаллиты дилимонноборной кислоты, которые имеют выраженную кристаллографическую ориентацию зерен и являются анизотропными.
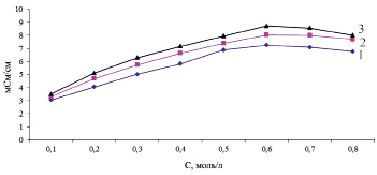
Рис. 4. Зависимость удельной электропроводности дилимонноборной кислоты от концентрации: 1 смесь, 2 смесь и 3 смесь

а) б)
Рис. 5. Кристаллы борной и лимонной и поликристаллиты дилимонноборной кислоты: а) режим съемки николи параллельны; б) режим съемки николи скрещены (12 часов с момента начала кристаллизации)
а) б)
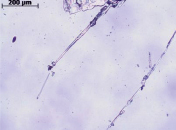
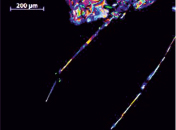
Рис. 6. Анизотропные кристаллы дилимонноборной кислоты: а) режим съемки – николи параллельны; б) режим съемки николи скрещены (через 36 часов с момента начала кристаллизации)
Минимальная подавляющая концентрация комплексных соединений бора на некоторые культуры микроорганизмов
|
№ п/п |
Название культуры микроорганизма |
МПК (мкг/мл) |
|||
|
ДЛБК |
ДГБМ |
ДЦБГ |
ДЦБО |
||
|
1 |
Кишечная палочка (АТСС 25922) |
0,2100 |
0,200 |
0,300 |
250 |
|
2 |
Золотистый стафилококк (25923) |
0,0018 |
0,002 |
0,030 |
250 |
|
3 |
Дрожжеподобные грибы рода Кандида |
0,0038 |
0,200 |
0,003 |
– |
Изменение режима съемки на николи скрещены позволит определить анизотропность кристаллов лимонной и дилимонноборной кислот. Кристаллы борной кислоты симметричны [5], следовательно, являются изотропными и при режиме съемки николи скрещены не видны. Форма кристаллов дилимонноборной кислоты существенно отличается от исходных компонентов и имеет вид тонких игольчатых кристаллов (рис. 6).
Дилимонноборная кислота относится к комплексным соединениям бора, использование которых в качестве антимикробных и противогрибковых средств изучалось ранее [6]. Бактериологическое исследование на антимикробную активность и минимальную подавляющую концентрацию дилимонноборной кислоты проводилось на базе лаборатории ГБОУ ВО ЧГМА Минздравсоцразвития России. В частности, изучалось воздействие комплексного соединения на культуры Candida albicans (дрожжеподобные грибы рода Кандида), Escherichia coli (кишечной палочки) и Staphylococcus aureus (золотистый стафилококк). Результаты исследования сравнивали с имеющимися данными ранее синтезированных соединений: ДЦБГ – дицитратоборатом гуанидиния; ДГБМ – диглициноборатом меди (II) и ДЦБО – дицитратоборатом оксихинолиния [7]. Результаты исследования показаны в таблице.
ДЛБК проявляет избирательную активность в отношении патогенных микроорганизмов, Staphylococcus aureus (золотистого стафилококка) и дрожжеподобных грибов рода Кандида. ДЦБО не оказывает никакого влияния на дрожжеподобные грибы рода Кандида. Дилимонноборная кислота обладает широким спектром применения, является экологически безопасным веществом, на ее основе могут быть синтезированы новые комплексные соединения.
Анализируя результаты проведенных исследований, можно сделать следующие выводы:
1) Изучены свойства и строение дилимонноборной кислоты методами термического анализа, ИК-спектроскопии и кондуктометрии. Получены результаты измерений удельной и молярной электропроводности в зависимости от температуры и концентрации исходных компонентов. Доказано, что дицитратоборатный анион образован путем бидентатной координации атома бора двумя молекулами лимонной кислоты через атомы кислорода центральной карбоксильной и α-гидроксильной групп; определен температурный интервал устойчивости лиганда.
2) Методом поляризационной электронной микроскопии исследованы кристаллы борной, лимонной и ДЛБК в режимах: николи скрещены и николи параллельны. Определено наличие анизотропных характеристик кристаллических структур лимонной и дилимонноборной кислот и изотропных свойств кристаллов борной кислоты.
3) Отсутствие в составе дилимонноборной кислоты агрессивных компонентов делает возможным применение ее как биоцидного препарата, обладающего избирательной активностью в отношении Staphylococcus aureus (золотистый стафилококк) и дрожжеподобных грибов рода Кандида.



