В современном мире одной из наиболее важных проблем является загрязнение объектов окружающей среды – воздуха, воды, земли, продуктов питания и, как следствие, организма человека. Одним из наиболее актуальных направлений является разработка быстрых, достоверных и точных методов определения загрязняющих веществ [1].
Пестициды, содержащиеся в воде и продуктах питания, являются очень опасными для человека химическими веществами. В настоящее время пестициды интенсивно используются в сельском и лесном хозяйстве для защиты растений от различных вредителей и болезней, удаления сорняков, сохранения запаса зерна, защиты животных от различных экопаразитов. Благодаря постоянной циркуляции пестицидов в окружающей среде они присутствуют во всех объектах живой и неживой природы [2].
Современное сельское хозяйство заинтересовано в разработке пестицидных препаратов, характеризующихся рядом особенностей: высокой активностью при низких нормах расхода (г/га), низкой опасностью для теплокровных животных и полезной фауны и флоры. Анализируя последние тенденции, можно утверждать, что в перспективе основными пестицидами, применяемыми в сельскохозяйственном производстве, будут препараты с нормами расхода от 5 до 200 г/га. Прежде всего это пестициды, базирующиеся на новых механизмах действия. Одним из важных, определяющих требований к современным пестицидам является их слабая подвижность в окружающей среде, быстрая разрушаемость в течение одного вегетационного периода (менее 90–150 суток) до нетоксичных остатков, а также безопасность для нецелевых объектов, связанная с высокой селективной токсичностью, что позволяет рассчитывать на снижение химической нагрузки на окружающую среду [3].
С целью оперативного количественного и качественного анализа попадающих в окружающую среду пестицидов используются аналитические методы, основанные на применении современной приборной базы, обладающие высокой разделяющей способностью, необходимой при анализе многокомпонентных образцов или смесей, и высокой чувствительностью, позволяющей определять пестициды на уровне концентраций 1 мкг/л и ниже. К таким методам относятся: капиллярная газовая хроматография, высокоэффективная жидкостная хроматография, тонкослойная хроматография и капиллярный электрофорез [4].
Учитывая большое разнообразие пестицидов, относящихся к различным химическим классам веществ, становится актуальной задача разработки универсальных методов их количественного и качественного определения. Подходы, основанные на узкоселективных методах, направленных на выявление одного вещества или класса веществ, сегодня становятся невыгодными ни по временным затратам, ни по расходам на эксплуатацию, перекалибровку и перенастройку аналитических приборов [5].
Целью данного исследования является разработка способа одновременного определения пестицидов различных химических классов в природной воде методом высокоэффективной жидкостной хроматографии.
Материалы и методы исследования
В разработке методики использовали следующие аналитические стандарты пестицидов (содержание основного вещества >99 %): имазапир (имп., «Cyanamid», США), имидаклоприд (имп., «Sigma-Aldrich», США), имазетапир (имп., «Bayer CropScience», Германия), ципросульфамид (имп., «Dr. Ehreustorfer GmbH», Германия), метрибузин (имп., «Bayer CropScience», Германия), фенмедифам (имп., «Aventis Cropscience Gmbh», Германия), флумиоксазин (имп., «Sumitomo Chemical CO. LTD, OSAKA», Япония), хизалофоп-П-этил («Агроэксперт Груп», Россия), этофумезат (имп., «Bayer СropScience», Германия), ипродион (имп., «Bayer CropScience», Германия), флуфенацет (имп., «Aventis Cropscience Gmbh», Германия), флубендиамид (имп., «Bayer CropScience», Германия), фамоксадон (имп., «E.I. du Pont de Nemours and Company», Швейцария), пенцикурон (имп., «Bayer CropScience», Германия), дифлуфеникан (имп., «Aventis Cropscience Gmbh», Германия). Для приготовления индивидуальных растворов стандартных веществ брали навеску действующего вещества пестицидов и растворяли в определенном объеме ацетонитрила. Стандартные растворы пестицидов с концентрацией 1 мг/мл хранили в холодильнике в течение трех месяцев в герметичных сосудах. Методом последовательного разведения ацетонитрилом непосредственно перед исследованиями готовили рабочие растворы смеси пестицидов, которые использовали для хроматографического исследования и внесения в контрольные образцы.
Для извлечения действующих веществ пестицидов из проб воды в эксперименте использовали следующие реактивы, материалы и растворы: ацетонитрил для ВЭЖХ, «В-230НМ» или «х.ч.» (ТУ 6-09-3534-87), вода бидистиллированная, деионизированная (ГОСТ 6709-79), кислота ортофосфорная («х.ч.», ГОСТ 6552-80), дихлорметан («х.ч.», ТУ 6-09-3716-80), натрия хлорид («х.ч.», ГОСТ 4233-77), дихлорметан («х.ч.», ТУ 6-09-3716-80), н-гексан («х.ч.», ТУ 6-09-3375-78), натрий сернокислый безводный, свежепрокаленный («ч.», ГОСТ 4166-76), фильтры бумажные, «красная лента» (ТУ-6-09-1678-86).
Экстракты, полученные на этапе пробоподготовки, хроматографировались на жидкостном хроматографе фирмы «Applied Biosystems» (США), оснащенном ультрафиолетовым детектором, дегазатором и термостатом колонки. Хроматографическая колонка – 4,6×150 мм Symmetry С-18, 5 мкм (Waters); предколонка Waters Symmetry С-18. В работе использовали ротационный испаритель RV 8 V (IKA), ультразвуковую ванну VBS–4DD, воронки делительные, цилиндры, воронки лабораторные, колбы и пипетки мерные. Обработку данных производили с помощью программного комплекса для обработки хроматографических данных – «МультиХром», Версия 1,5.
Результаты исследования и их обсуждение
В качестве методов разделения и концентрирования, используемых при определении пестицидов, широко применяются экстракционные методы, особенно жидкостно-жидкостная экстракция при помощи делительной воронки. На эффективность проведения экстракции оказывают влияние многие факторы, оптимизацию которых проводили с использованием природной воды в качестве матрицы. В матрицу вносили смесь растворов стандартных образцов 15-ти действующих веществ пестицидов различных химических классов. Данные вещества входят в ассортимент пестицидных препаратов, широко используемых на территории Ростовской области и Краснодарского края. Краткая характеристика исследуемых соединений представлена в табл. 1.
При выборе экстрагента учитывали физико-химические свойства определяемых действующих веществ пестицидов (гидрофобность и растворимость в воде). В качестве растворителя для извлечения пестицидов из образцов воды были исследованы возможности гексана и дихлорметана, в которых исследуемые вещества имеют наибольшую растворимость, чем в других органических растворителях. Для выяснения влияния ионной силы раствора на степень извлечения полярных пестицидов проводили эксперимент с добавлением к анализируемой пробе насыщенного раствора хлорида натрия.
В ходе эксперимента по извлечению остаточных количеств пестицидов в природной воде выполняли пробоподготовку следующих образцов:
– образец 1 – экстракцию действующих веществ пестицидов из матрицы проводили тремя порциями гексана;
– образец 2 – экстракцию действующих веществ пестицидов из матрицы проводили тремя порциями дихлорметана;
– образец 3 – экстракцию действующих веществ пестицидов из матрицы проводили тремя порциями дихлорметана с добавлением насыщенного раствора хлорида натрия;
– образец 4 – экстракцию действующих веществ пестицидов из матрицы проводили тремя порциями гексана с добавлением насыщенного раствора хлорида натрия.
Экстракцию проводили с использованием различных объемов экстрагента. Оценивали зависимость степени извлечения пестицидов от количества добавляемого экстрагента (от 10 мл до 100 мл). Для большинства определяемых действующих веществ пестицидов степень извлечения была максимальна при трехступенчатой экстракции с использованием 100, 60 и 40 мл дихлорметана (рис. 1).
С целью увеличения скорости массообмена между раствором и экстрагентом применяли ультразвуковую обработку проб. При использовании обработки дисперсной системы ультразвуком степень извлечения исследуемых веществ выше, чем при обычном механическом встряхивании. Тестирование в разных режимах показало, что оптимальная продолжительность обработки проб ультразвуком должна составлять 10 мин, при этом средняя степень извлечения пестицидов была выше 50 %.
Таблица 1
Краткая характеристика исследуемых действующих веществ пестицидов
|
Пестицид |
Химический класс |
Химическая формула |
Направленность действия |
ПДК, мкг/л |
|
Имазапир |
Имидазолиноны |
C13H15N3O3 |
Гербицид |
1 |
|
Имидаклоприд |
Неоникотиноиды |
C9H10ClN5O2 |
Гербицид |
400 |
|
Имазетапир |
Имидазолиноны |
C15H19N3O3 |
Гербицид |
1000 |
|
Ципросульфамид |
Производные метоксибензамида |
C18H18N2O5S |
Гербицид |
10 |
|
Метрибузин |
Производные триазинов |
C8H14N4OS |
Гербицид |
500 |
|
Фенмедифам |
Карбаматы |
C16H16N2O4 |
Гербицид |
50 |
|
Флумиоксазин |
n–фенилфталимиды |
C19H15FN2O4 |
Гербицид |
40 |
|
Хизалофоп-П-этил |
Производные арилоксифеноксипропионовых кислот |
C19H17ClN2O4 |
Фунгицид |
4 |
|
Этофумезат |
Бензофураны |
C13H18O5S |
Гербицид |
7 |
|
Ипродион |
Имидазолы |
C13H13Cl2N3O3 |
Фунгицид |
125 |
|
Флуфенацет |
Оксиацетамиды |
C14H13F4N3O2S |
Гербицид |
20 |
|
Флубендиамид |
Диамиды фталевой кислоты |
C23H22F7IN2O4S |
Инсектицид |
18 |
|
Фамоксадон |
Стробилурины |
C22H18N2O4 |
Фунгицид |
7 |
|
Пенцикурон |
Производные мочевины |
C19H21ClN2O |
Фунгицид |
10 |
|
Дифлуфеникан |
Феноксиникотинанилиды |
C19H11F5N2O2 |
Гербицид |
100 |
Экстракцию каждого образца проводили в пяти повторностях. С целью исключения ошибок, вносимых используемыми реактивами, для каждой серии проб проводили холостое определение (выполняли все процедуры методики, но без матрицы). В качестве контроля для каждой серии проб выполняли экстракцию теми же растворителями, что и для образца, но без добавления смеси пестицидов.
Полученные экстракты анализировали на жидкостном хроматографе. Условия хроматографирования были следующими: подвижная фаза: ацетонитрил – 0,01 М ортофосфорная кислота в соотношении 3:2 (по объему) в изократическом режиме, скорость потока 0,5 мл/мин, термостатирование – +40 °С. Рабочая длина волны – 230 нм, объем вводимого экстракта пробы в хроматограф – 10 мкл. Продолжительность анализа – 35 мин. Идентификация веществ проводилась по времени удерживания, а количественное определение – методом абсолютной калибровки. На рис. 1 представлена оптимальная схема извлечения действующих веществ пестицидов, которая была разработана по результатам проведенного эксперимента.
На рис. 2 представлена хроматограмма смеси стандартных образцов исследуемых действующих веществ пестицидов. Хроматограмма пробы воды с добавлением растворов смеси стандартных образцов пестицидов представлена на рис. 3.
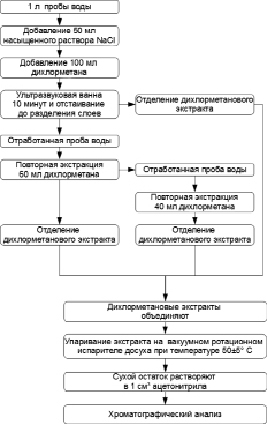
Рис. 1. Схема экстракции пестицидов из природной воды
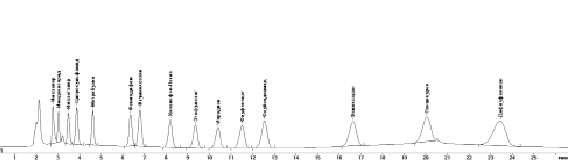
Рис. 2. Хроматограмма смеси стандартных образцов пестицидов: 1 – имазапир, 2 – имидаклоприд, 3 – имазетапир, 4 – ципросульфамид, 5 – метрибузин, 6 – фенмедифам, 7 – флумиоксазин, 8 – хизалофоп-П-этил, 9 – этофумезат, 10 – ипродион, 11 – флуфенацет, 12 – флубендиамид, 13 – фамоксадон, 14 – пенцикурон, 15 – дифлуфеникан
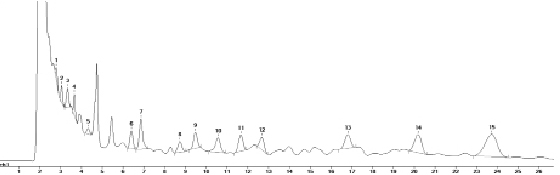
Рис. 3. Хроматограмма пробы воды с добавлением смеси стандартных образцов пестицидов: 1 – имазапир, 2 – имидаклоприд, 3 – имазетапир, 4 – ципросульфамид, 5 – метрибузин, 6 – фенмедифам, 7 – флумиоксазин, 8 – хизалофоп-П-этил, 9 – этофумезат, 10 – ипродион, 11 – флуфенацет, 12 – флубендиамид, 13 – фамоксадон, 14 – пенцикурон, 15 – дифлуфеникан
Таблица 2
Результаты определения пестицидов в водных образцах (n = 5, P ≥ 0,95)
|
Действующее вещество |
1образец |
2 образец |
3 образец |
4 образец |
||||
|
R, % |
Sr |
R, % |
Sr |
R, % |
Sr |
R, % |
Sr |
|
|
Имазапир |
10 |
0,06 |
30 |
0,02 |
55 |
0,02 |
15 |
0,03 |
|
Имидаклоприд |
33 |
0,01 |
49 |
0,01 |
66 |
0,01 |
32 |
0,02 |
|
Имазетапир |
12 |
0,04 |
37 |
0,01 |
50 |
0,01 |
16 |
0,02 |
|
Ципросульфамид |
15 |
0,04 |
22 |
0,02 |
69 |
0,02 |
17 |
0,03 |
|
Метрибузин |
21 |
0,05 |
27 |
0,02 |
71 |
0,02 |
25 |
0,02 |
|
Фенмедифам |
16 |
0,03 |
20 |
0,01 |
61 |
0,01 |
18 |
0,01 |
|
Флумиоксазин |
24 |
0,04 |
27 |
0,04 |
71 |
0,04 |
26 |
0,02 |
|
Хизалофоп-П-этил |
15 |
0,02 |
17 |
0,03 |
65 |
0,03 |
17 |
0,03 |
|
Этофумезат |
19 |
0,01 |
21 |
0,01 |
54 |
0,01 |
22 |
0,02 |
|
Ипродион |
25 |
0,02 |
27 |
0,01 |
59 |
0,01 |
27 |
0,01 |
|
Флуфенацет |
22 |
0,01 |
23 |
0,01 |
68 |
0,01 |
23 |
0,02 |
|
Флубендиамид |
28 |
0,01 |
43 |
0,01 |
60 |
0,01 |
30 |
0,02 |
|
Фамоксадон |
31 |
0,01 |
35 |
0,03 |
62 |
0,03 |
32 |
0,02 |
|
Пенцикурон |
27 |
0,01 |
37 |
0,01 |
55 |
0,01 |
29 |
0,01 |
|
Дифлуфеникан |
26 |
0,01 |
39 |
0,01 |
55 |
0,01 |
27 |
0,01 |
Примечание. Sr – относительное стандартное отклонение, R – степень извлечения.
Для оценки эффективности процесса пробоподготовки рассчитывали степень извлечения (R) и относительное стандартное отклонение (Sr) действующих веществ пестицидов из образцов. Результаты определений действующих веществ пестицидов в воде представлены в табл. 2.
По результатам проведенных исследований наибольшая степень извлечения исследуемых веществ по всем концентрациям достигалась при экстрагировании проб воды тремя порциями дихлорметана с добавлением насыщенного раствора хлорида натрия при предварительной обработке в ультразвуковой ванне. Значение степени извлечения составило от 50 % до 71 %. Относительное стандартное отклонение не превышало 0,06. При использовании разработанного способа экстракции пестицидов, согласно полученным аналитическим характеристикам методики, пределы определения исследуемых веществ варьируют от 0,02 до 10 мкг/мл. Графики для каждого действующего вещества пестицидов описывают линейную зависимость с коэффициентами корреляции R2 ≥ 0,9978.
Заключение
В результате проведенных исследований разработана оптимальная методика извлечения и хроматографического определения действующих веществ пестицидов различных химических классов при их одновременном присутствии в природной воде. Согласно полученным аналитическим характеристикам данная методика может быть использована для экологического мониторинга природных вод.



