Загрязнение окружающей среды тяжелыми металлами в результате деятельности различных промышленных предприятий является актуальной проблемой, требующей разработки экологически безопасных и дешевых сорбционных материалов для детоксикации загрязненных объектов.
Среди неорганических материалов, используемых для извлечения ионов тяжелых металлов, в том числе цинка, особую группу представляют природные и синтетические силикаты [1–3].
Авторы [4–6] рассматривают силикаты и гидросиликаты кальция определенного состава и структуры как соединения, которые могут использоваться при очистке водных растворов от ионов Zn2+.
Цель исследования – изучение сорбционных свойств материала на основе гидросиликата кальция (далее – силикатного сорбента), полученного из техногенных отходов производства борной кислоты (борогипса), по отношению к ионам Zn2+.
Материалы и методы исследования
Для получения сорбента использовали отходы производства борной кислоты – борогипс с удельной поверхностью 12,9 м2·г-1 и содержанием основных компонентов, масс. %: SiO2 – 32,2 %; CaO – 28,4; SO3 – 31,3 %; Fe2O3 – 2,7 %. Дигидрат сульфата кальция и аморфный кремнезём являются основными компонентами вышеуказанных отходов. Борогипс смешивали с раствором гидроксида калия квалификации «ч.д.а» в стехиометрическом соотношении. Полученную смесь подвергали автоклавной обработке при давлении 1,7·105 Па в течение 3 ч. После окончания заданного интервала времени полученную смесь извлекали из автоклава, промывали осадок дистиллированной водой, нагретой до 60–70 °С, отделяли от раствора фильтрованием и сушили при температуре 85 °С. Выход целевого продукта контролировали по количеству гидроксида калия, прореагировавшего в результате реакции [7].
Исследования по сорбции ионов Zn2+ проводили при соотношении твердой и жидкой фаз, равном 1:40, в статических условиях при 20 °С из водных растворов ZnСl2 в течение 3 ч. Предварительно готовили серию растворов хлорида цинка с начальными концентрациями в диапазоне от 1,6 до 79,7 ммоль·л-1. Также параллельно проводили опыты с борогипсом (состав указан выше), из которого был получен силикатный сорбент, и с карбонатом кальция (квалификации «х.ч.»), присутствующем в виде примеси в исходном сырье и силикатном сорбенте.
Кинетику сорбции исследовали при условиях, аналогичных вышеуказанным, во временных интервалах – от 1 до 120 мин. Начальная концентрация ионов Zn2+ составляла 16,0 ммоль·л-1. Через определенные промежутки времени растворы отделяли от сорбента фильтрованием и определяли в них концентрацию ионов Zn2+.
Сорбционную емкость (Ас, ммоль·г-1) силикатного сорбента рассчитывали по формуле
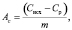 (1)
(1)
где Сисх – исходная концентрация ионов Zn2+ в растворе, ммоль·л-1; Ср – равновесная концентрация ионов Zn2+ в растворе, ммоль·л-1; V – объем раствора, л; m – масса сорбента, г.
Степень извлечения ионов Zn2+ (α, %) рассчитывали по формуле
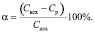 (2)
(2)
Рентгеновские дифрактограммы записывали на дифрактометре Bruker D8 Advance (Германия) в Сu Кα-излучении.
Удельную поверхность (Sуд) определяли по адсорбции азота на приборе «Сорбтометр-М».
Содержание ионов Zn2+ и Ca2+ в растворах определяли методом атомно-абсорбционной спектрометрии на двулучевом спектрометре Solaar M6 (Thermo Scientific, США) по аналитическим линиям 213,9 и 422,6 нм соответственно. Предел обнаружения ионов цинка в водных растворах составляет 0,001 мкг·мл-1, кальция – 0,0005 мкг·мл-1. Относительная ошибка определения ионов цинка методом ААС составляет 15 %, кальция – 10 %.
Элементный анализ выполняли методом энергодисперсионной рентгенофлуоресцентной спектроскопии на спектрометре Shimadzu EDX 800 HS (Япония).
Результаты исследования и их обсуждение
Результаты РФА показали, что синтезированный образец состоит из аморфной фазы, а также содержит кристаллическую фазу карбоната кальция. В результате обжига образца происходит переход аморфных гидросиликатов кальция в кристаллическую фазу волластонита CaSiO3 триклинной модификации, о чем свидетельствуют данные РФА образца после обжига при 900 °С. Удельная поверхность исследуемого материала варьировала от 30,8 до 80,0 м2·г-1.
На рис. 1 приведена зависимость величины сорбционной емкости силикатного сорбента из борогипса от исходной концентраций ионов Zn2+. Для эффективных сорбентов, имеющих высокие значения степени извлечения ионов из растворов, т.е. когда исходные концентрации ионов (Cисх) значительно выше равновесных концентраций (Cр), нецелесообразно построение изотермы сорбции в виде зависимости величины сорбции (Ас) от равновесной концентрации (Cр), так как теряется наглядность того, при каких значениях исходных концентраций мы имеем соответствующие величины сорбции.
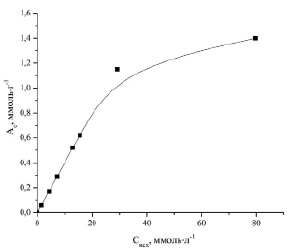
Рис. 1. Зависимость сорбционной емкости (Ас) от исходной концентрации (Сисх) ионов Zn2+ в растворе
Для оценки сорбционных свойств силикатного сорбента полученные экспериментальные данные анализировали в соответствующих координатах уравнения Ленгмюра:
Ср/Aс = (1/Amaxk) + Ср/Amax,
где Ср – равновесная концентрация ионов Zn2+ в растворе, Am – максимальная сорбционная емкость, k – константа Ленгмюра.
Найденные параметры уравнения Ленгмюра: k = 59,03 л·ммоль-1, Am = 1,4 ммоль·г-1.
На рис. 2 приведена кинетическая кривая сорбции ионов Zn2+ силикатным сорбентом.
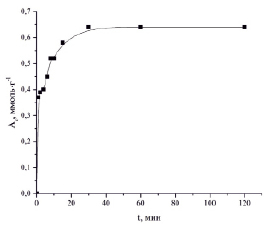
Рис. 2. Кинетическая кривая сорбции ионов Zn2+ силикатным сорбентом
Как видно из приведенной кинетической кривой, процесс сорбции ионов Zn2+ протекает достаточно интенсивно, и время достижения равновесия составляет 30 мин (степень извлечения ионов Zn2+ составляет 99,1 %).
Исследование механизма сорбции ионов Zn2+ силикатным сорбентом проводили посредством расчета значений свободной энергии Гиббса (ΔG °х.р) для соответствующих химических реакций хлорида цинка с компонентами сорбента. Ранее установлено, что получаемые в автоклавных условиях силикатные сорбенты представляют собой многокомпонентную систему, и при исследовании механизма сорбции необходимо учитывать возможность взаимодействия солей металлов с гидросиликатом кальция, CaCO3, SiO2 и CaSO4·2H2O. С этой целью проведен расчет значений свободной энергии Гиббса для соответствующих химических реакций. Для расчета использовали данные, приведенные в [8, 9]. Согласно рассчитанным значениям ΔG °х.р, термодинамически возможными являются следующие реакции:
ZnCl2+CaSiO3 > ZnSiO3 + + CaCl2 (–291,4 кДж· моль-1);
ZnCl2+CaCO3 > ZnCO3 + + CaCl2 (–249,6 кДж· моль-1).
Проведенные термодинамические расчеты подтверждают исследования, проведенные с привлечением современных физико-химических методов анализа фильтратов и твердых осадков после сорбции, а также борогипса и компонентов, входящих в состав сорбента.
В контрольном опыте непосредственно борогипс характеризовался незначительной величиной сорбционной емкости по сравнению с полученным из него силикатным сорбентом (до 0,18 ммоль·г-1), что обусловлено наличием микропримесей в исходном сырье. Результаты контрольного опыта с карбонатом кальция CaCO3 показали, что сорбционная емкость карбоната кальция также существенно ниже по сравнению с исследуемым силикатным сорбентом.
Данные атомно-абсорбционной спектрометрии показали, что с увеличением исходной концентрации ионов Zn2+ в растворах увеличивается и концентрация ионов Ca2+ в фильтратах после сорбции, что свидетельствует о замещении ионов Ca2+ на ионы Zn2+ в компонентах силикатного сорбента. Данные, полученные методом атомно-абсорбционной спектрометрии, коррелируют с результатами анализа элементного состава твердых осадков после сорбции, выполненного с помощью энергодисперсионного рентгенофлуоресцентного метода (рис. 3).
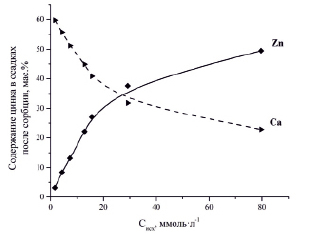
Рис. 3. Зависимости содержания цинка и кальция в осадках после сорбции от исходной концентрации ионов Zn2+ в растворе [10]
Из представленного рисунка видно, что с увеличением исходной концентрации ионов Zn2+ в растворе в осадках после сорбции уменьшается содержание кальция и увеличивается содержание цинка.
Представленные результаты свидетельствуют о том, что основным механизмом сорбции во всех рассматриваемых случаях является катионный обмен ионов Ca2+ на ионы Zn2+ в соединениях, присутствующих в составе силикатного сорбента.
Заключение
Исследован процесс извлечения ионов цинка из водных растворов силикатным сорбентом, полученным из отходов производства борной кислоты. Найдено, что максимальная сорбционная емкость силикатного сорбента составляет 1,4 ммоль·г-1. Показано, что процесс сорбции ионов Zn2+ протекает достаточно интенсивно, и время достижения равновесия составляет 30 мин. Установлено, что термодинамически возможными являются реакция взаимодействия хлорида цинка с силикатом кальция (ΔG °х.р = –291,4 кДж· моль-1) и реакция взаимодействия хлорида цинка с карбонатом кальция (ΔG °х.р = –249,6 кДж· моль-1). Установлено, что с увеличением исходной концентрации ионов Zn2+ в растворах, увеличивается и концентрация ионов Ca2+ в фильтратах после сорбции. Результаты, полученные методом атомно-абсорбционной спектрометрии, коррелируют с результатами анализа элементного состава твердых осадков после сорбции, выполненного с помощью энергодисперсионного рентгенофлуоресцентного метода. Указанные физико-химические методы анализа фильтратов и твердых осадков после сорбции показали, что основным механизмом сорбции во всех рассматриваемых случаях является катионный обмен ионов Ca2+ на ионы Zn2+ в соединениях, присутствующих в составе силикатного сорбента. Таким образом, силикатный сорбент, полученный из отходов борного производства, может использоваться в процессах извлечения ионов Zn2+ из водных растворов.
Работа выполнена при финансовой поддержке проекта 4.5913.2017/8.9 (Министерство образования и науки Российской Федерации) и при поддержке проекта № 18-3-024 комплексной программы фундаментальных научных исследований Дальневосточного отделения РАН «Дальний Восток» на 2018–2020 гг.



