Специфика переработки продуктов животноводства заключается в том, что в процессе получения основной товарной продукции до половины исходного сырья на различных стадиях технологического процесса превращается в отходы. Это касается, в частности, белоксодержащих отходов птицеводства и шерстеперерабатывающих производств.
В крупных животноводческих хозяйствах белоксодержащие отходы могут, в определенной степени, представлять угрозу экологическому состоянию – медленно разлагаясь и выделяя загрязняющие, в том числе токсичные вещества в окружающую среду [1]. Так, накапливающиеся в анаэробных условиях в почве продукты разложения белков (диамины) проявляют ярко выраженные фитотоксичные свойства и нередко способствуют угнетению роста растений [2, 3].
Кератин, являясь животным белком, состоит из α-аминокислот, из которых порядка 30 % относятся к группе незаменимых для животного организма. Природные кератины очень богаты кислыми и основными аминокислотами. Эти белки отличаются также необычно высоким содержанием остатков цистеина – аминокислоты, содержащей тиольную группу (SH). Во многом по этой причине кератин характеризуется особыми физико-химическими свойствами. В частности, кератин отличается высокой устойчивостью к воздействию различных реагентов: в воде, растворах нейтральных солей и в разбавленных растворах кислот и щелочей кератин нерастворим. Он не подвергается гидролизу под действием ферментов, кроме фермента кератиназы. Наличие в составе этого белка большого числа тиольных групп обуславливает значительную роль дисульфидных ковалентных связей, формирующих и поддерживающих нативную структуру полипептида.
Устойчивость кератина к химическим реагентам, внешним воздействиям, ферментам пищеварительных соков животных обусловлена главным образом именно наличием в структуре его дисульфидной (цистиновой) связи. По этой причине большинство животных организмов усваивать этот белок в нативном состоянии не может [4].
Очевидно, чтобы перевести кератин в усваиваемое (водорастворимое) состояние, необходимо разрушить третичную структуру белка.
Процесс денатурации способствует разворачиванию укладки цепей полипептида. В ходе этого процесса утрачиваются свойства, характерные для нативного кератина. При денатурации становятся доступны функциональные группы, ранее находящиеся в положении скрытых в нативном состоянии молекул. Следовательно, для того, чтобы получить водорастворимый кератин, следует оказывать воздействия, вызывающие процесс денатурации. Это может быть изменение суммарного заряда полипептида за счет варьирования рН и частичный разрыв ковалентных дисульфидных связей. В результате изменения рН молекула белка кератина как полиамфолит меняет свою структуру и свойства, увеличивается способность к гидратации, набуханию и растворению в воде. Разрушение дисульфидных связей, формирующих третичную структуру белка, приводит к её нарушению, что выражается в разрыхлении структуры пера, снижению его прочности, что облегчает проникновение молекул воды внутрь структуры и сопровождается его более эффективным набуханием.
Одной из главных характеристик химической активности тиолов и их производных (сульфидов) является их способность к окислительно-восстановительным превращениям. Так, при действии на дисульфиды восстановителей (сульфидов, бисульфитов, гидросульфитов и др.) дисульфидные связи разрываются с последующим присоединением по месту освободившихся валентностей различных групп в зависимости от применяемого реагента. В биохимических реакциях роль восстанавливающего реагента играет фермент кератиназа, наличие которого дает возможность некоторым организмам усваивать кератин (Tineola bisselliella). При окислении тиолы превращаются в сульфоновые кислоты, образующие в щелочной среде соответствующие соли, тем самым нейтрализуя конечный раствор.
В литературных источниках описаны различные методы получения гидролизатов из кератинсодержащего сырья: гидротермический, щелочной, кислотный, ферментативный [5]. Известные методы по переработке кератинсодержащего сырья основаны на разрыве связей, образующих четвертичную, третичную, вторичную и первичную структуры. В последнем случае деструкция кератина идет до свободных аминокислот. Как показывает анализ доступной научно-технической информации, в основном используют комбинацию физических и химических воздействий на кератинсодержащее сырьё для извлечения белка. Чтобы получить растворимый белок из нерастворимого полипептида, необходимо подобрать условия и реагенты, которые позволили бы разрушить четвертичную, третичную, вторичную структуры. В числе факторов, которые изменяют четвертичную структуру перьевого кератина, – изменение рН, повышение температуры, действие детергентов и т.д. К разрушению третичной и вторичной структуры без разрыва пептидных связей (денатурации) могут привести: нагревание растворов белка выше 60 °С, изменение рН (<3–4 или >10), ультразвук, органические растворители, соли тяжелых металлов, детергенты и т.д. И как результат – изменяются кристаллическая структура, растворимость и др. [5, 6].
При гидролизе в качестве реагентов используют 0,25–10 % растворы гидроксида натрия, 13 % раствор гидроксида калия или 25 % раствор аммиака, растворы минеральных и органических кислот. Гидролиз, как правило, осуществляют при нагревании до 95 °С в течение длительного времени (до 5 и более часов) [7].
Основными недостатками гидролиза при высоких температурах являются значительная деструкция как самого белка, так и отдельных аминокислот, входящих в его состав. Длительность процесса и жесткие условия приводят к разрушению аминокислот и их частичной рацемизации [7].
Так, некоторые авторы [8] указывают, что при использовании жестких температурных режимов сильно возрастает потеря серосодержащих аминокислот (цистеина).
Материалы и методы исследования
Щелочной гидролиз. 10 г пера промывали тёплым мыльным раствором, несколько раз ополаскивали дистиллированой водой, помещали в колбу и добавляли 100 мл 10 % раствора NaOH. Отбирали пробы через 24, 48, 72, 144, 168 часов. Определяли концентрацию белка.
Гидролиз в присутствии восстановителя. 10 г пера промывали тёплым мыльным раствором, несколько раз ополаскивали дистиллированной водой, помещали в колбу и добавляли 200 мл 0,1 н раствора NaOH, и 200 мл 10 % раствора Н2О2, Na2S, Na2SO3. Отбирали пробы через 24, 48, 72, 144, 168 часов. Определяли концентрацию белка.
Количественную оценку содержания белка проводили фотоколориметрическим методом по биуретовой реакции.
Результаты исследования и их обсуждение
Моделирование процесса гидролиза пера птицы, основанное на литературных аналогиях, заключающееся в длительном кипячении исходного сырья в растворах щёлочи и кислоты, обнаружило полное растворение пера и глубокую деструкцию кератина. По истечении 5 часов кипячения нерастворимой фракции в системе не осталось. В случае обработки кислотой наблюдалось также и значительное обугливание органического вещества.
Тонкослойная хроматография с нингидрином показала наличие серосодержащих аминокислот (цистеина и метионина) в гидролизатах исследуемых образцов. Это подтверждает, что при использованном методе обработки пухо-перового сырья происходит разрушение не только третичной и вторичной, но также и первичной структуры белка с образованием олигопептидов с низкой молекулярной массой и свободных аминокислот.
Во избежание указанных негативных процессов в системе нами осуществлен щелочной гидролиз в мягких условиях, когда перо выдерживалось в 10 % растворе NaOH при комнатной температуре. Эксперимент показал, что в течение суток произошло полное растворение пера.
Таким образом, при действии щелочи в мягких условиях кератин также переходит в раствор за счет селективного гидролиза дисульфидных -S-S- связей в молекуле. Образующиеся продукты реакции (тиолы, сульфоновые кислоты), как правило, неустойчивы в щелочных растворах, и в них могут протекать дальнейшие изменения, осложняющие процесс и загрязняющие конечный целевой продукт.
Подобных нежелательных последствий при осуществлении процесса гидролиза можно попытаться избежать используя особенности химического поведения рассматриваемых веществ.
Предлагаемый в настоящей работе метод получения растворимой модификации кератина основан на взаимодействии кератина с агентами, обладающими окислительно-восстановительными свойствами: сульфидом натрия, сульфитом натрия и перекисью водорода. Эффективность метода оценивалась по содержанию белка в растворе.
Известно, что в случае реакции окисления дисульфидной связи перекисью водорода в присутствии муравьиной кислоты образуются сульфоновые кислоты (схема).
Дисульфидная связь при этом разрушается, белок переходит в водорастворимое состояние. При этом большая часть тиольных групп остатков цистеиновой кислоты в белке будет окислена, что означает фактическую потерю цистеина в конечном продукте.
В случае восстановления дисульфидной связи можно предположить образование тиолов, производной которых белковая аминокислота цистеин и является.
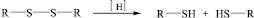
Как показал эксперимент, предлагаемые методы оказались достаточно эффективными. Переход кератина в раствор в разной степени происходит во всех модельных системах. После 96-часовой экспозиции обработки пера наблюдалось полное его растворение, несмотря на значительно меньшую концентрацию (0,5 % раствор по сравнению с 10 % раствором в предыдущем опыте) щелочи в рабочем растворе. Можно предположить, что в этом случае растворение белка связано не с щелочным гидролизом, а с окислительно-восстановительным процессом преобразования дисульфидной связи. Полученная система представляла собой прозрачный практически бесцветный раствор. Следует отметить, что проведение реакции в жестких условиях (при температуре 80–90 °С) приводило к образованию сильно окрашенных растворов, что является следствием побочных деструктивных и окислительных реакций [9].
Концентрация белка во всех случаях возрастала на протяжении 48 часов. Затем наблюдалась определенная стабилизация системы. В течение 2–3 суток концентрация белка оставалась практически постоянной. После этого в эксперименте отмечалось резкое снижение содержания белка в растворе, что может быть связано с самопроизвольным разрушением белковой молекулы (рис. 1).
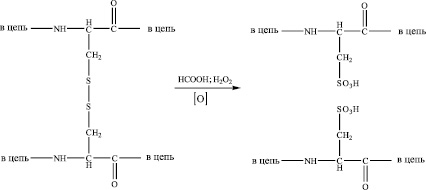
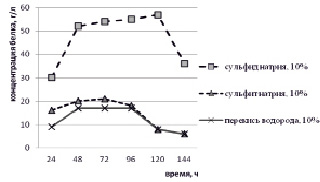
Рис. 1. Изменение концентрации белка в гидролизатах пера в модельных системах
Обращает на себя внимание, что концентрация белка в растворе при использовании сульфида натрия возрастает быстрее и достигает большего значения (до 57 г/л), чем в случае с сульфитом натрия и перекисью водорода. С химической точки зрения это выглядит вполне обоснованно, учитывая, что сульфид – типичный восстановитель в окислительно-восстановительных реакциях, а сульфит и перекись водорода – реагенты с двоякими свойствами (окислителя и восстановителя).
Можно предположить, что в случае с сульфидом процесс ограничивается реакцией восстановления с образованием производных тиолов, а в случае с сульфитом и перекисью водорода процесс осложняется конкурирующей реакцией окисления с образованием конечных продуктов более сложного состава.
Таким образом, проведенное исследование показывает, что для получения водорастворимой формы кератина из пера наиболее целесообразным является способ обработки кератинсодержащего сырья раствором, содержащим типичный восстановитель в щелочной среде.
Аналогичный результат был получен в случае эксперимента по переводу в растворимое состояние кератина шерсти. В опыте с раствором сульфида натрия в щелочной среде наблюдалось увеличение концентрации белка до 43 г/л в течение 48 часов (рис. 2).
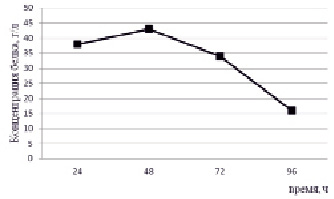
Рис. 2. Изменение концентрации белка в гидролизате шерсти в модельной системе NaOH (0,5 %) : Na2S (10 %)
Выводы
В присутствии в растворе химических реагентов с окислительно-восстановительными свойствами осуществлен процесс перехода кератина пера и шерсти в водорастворимое состояние. В результате такой обработки дисульфидные связи в молекуле белка разрываются с образованием продуктов окисления и восстановления серы, что влечет за собой изменение структуры белка и увеличение его растворимости. Наиболее эффективным вариантом в плане скорости процесса и выхода конечного продукта оказался способ воздействия раствором, содержащим типичный восстановитель (сульфид натрия) в щелочной среде.
Проведенные исследования показали, что получение растворимой модификации кератина из соответствующего белоксодержащего сырья (перо, шерсть) можно эффективно проводить в мягких условиях, не прибегая к высоким температурным режимам и агрессивным реагентам.
Данная технология позволяет в мягких условиях, без деструкции белка и побочных процессов получить его водорастворимую форму, которая может быть использована в различных отраслях практической деятельности. Кроме того, утилизация подобных отходов имеет большое экологическое значение, предотвращая попадание токсичных веществ в окружающую среду, и способствует переходу к высокопродуктивному и экологически чистому сельскому хозяйству.



