Шпинели на основе феррита цинка ZnFe2O4 находят применение в качестве магнитомягких материалов [1], известно их использование в качестве анодов литий-ионных аккумуляторов [3], сенсоров [4], адсорбентов катионов тяжелых металлов [5]. Немаловажным при использовании феррита цинка является его нетоксичность. С этим связано возможное применение ZnFe2O4 в медицине [2]. Одной из активно развивающихся областей применения феррита цинка является использование его в качестве катализатора ряда важных процессов. Так, в работах [6–8] обсуждено применение феррита цинка в качестве фотокатализатора. Имеются сведения [8] о высокой каталитической активности феррита цинка в процессах разложения органических веществ.
Важным свойством гетерогенных катализаторов является развитая поверхность, что обеспечивает большое количество активных центров на единицу массы образца. В связи с этим в последние годы внимание исследователей обращено к изучению возможностей синтеза наноразмерных материалов со структурой шпинели.
Для синтеза мелкокристаллических образцов ферритов используют различные методы, в частности – разложение органического компонента реакционной смеси, в качестве которого могут выступать поливиниловый спирт [5], полиэтиленгликоль [9], мочевина [6] и другие.
Для получения нанокристаллических образцов феррита цинка может быть использован метод, предложенный в работе [6]. Данный метод заключается в растворении нитратов цинка (II) и железа (III) в водно-этанольной смеси, с добавлением мочевины. Смесь подвергают ультразвуковому диспергированию при температуре 60 °С, выдерживают в течение 48 часов, добавляют гидроксид натрия до значений рН 9–10, центрифугируют, промывают, высушивают при температуре 60 °С, вакуумируют, спекают при температуре 550 °С в течение 3 часов. В работе [10] предложена методика синтеза из свежеприготовленного оксида цинка с добавлением хлорида железа (III), аскорбиновой кислоты и гидротермальной обработке полученной смеси в течение 12 часов при температуре 180 °С. Аналогично в работе [4] нитраты железа (III) и цинка (II) растворяют в смеси этанол-этиленгликоль в соотношении (1:9), помещают в автоклав, выдерживают при температуре 180 °С в течение 24 часов, центрифугируют, промывают, высушивают при температуре 80 °С в течение 12 часов, отжигают при температуре 400 °С в течение 2 часов.
Сочетанием описанных выше методик может быть способ, предложенный авторами [7], согласно которому синтез проводят с применением ультразвуковой обработки. При этом нитраты железа (III) и цинка (II) растворяют в этиленгликоле, добавляют ацетат натрия и подвергают гидротермальной обработке при температуре 160 °С в течение 12 часов.
В работе [9] предложен метод, согласно которому нитраты цинка (II) и железа (III) смешивают с раствором полиэтиленгликоля, добавляют ацетат натрия и помещают в СВЧ-печь при мощности 120 Ватт в течение 5 минут и 700 Ватт в течение 10 минут, затем высушивают при температуре 60 °С в течение 24 часов.
Как видно из приведенного обзора методов синтеза мелкокристаллических порошков, для получения шпинелей ZnFe2O4 используют многостадийные методики с применением сложного аппаратурного обеспечения. Для обеспечения диспергирования образующегося продукта часто используют вредные для здоровья органические прекурсоры.
В этой связи целью настоящего исследования являлась разработка простого метода синтеза наноразмерного феррита цинка без применения в качестве исходных вредных органических веществ и изучение его свойств в процессе каталитической деструкции пероксидом водорода органического красителя.
Материалы и методы исследования
Для получения образцов феррита цинка ZnFe2O4 были использованы растворы с концентрацией 1,0 моль/л. Приготовление растворов проводили из реактивов Fe(NO3)3·9H2O, Zn(NO3)2·6H2O квалификации «хч». Смесь растворов нитрата железа (III) (50 мл) и нитрата цинка (II) (25 мл) помещали в реакционный сосуд из нержавеющей стали, добавляли 15 мл 25 %-ного водного раствора аммиака, затем смешивали с 25 мл раствора лимонной кислоты с концентрацией 6,25 моль/л, выпаривали до образования сухого остатка и подвергали термообработке до полного разложения органической составляющей.
Фазовый состав изучали на дифрактометре ARL X’TRA, использовали Cu-Kα излучение. Уточнение структуры фаз, входящих в образцы, проводили по рефлексам 220, 311, 222, 422, 333, 440. Микрофотографии образцов были получены на сканирующем электронном микроскопе. Определение площади поверхности проводили методом ВЕТ на аппарате ChemiSorb 2750 в Центре коллективного пользования «Нанотехнологии» НИИ Нанотехнологий и новых материалов Южно-Российского государственного политехнического университета (НПИ) имени М.И. Платова.
Расчет среднего размера кристаллов D, нм, проводили по уравнению Дебая – Шеррера [11] по линии 311:
D = 0,9∙λ / (B∙cos θ),
где λ = 1,5406 нм – длина волны, В – полная ширина пика на уровне половины интенсивности, θ – угол дифракции.
Изучение каталитической активности синтезированных материалов проводили на модельном растворе метилового оранжевого с концентрацией 40 мг/л. Подробно методика рассмотрена в работе [12]. В типичной процедуре 10 мл исходного раствора метилового оранжевого помещали в плоскодонную колбу, добавляли 0,0010 г катализатора и 2 мл раствора пероксида водорода с концентрацией 3 % (мас.). Определение концентрации метилового оранжевого в растворе проводили фотоколориметрическим методом с помощью прибора КФК-2-УХЛ 4,2 через определенные интервалы времени. Расчет количества метилового оранжевого, подвергшегося каталитической деструкции (Р), проводили по формуле
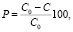
где С0 – начальная концентрация раствора, мг/л; С – текущее значение концентрации раствора, мг/л.
Результаты исследования и их обсуждение
При смешивании растворов исходных солей с раствором аммиака в ходе приготовления образцов наблюдали образование аморфного осадка бурого цвета, затем его растворение. Процессы, происходящие в системе, могут быть представлены следующими уравнениями.
1. Образование малорастворимых гидроксидов цинка (II) и железа (III) при взаимодействии с основанием:
Zn(NO3)2 + 2NH3·H2O = Zn(OH)2 + 2NH4NO3,
Fe(NO3)3 + 3NH3·H2O = Fe(OH)3 + 3NH4NO3.
2. Растворение гидроксидов в избытке гидроксида аммония:
Zn(OH)2 + 2NH3·H2O = (NH4)2[Zn(OH)4],
Fe(OH)3 + NH3·H2O = (NH4)[Fe(OH)4].
В рассматриваемых условиях возможно также протекание процессов формирования нанодисперсных порошков оксидов железа и феррита цинка [13], которые в дальнейшем могут выступать в качестве зародыша образования целевого продукта, и аммиачных комплексов цинка по реакции
Zn(NO3)2 + 4NH3 = [Zn(NH3)4](NO3)2.
При введении в систему раствора лимонной кислоты, имеющей формулу
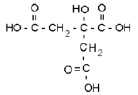
возможно образование комплексных соединений (подобно отмеченным в [14] для хромсодержащих систем) по реакциям
(NH4)2[Zn(OH)4] + 2C6H8O7 =
= (NH4)2[Zn(C6H6O7)2] + 4Н2О,
(NH4)[Fe(OH)4] + 2C6H8O7 =
= (NH4)[Fe(C6H6O7)2] + 4Н2О.
Изучение морфологии поверхности полученных материалов (рис. 1) позволяет сделать вывод, что в формировании образцов с пористой каркасной структурой принимают участие прекурсоры аналогичной формы.
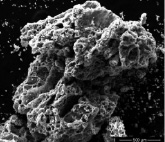
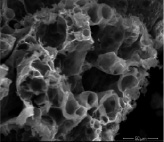
а) б)
Рис. 1. Микрофотография образца феррита цинка (II). Увеличение: а) х 150; б) х 1274
В этой связи можно предположить, что формирование феррита цинка протекает через стадию образования хелатных комплексов цитратов с катионами переходных элементов
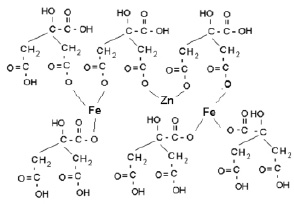
в соответствии с возможным уравнением реакции
(NH4)2[Zn(C6H6O7)2] + 2(NH4)[Fe(C6H6O7)2] = = [ZnFe2(C6H6O7)2(C6H7O7)4] + 4NH3.
Подобные комплексы имеют объемную структуру, которую будут сохранять образующиеся продукты процесса.
При дальнейшей термообработке прекурсоры разлагаются с интенсивным выделением газообразных веществ и формированием конечного продукта реакции
[ZnFe2(C6H6O7)2(C6H7O7)4] + 27 O2 = = ZnFe2O4 + 36CO2 + 20H2O.
Подтверждением предложенного механизма реакции может являться указанная в [14] возможность использования прекурсоров – комплексных солей переходных элементов – в синтезе оксидных соединений.
Протеканию процесса синтеза может способствовать экзотермическая реакция разложения нитрата аммония, образующегося при взаимодействии растворов солей с водным раствором аммиака.
Процесс завершается образованием пористой массы желтого цвета. При дальнейшем нагревании наблюдали разложение прекурсора с формированием кристаллического порошка кирпично-коричневого цвета с ячеистой структурой и порами большого диаметра (рис. 1). Площадь удельной поверхности, измеренная методом ВЕТ, составляет 207 м2/г.
Согласно результатам рентгенофазового анализа (рис. 2) образец представляет собой феррит цинка (II) со структурой кубической шпинели (Franklinite, PDF Number 010-70-6490). Параметр элементарной ячейки а = 0,84440 нм.
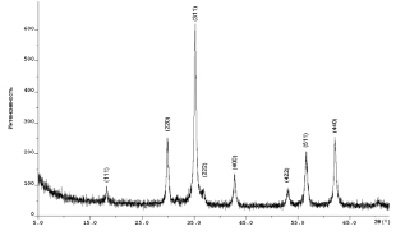
Рис. 2. Рентгенограмма образца феррита цинка (II)
Расчет среднего размера кристаллитов по уравнению Дебая – Шеррера по наиболее интенсивной линии дает результат D = 3,0 нм.
Предложенный метод формирования структуры феррита цинка отличается простотой аппаратурного оформления и небольшим набором технологических операций. Кроме того, он исключает использование вредных для здоровья органических веществ.
Изучение каталитической активности синтезированных материалов проводили на примере реакции окислительной деструкции метилового оранжевого в присутствии пероксида водорода. В ходе проведенного исследования установлено, что синтезированный нанокристаллический феррит цинка проявляет высокую каталитическую активность в реакции Фентона. Временная зависимость количества метилового оранжевого, подвергшегося каталитической деструкции, приведена на рис. 3.
Согласно результатам проведенного исследования, в случае применения синтезированного катализатора ZnFe2O4 в процессе окислительной деструкции метилового оранжевого в присутствии пероксида водорода при температуре реакции 86 °С удается достичь полного удаления органического вещества из водного раствора в течение 5 минут. Полученные результаты могут служить ориентиром для выбора материалов, перспективных для применения в системах очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.
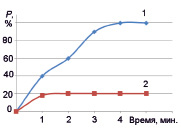
Рис. 3. Зависимость степени разложения органического красителя от времени протекания реакции: 1 – в присутствии катализатора ZnFe2O4 , 2 – без катализатора
Выводы
1. Предложен простой метод получения наноразмерного феррита цинка из растворов солей соответствующих переходных элементов в среде водных растворов аммиака и лимонной кислоты. Обсужден механизм формирования структуры образцов через образование комплексных цитратов переходных элементов и их последующего разрушения при нагревании. Показана возможность получения гомогенной смеси, приводящей к формированию каркасной структуры феррита цинка. Определен по формуле Дебая – Шеррера средний размер кристаллитов образующегося феррита цинка, который составил 3 нм. Полученные образцы имеют сильно развитую поверхность и могут представлять интерес в качестве нетоксичных катализаторов, адсорбентов.
2. Изучены свойства синтезированного материала в процессе окислительной деструкции органического красителя в присутствии пероксида водорода. Проведение реакции при температуре 86 °С сопровождается полным удалением органического вещества из водного раствора в течение 5 минут. Полученные результаты могут служить ориентиром для выбора материалов, перспективных для применения в системах водоподготовки и обеспечения экологической безопасности промышленных предприятий, использующих в производственном процессе органические красители.



