Благодаря способности к донорно-акцепторному взаимодействию с катионами металлов и такому ценному качеству, как высокая избирательность, комплексообразователи нашли широкое применение в качестве фотометрических, экстракционных, маскирующих, люминесцентных аналитических реагентов. Реагенты в большинстве случаев используются в виде растворов, и сами анализы осуществляются практически всегда в жидкой фазе. Но, если применять комплексообразователь или иной сорбент в виде твёрдой фазы, как показывает пример ионитов и сорбентов типа окисленных углей [1], хемосорбция также возможна и на твердой поверхности, по-видимому, за счёт того, что в межфазное пространство выходят активные группы сорбента, которые связывают поступающие туда же из жидкой фазы ионы.
В аналитической химии находят все более широкое применение многочисленные производные пиразолона. Они легко синтезируются и обладают высокой реакционной способностью. Введение гетероциклического радикала в молекулы красителей обусловливает устойчивость реагентов в кислых средах, прочность образуемых соединений, высокую реакционную способность реагентов. Интенсивно окрашенные реагенты успешно используются для определения ряда элементов, образующих ацидокомплексные анионы, которые не обладают хромофорным действием. Способность антипирина и его производных к реакциям комплексообразования и экстракции ионов металлов в органические растворители описана в работах российских ученых М.И. Дегтева [2], В.П. Живописцева [3], О.Б. Логиновой, С.В. Темерева [4], Б.И. Петрова [5] и иностранных авторов [6, 7].
Цель исследования – изучение свойств производных антипирилметана как избирательных комплексообразователей и возможности их применения в виде твёрдой фазы.
Материалы и методы исследования
Исследования проводили на примере синтезированного соединения из группы арилариламино-4-антипирилметанов-фенил-2-метоксифениламино-4-антипирилметана (ФМААМ) [8], прекурсорами которых являлись: бензальдегид, орто-анизидин и антипирин. Структура вещества подтверждена спектральными методами анализа (ИК-спектры снимались на ИК-Фурье спектрофотометре Shimadzu FTIR-8400S, УФ-спектры – на спектрофотометре СФ-2000). Ход реакции и чистоту соединений контролировали методами тонкослойной хроматографии на пластинах Silufol в системе этилацетат-толуол, пятна детектировали в ультрафиолетовом свете. Элементный анализ выполняли на атомно-абсорбционном спектрометре с пламенной атомизацией Shimadzu AA 6200.
Результаты исследования и их обсуждение
Формула полученного фенил-2-метоксифениламино-4-антипирилметана приведена на рис. 1.
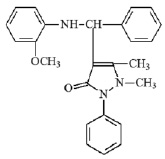
Рис. 1. Структурная формула ФМААМ
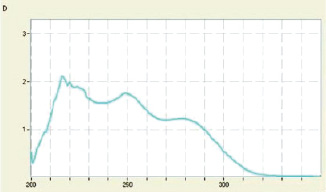
Рис. 2. УФ-спектр ФМААМ
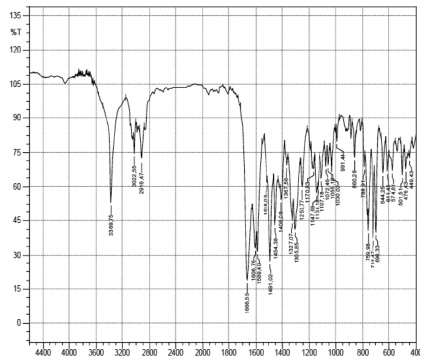
Рис. 3. ИК-спектр ФМААМ
К 0,05 моль шиффова основания (N-бензилиден-м-толуидину) добавили 0,05 моль антипирина, растворяли в 30 мл изопропанола при нагревании, далее раствор охлаждали и при достижении комнатной температуры приливали 0,2 мл концентрированной HCl. Затем полученную смесь оставили на сутки для выпадения осадка, избегая воздействия прямых солнечных лучей. Для нейтрализации прибавленной ранее кислоты прибавляли водный раствор аммиака и осадок отфильтровывали. Далее осуществляли двойную перекристаллизацию в изопропаноле для очистки вещества от примесей.
Полученный ФМААМ представляет собой кристаллическое вещество белого цвета с η = 72,4 % и Тпл = 220 °С. На рис. 2 представлен его УФ-спектр.
ИК-спектр (рис. 3) содержит полосы, подтверждающие наличие в молекуле в соответствии с предполагаемой формулой полученного соединения вторичной аминогруппы при 3369,75 см-1 и карбонильной группы антипирильного радикала при 1666,65 см-1.
Константа распределения фенил-2-метоксифениламино-4-антипирилметана в системе хлороформ – вода К = 153. Высокое значение константы показывает, что хлороформные растворы этого соединения должны обладать высокой экстракционной способностью. Протонированная форма соединения, в отличие от комплексов, слабо поглощает в области выше 320 нм, что свидетельствует о возможности его применения в качестве фотометрического реагента (рис. 4).
Свойства ФМААМ как экстракционного аналитического реагента были изучены ранее на примере экстракции катионов Hg2+, Сd2+, Bi3+, Mg2+, Sr2+, Ca2+, Сu2+, Pb2+, Mn2+, Pt4+ [5, 8] из Cl-, Br-, I-, HPO42-, SCN-, NO3-, SO42-, ClO4-, CH3COO-, CCl3COO- систем [9, 10]. На основании УФ спектров хлороформных экстрактов установлены катионы металлов, с которыми реагенты образуют комплексы. Наиболее интересными оказались йодидная, трихлорацетатная и гидрофосфатная системы. Из перечисленных катионов из йодидной среды извлекаются все кроме Mn2+, из трихлорацетатной извлекается только Hg2+, гидрофосфатной только Bi3+.
Эти факты свидетельствуют о том, что соединение может применяться в двух вариантах: в одном случае как высокоизбирательный реагент (из трихлорацетатной среды из 10 катионов извлекается только 1), во втором – как эффективное маскирующее средство (из йодидной среды извлекаются все кроме одного). При этом для того, чтобы приблизить эффективность производных антипирилметана к показателям, демонстрируемым в случаях, когда они применяются в виде растворов, использовать их целесообразнее в виде коллоидных систем, которые предоставляют для взаимодействия большие поверхности.
Для изучения возможности применения комплексообразователя в виде твёрдой фазы методом замены растворителя готовили дисперсии реагента в воде. Для этого ФМААМ растворяли в диметилформамиде (ДМФА), полученный раствор вливали в дистиллированную воду. Варьируя объёмы, готовили растворы разной степени дисперсности. Возможность сорбции катионов металлов из водной фазы коллоидными частицами изучали на примере сорбции ионов меди из водных растворов этими дисперсиями. Для этого в пробирку помещали 1 мл водного раствора соли меди концентрации 0,01 н, для создания соответствующей среды приливали 1 мл 0,3 н раствора йодида калия и 1 мл 0,03 н раствора НСl. К полученному раствору добавляли 0,5 мл 0,03 М раствора ФМААМ в ДМФА. Образовавшуюся коллоидную систему подвергали 10-минутному центрифугированию при скорости 15 тыс. об/мин. Добавленный реагент выпал в осадок. Центрифугат сливали и обнаруживали ионы меди добавлением водного раствора аммиака. Образования синей окраски не наблюдали. На основании этого полагали, что все ионы меди были осаждены на поверхность коллоидных частиц, водная фаза была от них освобождена. коллоидными растворами.
Для контроля параллельно поставили 2 опыта: в одном случае раствор иодида калия заменили раствором нитрата калия. Во втором случае вместо этого раствора прилили такой же объём воды. После отделения центрифугата и добавления водного раствора аммиака наблюдали ярко-синее окрашивание, т.е. медь присутствовала, её связывания не произошло. Точно так же происходило и при экстракции меди хлороформным раствором этого соединения.
Изучение маскирующего действия ФМААМ установили на примере осаждения меди из смеси солей меди и кадмия из нитратной среды (в этом случае комплексообразование с медью происходит, с кадмием нет). После описанных выше операций медь не обнаруживалась, а остаточное присутствие кадмия было установлено образованием жёлтого осадка сульфида кадмия при добавлении к центрифугату сероводородной воды.
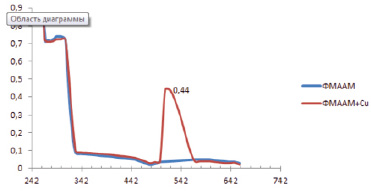
Рис. 4. Спектры чистого ФМААМ в хлороформе и с катионами меди
Значения длин волн максимумов поглощения (λmax, нм) и оптическая плотность (А) в УФ-спектрах поглощения экстрактов комплексов ФМААМ с катионами металлов из различных сред при концентрации реагента 10-4 моль/л
|
Ионы |
I- |
Br- |
NO3- |
ClO4- |
Cl- |
SO42- |
HPO42- |
CH3COO- |
CCl3COO- |
SCN- |
|
Hg2+ |
330 0,72 |
550 0,08 |
– |
550 0,052 |
– |
– |
– |
– |
550 0,084 |
– |
|
Сd2+ |
365 0,66 |
– |
– |
– |
285 0,08 |
– |
– |
– |
– |
– |
|
Bi3+ |
380 0,15 |
– |
– |
380 0,68 |
– |
– |
380 0,077 |
380 0,09 |
– |
– |
|
Mg2+ |
345 0,377 |
– |
– |
– |
– |
– |
– |
– |
– |
560 0,024 |
|
Sr2+ |
365 0,383 |
550 0,08 |
– |
– |
– |
– |
– |
– |
– |
– |
|
Ca2+ |
350 0,391 |
– |
– |
– |
– |
– |
– |
– |
– |
560 0,131 |
|
Сu2+ |
510 0,44 |
– |
320 0,17 |
– |
– |
– |
– |
– |
– |
– |
|
Pb2+ |
550 0,115 |
540 0,095 |
– |
– |
– |
560 0,01 |
– |
– |
– |
560 0,0113 |
|
Mn2+ |
– |
– |
320 0,13 |
– |
– |
– |
– |
– |
– |
– |
|
Pt4+ |
360 0,45 540 0,107 |
560 0,117 |
560 0,08 |
545 0,094 |
570 0,051 |
565 0,04 |
– |
560 0,15 |
– |
550 0,12 |
На основании описанных экспериментов полагали, что ФМААМ сохраняет свою достаточно высокую избирательность при применении в виде твердой фазы в высокодисперсном (коллоидном) состоянии. При этом применение комплексообразователей в виде коллоидных растворов может быть более удобным, так как, например, при использовании для устранения мешающего влияния посторонних элементов упрощает выполнение этой процедуры, позволяет избежать применения не всегда безопасных растворителей, что особенно приветствуется «зелёной химией» [5].
Как видно из приведенных в таблице данных, соединение является достаточно высокоизбирательным комплексообразователем.
Чтобы убедиться в том, что комплексообразование происходило на поверхности твердого комплексообразователя и связанный ион оставался на твердой фазе, осуществили десорбцию меди с поверхности отделённого центрифугированием осадка смешиванием его с 0,1 н раствором сульфата натрия (в сульфатной среде реагенты комплексов с катионом меди не дают) с последующим добавлением водного аммиака. Если бы ионы меди оставались на твердой фазе, после их десорбции мы бы наблюдали образование синего аммиаката меди. Но этого не происходило, т.е. ионы меди отсутствовали.
Во втором варианте отделённый центрифугированием осадок подвергали мокрому сжиганию и в продуктах сжигания пытались обнаружить ионы меди. Они отсутствовали. Это свидетельствует о том, что имела место не адсорбция ионов меди на поверхности твердой фазы, а либо выход комплексообразователя в жидкую фазу с последующим комплексообразованием, либо комплексообразование на поверхности с последующим выходом образующихся комплексов в жидкую фазу. То есть в конечном варианте имело место маскирующее действие комплексообразователя. Возможность практического применения маскирующего действия реагента проверили на примере определения марганца в присутствии других катионов. Для этого брали раствор, содержащий все вышеперечисленные катионы и иодид натрия. Его подкисляли и вносили суспензию реагента. Твердую часть отделяли центрифугированием, к центрифугату добавляли раствор нитрата серебра для осаждения иодид-ионов, образовавшийся осадок отделяли фильтрованием, получали прозрачный бесцветный раствор. К нему добавляли окислитель (персульфат аммония), получали розовый раствор перманганата. То есть, таким образом можно определять марганец фотометрическим методом.
Заключение
Таким образом, изученный фенил-2-метоксифениламино-4-антипирилметан, являясь эффективным комплексообразователем, может применяться как маскирующий агент в виде твердой взвеси или коллоидного раствора. Данный класс соединений обладает свойствами аналитических экстракционных реагентов с достаточно высокой избирательностью, что дает возможность поиска более совершенных и расширения ассортимента применяемых реактивов подобного назначения.



