Металлароматические комплексы (МАК) – это особый класс окрашенных соединений, которые получают при взаимодействии щелочных металлов (Li, Na, K) с ароматическими углеводородами (дифенил, нафталин, фенантрен и т.д.) [1, 2]. Благодаря своей ион-радикальной природе, МАК являются реакционноспособными соединениями, что позволяет их использовать для модификации поверхности инертных полимеров с целью придания адгезионной способности [3, 4], интеркаляции слоистых материалов и как инициаторы в реакциях полимеризации [5, 6].
Реакции такого типа легко протекают в среде электронодонорных растворителей (тетрагидрофуран, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и т.п.) [1, 2, 7].
Цель настоящей работы – исследование влияния природы растворителя на модифицирующую способность раствора МАК.
Материалы и методы исследования
В работе использовали неориентированную пленку политетрафторэтилена (ПТФЭ) (ГОСТ 24222-80) толщиной 60 ± 3, 100 ± 3 мкм.
Растворители (тетрагидрофуран, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля, диметоксиэтан, диэтоксиэтан) очищали согласно следующей методике. Растворитель сушили над твердой щелочью двое суток, декантировали, а затем оставляли на сутки над металлическим натрием. Осушенный от воды растворитель проверяли на наличие гидропероксидных соединений йодометрическим методом. При содержании пероксидных соединений более 3 % растворитель подвергали очистке методом адсорбционной хроматографии на колонке, заполненной сорбентом из чередующихся слоев оксида алюминия Al2O3 (ТУ 6-09-3916-75) и безводного сульфата меди СuSO4 (ТУ 6-09-4525-77). Чистоту очищенного растворителя определяли по показателю преломления на рефрактометре RL Nr2925.
Технология получения металлароматического комплекса представлена на рис. 1.
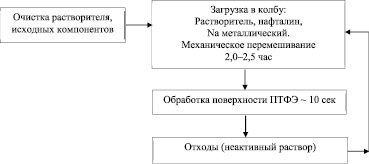
Рис. 1. Технология получения металлароматического комплекса
Содержание активного Na-нафталинового комплекса в растворах определяли методом газожидкостной хроматографии на приборе ЛХМ-8Д.
Количественный анализ компонентов проводили методом внутренней нормализации по формуле
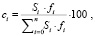
где сi – концентрация компонента i в смеси, %;
Si – площадь соответствующего пика, мм2;
fi – относительный поправочный коэффициент;
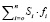 – сумма произведений площадей пиков на относительные поправочные коэффициенты для всех пиков хроматограммы.
– сумма произведений площадей пиков на относительные поправочные коэффициенты для всех пиков хроматограммы.
Площадь пика Si определяли методом треугольника как произведение высоты пика на его ширину, замеренную на середине высоты пика.
Технология модифицирования поверхности ПТФЭ: пленки политетрафторэтилена промывают водой и обезжиривают ацетоном с последующим подсушиванием на воздухе. Модифицирующий раствор наливают в чистый, сухой сосуд, куда погружают пленки на 5–10 с, поверхность которых окрашивается в коричневый цвет. Обработанные пленки ПТФЭ промывают ацетоном, затем водой и высушивают на воздухе в течение 2–3 ч.
Адгезионную способность пленок характеризовали прочностью склеивания их с металлами и друг с другом клеем марки К-300. Прочность при сдвиге образцов, склеенных «внахлестку» (ГОСТ 14759-69), определяли на универсальной машине Instron 3367 при скорости движения траверсов 10 мм/мин.
Результаты исследования и их обсуждение
Использование МАК для модификации поверхности политетрафторэтилена обусловлено высокой химической активностью, сопровождающейся образованием полярных групп (пероксидных, гидроксильных и гидропероксидных), в результате увеличиваются адгезионные свойства полимера (рис. 2) [3, 4].
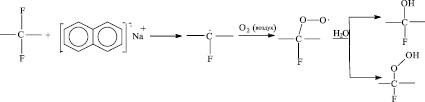
Рис. 2. Образование гидрофильных групп на поверхности модифицированного ПТФЭ
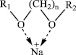
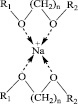
Рис. 3. Комплексы хелатного типа
МАК получали в различных растворителях c учетом полярных свойств и сольватирующей способности растворителей, которые зависят от строения молекул, т.е. величины алкильного радикала в эфирах, диэлектрической постоянной, строения мостика между атомами кислорода в эфирах гликолей, числа атомов кислорода и вида заместителей в циклических эфирах.
Важное значение для реакции образования анион-радикалов имеет природа металла и растворителя [8]. Сольватация рассматривается как донорно-акцепторный процесс и как комплексообразование. Этим объясняются особенности процесса гидратации катионов лития, натрия и калия. Донорами электронов выступают атомы кислорода, имеющие неподеленные пары электронов, а акцептором – атомы щелочных металлов, представляющие вакантные электронные орбитали. Число и тип гибридизации свободных орбиталей атомов катиона определяют направленность и количество донорно-акцепторных связей. Вероятными вакантными орбиталями для катионов лития, натрия и калия являются 2s2p, 3s3p и 4s4p3d, тип гибридизации которых – sp3, sp3 и sp3d2 соответственно. Таким образом, атомы кислорода адденда должны располагаться в вершинах тетраэдра при сольватации Na+, который находится в центре. В теплоту сольватации наибольший вклад вносит энергия образования донорно-акцепторных связей между молекулами растворителя и катиона. Энергия вторичной сольватации катиона, происходящей в результате ион-дипольного взаимодействия, составляет меньшую часть полной энергии сольватации.
На примере эфиров гликолей можно проследить влияние стерических факторов. Показано [8], что при реакции ионов Na+ с эфиром этиленгликоля происходит образование комплексов хелатного типа (рис. 3).
При образовании устойчивого сольвата большое значение имеет строение метиленового мостика. Наиболее выигрышна группировка атомов, характерная для эфиров этиленгликоля (-О(СН2)2О-). Это связано с устойчивостью цис-конформации молекулы, необходимой для образования хелатного комплекса. С ростом числа групп СН2-, вращающихся свободно по отношению к друг другу, затрудняется переход молекул в цис-конформацию. Ухудшение сольватирующей способности связано с тем, что у эфиров этиленгликоля с увеличением размера боковых алкильных групп и свободном их вращении, повышается вероятность экранирования ими атомов кислорода.
О возможном механизме сольватации свидетельствует данные по термодинамике реакции дифенила с натрием [8]. Установлено, что механизм сольватации иона Na+ – ступенчатый. Поскольку у натрия координационное число равно 4, а молекулы эфиров этиленгликоля способны одновременно образовывать по две донорно-акцепторных связи, имеются два вида хелатных комплексов – с одной и с двумя молекулами эфира (рис. 3). В отличие от эфиров гликолей одна молекула тетрагидрофурана может образовать с катионом только одну донорно-акцепторную связь, следовательно хелатный комплекс содержит четыре молекулы ТГФ.
Согласно плазменно-гидродинамической концепции, включающей ион-дипольное электростатическое взаимодействие, поведения ионов и молекул в различных средах [9], сольватное число ns оценивается параметрами растворенного электролита и самого растворителя
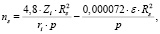 (1)
(1)
где Zi, ri – заряд и радиус иона (10-8 см); Rs – радиус молекулы (10-8 см), p – дипольный момент (D) и ε – диэлектрическая постоянная растворителя.
Радиусы молекул некоторых растворителей известны. Для тетрагидрофурана искомый радиус аппроксимирован методом многоуровневого моделирования авторской компьютерной программы по уравнению [10]:
Rs = 0.008617•Tкип – 3,7219•p + 0,001198•η +
+ 0,06734•p + 2,1684 = 1,92•10-8 см. (2)
Уравнения (1, 2) позволяют оценить сольватное число иона Na+ в тетрагидрофуране
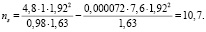
Это свидетельствует о том, что в связи с неполной локализацией электрического поля иона натрия (ядра атома натрия) МАК – это не только простой металлароматический комплекс, а представляет собой более сложную сольватную оболочку, в которую дополнительно включено несколько диполей тетрагидрофурана.
Увеличение модифицирующей способности полученного в тетрагидрофуране МАК связано с повышенной концентрацией активного комплекса (12–13 %) в растворе в сравнении с растворами, полученными в других растворителях (8–9 %). Na-нафталиновый комплекс на основе отходов модификации поверхности ПТФЭ обладает высокой активностью вследствие образования дианионов нафталина в растворе (18–20 %).
Так, при добавлении Na в раствор образуется избыток, что приводит к захвату второго электрона анион-радикалом нафталина с образованием дианиона:
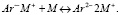
Исследование методом ЭПР Na-нафталинового комплекса на основе отходов модификации поверхности ПТФЭ показало, что полученный раствор диамагнитен (рис. 4). Известно, что дианионы в большинстве случаев являются диамагнитными.
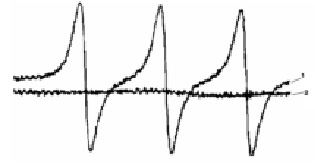
Рис. 4. ЭПР-спектры: 1 – эталон ТЕМПО (2,2,6,6-тетраметил-4-оксопиперидин-1-оксилом); 2 – Na-нафталиновый комплекс, полученный с использованием отходов в ТГФ
Прочность склеенных образцов, обработанных МАК, в зависимости от природы растворителя
|
Образец |
Получение МАК в растворителе |
Прочность при сдвиге τ, кН/м2 |
|
|
Чистый растворитель |
Растворитель/отходы (1/1) |
||
|
Д 16T-ПТФЭ |
Тетрагидрофуран |
177,6 |
208,6 |
|
Диметоксиэтан |
163,4 |
190,8 |
|
|
Диметиловый эфир диэтиленгликоля |
159,8 |
186,3 |
|
|
Диэтиловый эфир диэтиленгликоля |
154,3 |
190,2 |
|
|
ПТФЭ-ПТФЭ |
Тетрагидрофуран |
145,8 |
201,7 |
|
Диметоксиэтан |
140,7 |
195,8 |
|
|
Диметиловый эфир диэтиленгликоля |
136,1 |
195,0 |
|
|
Диэтиловый эфир диэтиленгликоля |
131,2 |
188,7 |
|
Из данных таблицы видно, что МАК, полученный в тетрагидрофуране, характеризуется большей модифицирующей активностью. Тетрагидрофуран является лучшим комплексообразователем, что объясняется отсутствием стерических препятствий при координации этим растворителем.
Заключение
Концентрация металлароматического комплекса в растворе тетрагидрофурана на 33 % выше, чем в других растворителях, что приводит к повышению модифицирующей способности. Прочность при сдвиге склеенных композиций на основе модифицированного политетрафторэтилена повышается на 5–13 %.
Улучшение сольватирующей способности тетрагидрофурана объясняется отсутствием пространственных затруднений в процессе комплексообразования.



