Разработку и развитие теоретических и прикладных основ инструментальных методов контроля качества пищевых продуктов, включая определение кислотных и пероксидных чисел растительных масел и жиров, следует отнести к актуальным направлениям аналитической химии сегодняшнего дня. Именно к последней проблеме проявляется большой интерес со стороны исследовательских и контрольно-аналитических лабораторий многих стран мира, благодаря той важной биолого-медицинской, потребительской и даже социальной роли, которую играют растительные жиры в жизни современного человека [1, с. 332–336]. Вместе с тем в этой научно-технической области, прежде всего аналитического и технохимического контроля, еще остается много нерешенных вопросов, связанных с развитием теоретических и методологической базы аналитического контроля, а также методов и средств измерений показателей качества таких трудных для анализа объектов, как растительные масла. В частности, необходимость применения неводных или смешанных водно-органических растворителей делает проблематичным долговременное использование стеклянного электрода с Н-функцией в косвенных рН-метрических методах определения кислотного числа растительных жиров [2, с. 42–44]. В основу развития данной проблематики положена и другая аналитическая реакция (окислительно-восстановительное взаимодействие в иодад-иодидной системе с переносом протона), и другой способ измерения аналитического сигнала (редокс-потенциометрия в эмульсионных водно-спиртовых растворах) без применения трудоемкого титрования.
Целью настоящей работы было определение ряда кинетических и равновесных характеристик и параметров комплексного процесса массопереноса высших жирных кислот в системах «масло – водно-спиртовые растворы» с реагентами и электролитами различной природы (хлорид натрия, иодид калия, KI + KIO3, гексаметилентетрамин, ацетат натрия) для оптимизации условий косвенного потенциометрического определения кислотного числа растительных масел.
Материалы и методы исследования
Для повышения качества и надежности рН- и редокс-потенциометрических измерений собственно аналитического сигнала и производных от него параметров, определяющих физико-химические (кинетические и термодинамические) характеристики соответствующих гетерогенных и гомогенных реакций использовались современные информационные технологии [3, с. 92–93]. Особенно важным представляется автоматическая регистрация на основе созданного программно-технического комплекса «иономер – ЭВМ» таких кинетических зависимостей, как «рН – время» и «потенциал – время» с начальным шагом в одну секунду. Предлагаемый аппаратный комплекс состоит из потенциометрической ячейки, устройства сопряжения и персонального компьютера с соответственным программным обеспечением. Все измерения проводились с использованием иономера И-130, блока индикаторных платинового ЭПВ-1 и стеклянного ЭСЛ-43-07 электродов и хлорид серебряного электрода сравнения ЭВП 1 МЗ.
Результаты исследования и их обсуждение
Для обоснования оптимальных условий косвенного редокс-потенциометрического анализа в автоматическом режиме регистрировались кинетические потенциометрические зависимости «потенциал (Е) – время (t)» (реакция по продукту) и «рН – время (t)» (реакция по исходному реагенту). На основании этих зависимостей оценивались эффективные значения начальной потенциометрической скорости:
V0(Е) = (1/S)(dE/dt)t=0, (1)
V0(Н) = (dрН/dt)t=0 (2)
Таблица 1
Эффективные значения начальных скоростей V0E = (1/S)(dE/dt) t=0 и V0Н = (dрН/dt)t=0 в растворе 60 %-ного этанола, содержащем 0,2 М иодид калия и 0,01 иодат калия
|
Масло |
Х, мг КОН |
m, г |
t, °C |
pH0 |
V0 (E), с-1 |
V0(H), с-1 10-3 |
V0(H)эк, с-1 10-3 |
|
Оливковое |
0,33 |
0,23 |
30 |
6,87 |
4,69 10-3 |
– |
– |
|
Кукурузное |
0,55 |
0,20 |
30 |
6,83 |
6,25 10-3 |
6,5 |
6 |
|
Подсолнечное рафинированное |
0,70 |
0,20 |
30 |
6,55 |
7,50 10-3 |
10 |
50 |
|
Сливовое |
0,88 |
0,18 |
30 |
6,60 |
8,94 10-3 |
6,8 |
6 |
|
Подсолнечное |
3,10 |
0,47 |
30 |
5,81 |
3,44 10-2 |
150 |
210 |
|
Соевое |
3,65 |
0,22 |
40 |
5,98 |
1,6 10-2 |
30 |
50 |
|
Подсолнечное |
7,60 |
0,19 |
55 |
5,75 |
3,12 10-2 |
94 |
80 |
|
Рапсовое |
8,20 |
0,20 |
55 |
5,66 |
8,28 10-2 |
110 |
77 |
в растворе 60 %-ного этанола, содержащем, 0,2 моль/л иодида калия и 0,01 моль/л иодата калия. Некоторые значения этих величин представлены в табл. 1. В качестве равновесной характеристики использовались значения разностного потенциометрического сигнала [4, с. 1110]:
DpHr = pHr – pH0, (3)
DEr = Er – E0. (4)
Измеряемый потенциометрический аналитический сигнал в системе «масло (высшие жирные кислоты RiCOOH) – водно-спиртовой раствор реагента (IO3- + I-)» определяется комплексной реакционной схемой [5, с.75]:
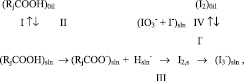 (5)
(5)
где стадия I отвечает экстракции свободных жирных кислот из неполярной фазы (масло – индекс «oil») в полярную фазу (водный этанол – индекс «sln»); стадия II – равновесие протонизации – дипротонизации органических карбоновых кислот в указанном водно-спиртовом растворе, стадия III – суммарная окислительно-восстановительная реакция с участием ионов IO3- , I- и Н+. Ионы Н+sln в растворе выступают, особенно при избытке KIO3 и KI, как скорость-определяющий реагент. Схема позволяет изучить равновесные и кинетические характеристики путем раздельного введения компонентов (экстракция в иодиде калия) и реакция после добавки иодата калия. В отличие от растительных пищевых масел, при смешении доз эфирных масел и водно-спиртового раствора указанного реагента, образовывалась микроэмульсионная система без видимого разделения полярной и неполярной фаз.
Для сравнения с редокс-схемой (5) приведена также схема кислотно-основного химического взаимодействия, включающая наряду с экстракцией стадию взаимодействия жирных кислот с реагентом – слабым основанием взятом в избытке [5, с. 79]:
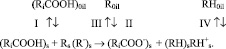 (6)
(6)
Для приведенной схемы 1 из кинетических зависимостей рН – t получены опытные значения V0(H) с кислотно-основным реагентом (0,2М уротропин + 0,2М хлористый натрий; рН0 = 8,9), которые в первом приближении согласуются с кинетическим уравнением
V0(H)ex= k'ef *Ck0 (рН0 = сonst), (7)
где k'ef – эффективная константа скорости; Ck – общая концентрация кислоты, в том числе суммы органических кислот из растительных масел исходной иодат-иодидной смеси.
В гомогенных модельных системах состава ≈ 60 % этанол + 0,2М иодид калия + (6×10-3 – 1×10-2М) иодат калия + жирные (уксусная, олеиновая) кислоты из наклона линейных зависимостей lg V0 (по изменению рН) и lg V0 (по изменению потенциала) – рН0, lg V0 (по изменению рН) и lg V0 (по изменению потенциала) – lg СК был найден общий порядок сложной окислительно-восстановительной реакции по ионам водорода, участвующим в иодат-иодидном взаимодействии, а также формальный порядок по общему содержанию жирных кислот (СК). При исследовании масел вместо СК в уравнения можно подставить величины навески m, кислотного числа Х или (mХ).
Между найденными кинетическими параметрами и содержанием жирных кислот в образцах масел имеют место соотношения
lg V0 (H) @ constI – pH 0', (8)
lg V0 (H) @ constII + lg (mX), (9)
lg V0 (E) @ constIII + 0,7 lg (mX), (10)
lg V0 (E) @ constIV – pH 0', (11)
lg V0 (H)ex @ constV + lg (mX). (12)
Такая же зависимость была получена для масел с различными кислотными числами или для данного кислотного числа от количества масла (табл. 2).
Таблица 2
Влияние кислотного числа и природы масла на параметр V0 (e); 20 °С
|
Масло |
Кислотное число, мг КОН/ г масла |
V0(Е) |
|
Оливковое |
0,33 |
10-4 |
|
Кукурузное |
0,55 |
3·10-3 |
|
Подсолнечное (рафинированное) |
0,70 |
9·10-3 |
|
Сливовое |
0,88 |
5·10-3 |
|
Подсолнечное |
3,10 |
(0,3 – 3)·10-2 |
|
Рапсовое |
8,20 |
(2-3)·10-2 |
С учетом известных из литературы математических моделей потенциометрической кинетики выражения (8), (10) формально указывают на возможный второй порядок процесса по ионам водорода при значительном избытке других реактантов (IO3- , I-, R). Хотя из выражения (9) формально следует более высокий порядок по ионам Н+, если только в данной среде не образуется буфер (жирная кислота и ее соль). В то же время из соотношения (11) вытекает первый порядок измеряемой скорости реакции по ионом Н+. Это кажущееся противоречие обусловлено тем, что на параметр начальной скорости по изменению потенциала по сравнению с начальной скоростью по изменению рН большее влияние по-видимому, оказывает возможное торможение на промежуточной стадии образования ионной пары йодноватой кислоты. Аналогичные кинетические характеристики были получены и в случае добавок в иодат-иодидный этанольный раствор доз исследуемых эфирных масел. На основе кинетического уравнения (8) определены приближенные значения приведенной эффективной константы скорости.
Таблица 3
Влияние состава раствора (содержание этанола, реагента и/или электролита) на равновесие процесса DрНr (DEr) и начальную скорость экстракции V0 (H)ex жирных кислот из подсолнечного масла с кислотным числом 3,10 мг КОН/г moil = 0,5 г
|
Состав раствора |
V0 (H)ex , с-1Δ |
ΔрНr (ΔЕr/S) |
||
|
25 °С |
30 °С |
25 °С |
30 °С |
|
|
96 % этанол; 0,1 М NaAc |
0,25 |
0,26 |
0,93 |
0,97 |
|
67 % этанол; 0,2 М NaCl |
0,10 |
0,13 |
0,61 |
1,59 |
|
67 % этанол; 0,2 NaCl; 0,2 М уротропин |
0,23 |
0,25 |
1,13 |
1,21 |
|
58 % этанол; 0,2 М NaCl |
0,16 |
0,26 |
0,72 |
1,55 |
|
58 % этанол; 0,2 NaCl; 0,2 М уротропин |
0,29 |
0,51 |
1,08 |
1,32 |
|
58 % этанол; 0,2 М KI |
0,48 |
0,70 |
1,72 |
1,81 |
|
58 % этанол; 0,2 М KI + 0,01М KIO3 |
0,34 |
0,58 |
0,66 (1,12) |
0,69 |
В качестве примера в табл. 3 приведены кинетические и равновесные найденные параметры V0(H)ex и DрНr (DЕr/S), в различных по составу растворах для образца подсолнечного масла с кислотным числом около 3 мг КОН/г. Свод измеряемых на опыте потенциометрических значений Δ рН реакции и Δ Е реакции описывается уравнением
lgKr = A + 6 (DEr / S) + 12 DpHr, (13)
где Kr – смешанно-концентрационная константа равновесия.
Логарифм константы скорости линейно зависит от Δ рН реакции с наклоном, близким к 6, а от Δ Е реакции с наклоном, близким к 12 в определенном интервале температур (15–30), что подтверждает уравнение
(lg Kr/6) – (DEr / S) = 2 DpHr. (14)
Представлены закономерности по влиянию состава полярной фазы на V0 (H)ex (экстракции) в интервале 25–30 °С (NaAc) ≥ (NaCI + уротропин) > (NaCI), (KI + KIO3) < (KI), (NaCI) < (KI); по влиянию на DpHr: (NaCI + уротропин) > > (NaAc) > (NaCI), (KI + KIO3) < (KI), (NaCI) << (KI) для 25 °С и (NaAc)< (NaCI + + уротропин) < (NaCI), (KI + KIO3) < (KI), (NaCI) << (KI) для 35 °С. Общую суммарную реакцию можно описать уравнением
V0 (E)ex = k'"ef*Ck0. (15)
Вместе с тем однозначно оценить начальную скорость редокс-потенциометрического экстракционного процесса стадия III схема (6) (комплексный реагент KI + KIO3) особенно для масел с низким кислотным числом достаточно трудно, так как на этот параметр, кроме кислотного числа, заметно влияет природа (консистенция) растительного масла [6, с. 173–176].
В соответствии с линейными зависимостями DрНr (DEr) – Т-1, lg V0 (H) – (T-1) и lg V0 (E) – (T-1) найдены значения кажущейся теплоты реакции и значения эффективной теплоты активации, как отдельных стадий, так и суммарного процесса. Стадия собственно экстракции жирных кислот из масла в полярную фазу является эндотермической реакцией, тогда как объемная окислительно-восстановительная реакция I- + IO3- + H+ (Rj COOH) является экзотермической. Кажущаяся теплота стадии экстракции в 58 % этаноле возрастает в ряду реагентов (электролитов) (KI + KIO3) < (NaCI + уротропин) @ (NaAc) @ (NaCI) < (KI), а эффективная теплота активации экстракции, следовательно, в ряду(NaAc) < (KI) < (NaCI) < (NaCI + + уротропин) < (KI + KIO3).
Изменения теплоты активации в зависимости от химической природы реагента и состава испытуемого раствора происходят несимбатно соответствующим значениям теплоты процесса экстракции. Определение физико-химических параметров сложного экстракционного процесса, представленного на схеме (6), позволило оптимизировать условия редокс-потенциометрического определения кислотного числа. Результаты косвенных потенциометрических определений кислотного числа растительных масел с различными по природе реагентами удовлетворительно согласующиеся с отраслевыми нормативами погрешности и сходимости, свидетельствуют о практически полной экстракции высших жирных кислот из масла в водно-спиртовые растворы за 0,5–3 мин (в зависимости от величины дозы масла и кислотного числа).
Заключение
Получены научно значимые результаты для таких разделов аналитической химии, как теория окислительно-восстановительных аналитических реакций, косвенные методы анализа в редокс-потенциометрии, автоматические приборные комплексы. Научная ценность рассматриваемых результатов состоит также в расширении возможностей потенциометрического метода для изучения кинетики сложных, многостадийных химических процессов в неводных средах. Возможно непосредственное применение результатов в технохимическом контроле многих пищевых производств, исследовательской деятельности научно-технических организаций и в учебных курсах соответствующих профильных кафедр.



