Лишайник – уникальный организм, сочетающий в себе два компонента: гриб (микобионт) и одноклеточную зелёную водоросль и/или цианобактерию (фикобионт), которые симбиотически зависят друг от друга. Присутствие фотосинтезирующего компонента превращает грибной гетеротрофный организм в автотрофную ассоциацию, для существования которой необходимы лишь вода, воздух, минеральные соли и субстрат для прикрепления.
Физиология гриба и водоросли в талломе лишайника отличается от физиологии свободноживущих компонентов. Грибной мицелий служит для водоросли защитной оболочкой, предохраняющей ее от высыхания и позволяющей ей беспрепятственно получать необходимые для фотосинтеза воду и углекислый газ. Сам гриб, не способный синтезировать органические вещества, питается продуктами ассимиляции водоросли [1].
Компонентный состав лишайников весьма разнообразен и характеризуется наличием хитина, прочно связанного с глюканом, белковыми веществами, моносахарами (так называемый хитин-содержащий комплекс – ХСК), и специфическими лишайниковыми веществами, синтезируемыми водорослями. Показано, что ХСК проявляет себя как комплексообразователь – биодетоксикант, способный прочно связывать и легко транспортировать через мембраны экзогенные и эндогенные токсины, в том числе катионы тяжёлых металлов, радионуклиды, токсичные альдегиды и кетоны, канцерогены, шлаки. Эти свойства связаны в первую очередь с развитой поверхностью и доступностью функциональных групп ХСК (карбоксильных -СООН и ОН-групп кислотного характера и ацетамидной группы -NHСOCH3, NH2-группы основного характера).
ХСК из лишайников традиционно выделяют методами кислотно-щелочного гидролиза [2], при этом извлечение комплекса проходит в жёстких условиях и часть ХСК гидролизуется из-за разрыва связей между хитином и связанными с ним компонентами. Для извлечения лишайниковых кислот из талломов лишайников применяют методы экстракции органическими растворителями, а также метод сверхкритической флюидной экстракции (СКФЭ) диоксидом углерода [3, 4], при этом ХСК остается в кубовом остатке. Метод СКФЭ, основанный на принципах «зеленой химии», позволяет извлекать ХСК из слоевищ лишайников в малоизмененном виде, не разрушая ковалентные связи и сохраняя нативную структуру комплекса. Исследования биополимеров клеточной стенки грибов, в основном хитина [2], легли в основу разработки новой отрасли биотехнологии – получение этого аминополисахарида не из панцирей ракообразных, а на основе клеточных стенок мицелиальных грибов. Поскольку в талломах лишайников клеточная стенка грибного компонента составляет основную долю (90–98 %) клеточной стенки таллома, выделение ХСК из слоевищ лишайников и исследование их сорбционных свойств является актуальным.
Целью исследования явилось изучение влияния условий сверхкритической флюидной экстракции хитин-содержащего комплекса из талломов лишайников на его сорбционные свойства.
Материалы и методы исследования
Объектом исследования были выбраны наиболее распространенные в биотопах Северо-западного региона России лишайники Peltigera и Cladonia, отобранные в ходе экспедиции на о. Русский Кузов в акватории Белого моря. Эти лишайники характерны для данного региона и являются доминирующими видами и участвуют в формировании мохово-лишайникового покрова лесных сообществ.
Для выделения из них ХСК образцы подвергались СКФЭ с помощью системы MV-10ASFE (Waters, USA). Навеску образца (~2 г) помещали в автоклав объемом 10 мл и обрабатывали CO2 при скорости потока 93,6 мг/мин в течение заданного времени (20–60 минут). В ходе эксперимента варьировали температуру (40–80 °С) и давление (100–350 атм). Выход кубового остатка (ХСК) определяли высушиванием при 50 °С до постоянной массы.
Идентификацию ХСК (таблетки в KBr) проводили методом ИК-спектроскопии, спектры регистрировали на ИК-Фурье спектрометре IRAffinity-1 («Shimadzu», Япония) в диапазоне частот 400–4000 см-1, число сканирований 50, разрешение 4 см-1.
В табл. 1 представлены характеристические полосы поглощения хитина животного происхождения (рачок гаммарус) и хитин-содержащего комплекса растительного происхождения, выделенного из талломов лишайников родов Peltigera и Cladonia.
Таблица 1
ИК-спектры хитина и ХСК, выделенных из талломов лишайников
|
Тип колебаний |
Характеристические полосы поглощения, см-1 |
||
|
Хитин рачка гаммаруса [5] |
Peltigera |
Cladonia |
|
|
-NH2 |
3447 |
3404 |
3400 сл* |
|
OH…O (связ.) |
3300 |
3387 |
3381 |
|
NH (связ.) |
3041 |
2922 |
2910 |
|
NH (деформ.) |
1583 |
1560 |
1566 |
|
Протонированные аминогруппы NH3+ |
1622 |
1629 |
1635 |
|
CH2-, CH3- |
1433 |
1430 сл* |
1429 сл* |
|
C-O-H |
1419 |
1425 |
1417 |
|
O-H (деформ.) |
1373 |
1377 |
1373 |
|
О-Н |
1320 |
1319 |
1317 |
|
-C=O |
1258 |
1265 |
1260 |
|
C-N (вал.) |
1247 |
1207 |
1219 |
|
C–O |
1153 |
1168 сл* |
1168 сл* |
|
C–O–C |
1066 |
1072 |
1072 |
|
С1-Н (деформ.) в β-сахарах |
893 |
889 |
891 |
Примечание. * – слабовыраженные полосы.
Область 1700–800 см-1 (рис. 1, спектр 1, 2), называемая «отпечатками пальцев», имеет все пики, характерные для мономера хитина, а именно: 1655 см-1– N-H- связь (1637; 1645), 1554 см-1– С=О связь (1560; 1566), в области 900–1100 см-1 два пика поглощения, которые соответствуют эфирным связям в кольце и β-глюкозидной связи, соединяющей пиранозные кольца. Кроме того, присутствуют слабые полосы поглощения при 890–880 и 800–790 см-1, ответственные за деформационные колебания группы С–Н и пульсационные колебания пиранозного кольца в β-сахарах. В целом ИК-спектроскопическое исследование образцов ХСК, полученных из лишайников родов Peltigera и Cladonia, показало схожесть их химической структуры с хитином рачка гаммаруса (табл. 1, рис. 1).
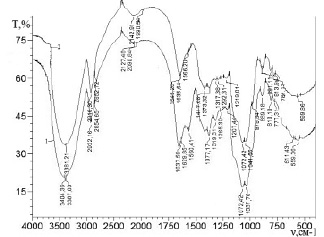
Рис. 1. ИК-спектры ХСК, выделенных из лишайников родов: 1 – Peltigera, 2 – Cladonia
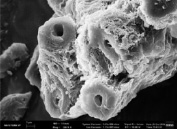
Применение диоксида углерода в сверхкритическом состоянии позволяет полностью и в щадящем режиме отделять ХСК от экстракта в противовес классическим методам, при этом выход ХСК достигает 96 %. Методом сканирующей электронной микроскопии были охарактеризованы морфологические особенности ХСК, выделенного методом СКФЭ (рис. 2). На микрофотографии ХСК отчетливо видны элементы клеточной стенки лишайников.

а) б)
Рис. 2. Электронные микрофотографии: а) ХСК, выделенный из лишайника Cladonia, б) ХСК, выделенный из лишайника Peltigera
Определение остаточного содержания метиленового голубого (МГ) и конго красного (КК) после их адсорбции на ХСК проводили колориметрическим методом на спектрофотометре UV-1800 Shimadzu (Япония), а катионов ртути – методом комплексонометрического титрования с роданидом калия [6]. Адсорбционную емкость ХСК (СЕ, сорбционная емкость, мг/г) находили по формуле
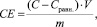
где С – концентрация адсорбтива в исходном растворе, мг/л;
Сравн.. – равновесная концентрация адсорбтива в растворе, мг/л;
V – объем раствора адсорбтива, взятого для контактирования с ХСК, л;
m – масса ХСК, г.
Результаты исследования и их обсуждение
Увеличение продолжительности СКФЭ с 10 до 20 мин (350 атм и 80 °С) влияет на сорбционную способность ХСК, что приводит к возрастанию СЕ комплекса на 11,4 %. Дальнейшее увеличение продолжительности экстракции до 30, 40 и 60 мин не приводит к изменению сорбционных свойств ХСК (сорбционная емкость 136–138,2 мг/г). Таким образом, для дальнейших экспериментов, в которых варьировались температура и давление СКФЭ, продолжительность процесса составляла 20 мин. Показано (рис. 3), что сорбционная емкость ХСК существенно не зависит от температуры и давления СКФЭ, сорбент с хорошими сорбционными характеристиками с экономической точки зрения целесообразно получать при температуре 40 °С и давлении 100 атм.
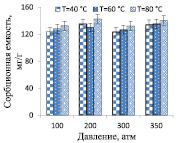
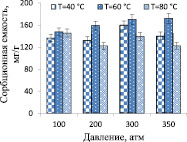
а) б)
Рис. 3. Влияние давления и температуры экстракции ХСК, выделенных из лишайников родов Cladonia (а) и Peltigera (б) на их сорбционные свойства по отношению к катионам ртути (II) (продолжительность экстракции 20 мин)
Установлено, что ХСК, выделенный из лишайников рода Peltigera, обладает более высокими сорбционными характеристиками в сравнении с выделенным из лишайника рода Cladonia, что, вероятно, обусловлено присутствием в его составе пигмента меланина, однако в ИК-спектре ХСК не обнаружены полосы поглощения основных групп пигмента (-СООН, -ОН, N-H в гетероцикле) в области спектра от 400 до 4000 см-1, что, возможно, связано с их перекрыванием полосами поглощения других функциональных групп ХСК.
Проведены исследования по адсорбции красителей на поверхности ХСК, выделенных СКФЭ из талломов лишайников родов Cladonia и Peltigera. Полученные комплексы проявляют высокую адсорбционную активность по отношению как МГ, так и КК. Положительно заряженный ион МГ адсорбируется на электроотрицательных (кислотного характера) адсорбентах, а КК – на электроположительных адсорбентах. Катионообменные свойства ХСК определяются присутствием двух типов функциональных групп: карбоксильных -СООН прочносвязанных аминокислот, а также ОН-групп кислотного характера. Для ХСК, выделенного из таллома лишайника рода Cladonia, сорбционная емкость по МГ составила 67,6, а по КК – 18 мг/г. Для лишайника рода Peltigera эти показатели выше и составили 172,4 и 46,0 мг/г соответственно. Таким образом, ХСК имеет полиамфолитную природу. Одной из важнейших характеристик сорбента, влияющих на эффективность сорбции, является адсорбционная поверхность. В табл. 2 приведены сравнительные данные удельной поверхности различных сорбентов по отношению к МГ.
Таблица 2
Удельная поверхность (м2/г) сорбентов различной природы (сорбат – МГ)
|
Литературные данные [7] |
Экспериментальные данные |
||||||
|
Акт. углерод. сорбент (УВС – А) |
Акт. уголь «Медисорб» |
Водорослевая клетчатка |
Хитин краба |
МКЦ |
ХСК, выделенные из лишайников |
||
|
L. digitata |
F. vesiculosus |
Peltigera |
Cladonia |
||||
|
723 |
160,0 |
50 |
21,0 |
7,23 |
1,4 |
310,3 |
121,0 |
ХСК, выделенный СКФЭ диоксидом углерода из талломов лишайников родов Cladonia и Peltigera, имеет достаточно высокую удельную поверхность в сравнении с другими сорбентами природного происхождения, но уступает по этому параметру полусинтетическим угольным сорбентам. Необходимо отметить, что ХСК имеет преимущество перед активированным углем, которое заключается в наличии дополнительных функциональных групп как кислотного, так и основного характера, следовательно, ХСК имеет полиамфолитную природу.
Заключение
Проведенное исследование показывает перспективность использования сверхкритической флюидной экстракции для выделения хитинсодержащих комплексов из талломов лишайников. Экспериментально подобраны условия экстракции ХСК из лишайников диоксидом углерода в сверхкритическом состоянии. Установлено, что продолжительность экстракции 20 мин, температура 40 °С и давление 100 атм являются оптимальными для выделения ХСК, обладающих высокими сорбционными свойствами относительно ионов ртути и органических красителей МГ и КК.
Работа выполнена в рамках научного проекта УрО РАН «Полифункциональные биологически активные материалы на основе компонентов растительного сырья» АААА-А18-118012390228-9 с использованием оборудования ЦКП НО «Арктика» САФУ и ЦКП КТ РФ-Арктика (ФИЦКИА РАН).



