Сахарная свекла в Российской Федерации является одной из основных экономически важных сельскохозяйственных культур. Её корнеплоды служат главным источником сырья для производства сахара в нашей стране. Побочные продукты переработки сахарной свеклы используются для кормления скота, получения пищевых кислот, хлебопекарных дрожжей, этилового спирта.
При выращивании сахарной свеклы первостепенное значение занимает защита посевов от сорняков с помощью гербицидов. Засоренность посевов часто носит сложный характер. В агроценозе сахарной свеклы насчитывается несколько десятков различных видов сорных растений. В период от появления всходов до смыкания рядков растения сахарной свеклы не в состоянии соперничать с сорняками. Поэтому очень важно в первые 4–6 недель вегетации проводить борьбу с сорной растительностью. В противном случае недобор урожая может составлять 25 % и более [1]. В настоящее время нет ни одного селективного для сахарной свеклы гербицида, который мог бы надежно защитить посевы от всего спектра двудольных сорняков, поэтому для достижения желаемого результата применяют различные гербицидные смеси [2]. Самыми широко используемыми препаратами против сорняков на сахарной свекле являются гербициды группы Бетанала и Лонтрел. Бетанал борется с однолетними двудольными сорняками, Лонтрел используется против трудноискоренимых сорняков (амброзия, осот и др.).
Несмотря на избирательность, растения сахарной свеклы испытывают стресс от применения гербицидов. Фитотоксическое воздействие бетаналов усиливается, если их наносят в жаркую погоду. Оптимальной для применения гербицидов бетанальной группы считается температура в пределах 16–25 °С, однако в полевых условиях не всегда удается ее выдержать. Механизм действия бетаналов проявляется в подавлении процессов фотосинтеза, что влечет нарушение дыхания, поступления питательных веществ; как следствие, замедляется синтез свободных аминокислот, необходимых для построения белка [3]. В качестве негативного воздействия гербицидов на начальной стадии вегетации обнаружено также снижение энергии корнеобразования [4]. Замедление прироста массы корнеплода и листьев у культуры под воздействием гербицидов в условиях теплой погоды может привести к существенному недобору урожая.
Одним из современных и действенных способов снижения фитотоксичности гербицидов на культурные растения является применение индукторов устойчивости – веществ, стимулирующих адаптивные возможности растений. Считается, что прибавка урожая в этом случае может складываться за счет проявления следующих эффектов: рострегулирущей активности вещества, повышения стрессустойчивости культуры к неблагоприятным факторам окружающей среды и антидотного действия по отношению к гербициду. Индукторы устойчивости находят все более широкое применение, исследования по изысканию новых препаратов продолжаются в нашей стране и за рубежом [5].
Целью настоящей работы являлся поиск индукторов устойчивости для вегетирующих растений сахарной свеклы от негативного воздействия гербицидов. Поиск осуществляли в ряду производных тиенопиридинов. Ранее нами успешно был проведен скрининг в рядах N-замещённых нафталин-2-сульфониламидов и производных пиридилгидразонов [6, 7].
Для достижения поставленной цели нами синтезирована серия соединений, которые относятся к ряду 3-аминотиено[2,3-b] пиридинов общей формулы I:
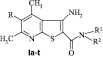
где R = H,CI; R1 = H, алкил, арил; R2 = алкил, арил, гетерил.
Синтез новых соединений осуществляли с использованием известных, а также оригинальных методик, описанных нами ранее [8]. Для доказательства структуры синтезированных веществ использовали элементный анализ, ИК-, и ЯМР 1Н и масс-спектры.
Материалы и методы исследования
Опыты по выявлению биоактивности синтезированных соединений осуществляли на сахарной свекле гибрида F1 Аллигатор.
Для первичной оценки веществ в лабораторных условиях определяли величину их рострегулирующего эффекта по методике проращивания семян в «рулонах». Повторность опыта четырёхкратная. В опыте предусмотрено замачивание семян в рабочем растворе испытуемого вещества и последующее выдерживание в течение 1 ч при 21–22 °С в отсутствии света. Затем семена раскладывались на увлажненную полосу фильтровальной бумаги (по 50 шт.), которая сворачивалась в рулон. Установленные в стаканы с водой рулоны термостатировались при 22–25 °С в течение 10 суток. По окончании опыта проводили биометрическую оценку растений. Данные учётов обрабатывали статистически (при уровне значимости Р = 0,95).
По результатам лабораторного опыта отбирали активные соединения для изучения в условиях поля. Исследования проводили на экспериментальном поле ВНИИ биологической защиты растений, г. Краснодар (центральная зона Краснодарского края). Климат умеренно континентальный, с мягкой зимой и жарким летом.
В 2016–2017 гг. для пропашных культур метеоусловия были вполне благоприятными в апреле, мае и июне. В июле-августе отмечалось значительное повышение среднесуточных температур воздуха (до 30 °С), которое выразилось в проявлении воздушной и почвенной засухи. В 2018 г. с апреля до конца августа количество выпавших осадков было значительно меньше средних многолетних (на 10–15 мм). Этот период сопровождался высокими температурами (до 30,2 °С).
Почва на опытном участке представлена черноземом выщелоченным, рНвод 7,5, pHсол.6,5; содержание гумуса в пахотном горизонте 2,5–3,2 %. Предшественник – озимая пшеница. Обработка почвы: зяблевая вспашка на глубину 30 см, покровное боронование в два следа, две культивации. Перед вспашкой внесение удобрений N90P90K90, гербициды вносились дважды – после появления всходов и в фазу 4–6 настоящих листьев.
Опыт на сахарной свекле был заложен по схеме:
вариант 1. Контроль – без обработки (ручная прополка);
вариант 2. Баковая смесь гербицидов;
вариант 3. Баковая смесь: гербициды + индуктор устойчивости 1d 20 г/га;
вариант 4. Баковая смесь: гербициды + индуктор устойчивости 1d 40 г/га;
вариант 5. Баковая смесь: гербициды + индуктор устойчивости 1g 20 г/га;
вариант 6. Баковая смесь: гербициды + индуктор устойчивости 1g 40 г/га;
вариант 7. Баковая смесь: гербициды + индуктор устойчивости 1n 20 г/га;
вариант 8. Баковая смесь: гербициды + индуктор устойчивости 1n 40 г/га.
Расход рабочего раствора 300 л/га.
Баковая смесь содержала гербициды, применяемые в технологии выращивания сахарной свеклы: Бетанал 22 – селективный гербицид против однолетних двудольных сорняков; Лонтрел® 300 – послевсходовый гербицид для борьбы с трудноискоренимыми сорняками; Зелек Супер – селективный системный гербицид против однолетних и многолетних злаковых сорняков.
Обрабатывали растения потенциальными индукторами устойчивости однократно в фазу 4–6 настоящих листьев сахарной свёклы, с этой целью в баковую смесь гербицидов вносили растворы изучаемых веществ. Баковая смесь имела следующий состав: Зеллек – Супер, КЭ 0,37 л/га, Бетанал 22, КЭ – 0,7 л/га, Лонтрел 300, ВР – 0,2 л/га (дозы гербицидов ниже на 30 % относительно рекомендованных). Тип засоренности на опытных участках был смешанный, с преобладанием злаковых (просо куриное, щетинник сизый и др.) и двудольных (марь белая, осот полевой, амброзия полыннолистная, щирица обыкновенная и др). Засоренность посева в начале вегетации составляла 52 шт/м2, в середине вегетации – 16 шт/м2, в конце вегетации – 10 шт/м2. Участки, обработанные баковой смесью гербицидов и смесью гербициды + индуктор устойчивости, по засоренности практически не отличались.
Опыт предусматривал измерение биометрических показателей корнеплодов и надземных органов растений, урожайности. Качество корнеплодов оценивали по сахаристости. В течение всего периода вегетации определяли содержание фотосинтетических пигментов в листьях растений. Для этого отбирали пробы на следующий день после обработки, затем через каждые 5 дней. Содержание хлорофилла а, хлорофилла b и каротиноидов измеряли на спектрофотометре Genesys 8 (Thermo Spectronic, Англия), в экстрактах 96 %-ным этанолом и последующим расчетом по формулам Лихтенталлера [9].
Контроль биометрических показателей осуществляли в фазу смыкания листьев в междурядьях и при уборке урожая, по полученным данным рассчитывали площадь ассимиляционной поверхности листьев, динамику накопления растениями сырой и абсолютно сухой биомассы [10]. Содержание сахара в корнеплодах определяли по ГОСТ Р 53036-2008 [11].
Урожай учитывали количественно-весовым методом: корнеплоды с учетных площадок подсчитывали и взвешивали. Статистическую обработку результатов исследований проводили с использованием НСР05 [12].
Результаты исследования и их обсуждение
В лабораторном опыте нами были обнаружены потенциально активные соединения Id, Ig, In, которые способствовали увеличению стеблей и корешков проростков сахарной свеклы на 12–19 % относительно контрольного варианта.
Названные соединения не фитотоксичны, совместимы с биопрепаратами. Отобранные вещества были изучены в условиях полевого опыта в 2016 г. в дозе 40 г/га, в 2017 г. – в двух дозах: 20 и 40 г/га, в 2018 г. – в дозе 20 г/га, поскольку эта доза оказалась предпочтительной. Результаты по урожайности сахарной свеклы и содержанию сахара представлены в табл. 1. Полученные данные свидетельствуют, что применение гербицидов снижает урожайность культуры (вариант эталон) в сравнении с контролем. Внесение в баковую смесь исследуемых индукторов устойчивости способствует увеличению размеров корнеплодов и урожайности сахарной свеклы как по сравнению с гербицидным эталоном, так и с контролем. Прибавка урожая к эталону составила от 3,53 до 6,58 т/га, что соответствует 6,55–11,9 %, причем доза 20 г/га была более эффективной.
Таблица 1
Урожайность сахарной свеклы гибрида F1 Аллигатор
|
Вариант |
Урожайность ц/га |
Прибавка к эталону |
Корнеплод |
Содержание сахара, % |
Выход сахара, т/ га |
|||
|
т/га |
% |
Длина, см |
Диаметр, см |
Масса, г |
||||
|
2016 г. |
||||||||
|
Контроль |
56,48 |
– |
– |
26,0 |
9,3 |
637,5 |
14,8 |
8,4 |
|
Эталон |
55,14 |
–1,24 |
–2,2 |
25,8 |
9,0 |
622,0 |
13,3 |
7,3 |
|
Id 40 г/га |
60,75 |
5,62 |
10,2 |
27,1 |
9,6 |
683,2 |
18,0 |
10,8 |
|
Ig 40 г/га |
59,95 |
4,80 |
8,7 |
27,2 |
9,6 |
674,5 |
15,0 |
9,0 |
|
In 40 г/га |
61,72 |
6,58 |
11,9 |
27,0 |
9,5 |
694,4 |
17,5 |
10,7 |
|
НСР0,5 |
1,32 |
0,20 |
– |
1,65 |
0,75 |
13,7 |
1,4 |
– |
|
2017 г. |
||||||||
|
Контроль |
57,67 |
– |
– |
26,3 |
9,3 |
635,4 |
15,2 |
8,8 |
|
Эталон |
54,50 |
–3,17 |
–5,5 |
25,8 |
9,1 |
620,3 |
13,45 |
7,3 |
|
Id 20 г/га |
61,10 |
6,59 |
12,1 |
29,7 |
9,3 |
687,6 |
17,65 |
10,80 |
|
Id 40 г/га |
60,42 |
5,92 |
10,75 |
28,6 |
9,2 |
679,9 |
17,5 |
10,65 |
|
Ig 20 г/га |
58,04 |
3,53 |
6,55 |
33,8 |
9,4 |
653,3 |
17,6 |
10,25 |
|
Ig 40 г/га |
58,23 |
3,72 |
6,85 |
28,8 |
9,8 |
655,2 |
17,7 |
10,35 |
|
In 20 г/га |
60,52 |
6,01 |
11,0 |
31,2 |
9,45 |
680,6 |
17,65 |
10,70 |
|
In 40 г/га |
60,84 |
6,33 |
11,6 |
30,9 |
9,5 |
684,3 |
17,60 |
10,69 |
|
НСР0,5 |
1,23 |
0,24 |
– |
1,75 |
0,8 |
14,2 |
1,5 |
– |
|
2018 г. |
||||||||
|
Контроль |
54,82 |
– |
– |
26,3 |
9,3 |
635,41 |
15,0 |
8,2 |
|
Эталон |
52,42 |
– 2,40 |
–4,4 |
25,7 |
9,2 |
620,44 |
13,0 |
6,8 |
|
Id 20 г/га |
55,80 |
6,16 |
11,8 |
27,1 |
9,6 |
694,27 |
17,6 |
10,3 |
|
Ig 20 г/га |
56,49 |
4,07 |
7,8 |
27,0 |
9,5 |
674,59 |
14,9 |
8,5 |
|
In 20 г/га |
58,32 |
5,90 |
11,3 |
28,9 |
9,5 |
690,32 |
15,0 |
8,7 |
|
НСР0,5 |
1,21 |
0,9 |
– |
1,4 |
0,7 |
13,0 |
1,3 |
– |
В то же время все препараты существенно увеличивали сахаристость корнеплодов как по отношению к гербицидному эталону, так и по отношению к контролю. Их применение позволило повысить процентное содержание сахара по отношению к гербицидному эталону на 1,6–4,6 %, а выход сахара на 1,7–3,5 т/га.
Из-за ограниченности объема статьи мы приводим данные по биометрии растений сахарной свеклы в фазе смыкания листьев в междурядьях за 2017 г. (табл. 2). Использование испытуемых соединений существенно повлияло на формирование надземных органов культуры. Высота растений увеличилась на 2,15–5,8 см; число листьев – на 2,0–4,5 шт; площадь листьев – на 1,11–4,30 дм2 в сравнении с гербицидным эталоном. Увеличение параметров надземных органов повлекло увеличение биомассы и массы сухого вещества. Биомасса надземных органов увеличилась на 10,9–43,0 г; сухого вещества – на 2,6–10,9 г. Многие перечисленные показатели существенно превышают таковые также в контрольном варианте.
Таблица 2
Биометрия сахарной свеклы в фазе смыкания листьев в междурядьях гибрида F1 Аллигатор, 2017 г. (на одно растение)
|
Вариант |
Высота растений, см |
Число листьев, шт |
Сырая масса листьев, г |
Сухая масса листьев, г |
Сырая масса листовых пластинок, г |
Площадь листьев, дм2 |
Корнеплод |
||
|
длина, см |
диаметр, см |
масса, г |
|||||||
|
Контроль |
34,1 |
14,7 |
83,20 |
20,82 |
47,10 |
8,05 |
25,3 |
8,2 |
587,60 |
|
Эталон |
32,7 |
14,3 |
81,47 |
20,35 |
46,12 |
7,81 |
24,5 |
8,0 |
567,04 |
|
Id 20 г/га |
36,2 |
16,3 |
96,38 |
24,10 |
54,58 |
9,28 |
28,7 |
9,3 |
650,40 |
|
Id 40 г/га |
36,1 |
16,0 |
94,60 |
23,67 |
53,50 |
9,10 |
27,8 |
8,8 |
644,40 |
|
Ig 20 г/га |
38,6 |
18,7 |
124,60 |
31,23 |
70,51 |
11,92 |
31,3 |
9,4 |
647,92 |
|
Ig 40 г/га |
36,9 |
17,2 |
110,41 |
27,63 |
62,44 |
10,58 |
27,2 |
9,3 |
633,70 |
|
IIn 20 г/га |
35,5 |
16,6 |
99,30 |
24,87 |
56,22 |
9,55 |
29,1 |
9,25 |
661,43 |
|
In 40 г/га |
35,2 |
16,1 |
92,40 |
23,10 |
52,29 |
8,90 |
28,7 |
9,1 |
659,31 |
|
НСР05 |
4,7 |
2,4 |
6,3 |
3,4 |
8,0 |
2,1 |
3,15 |
1,3 |
12,5 |
Использование в качестве индукторов устойчивости соединений Id, Ig, In стимулировало не только рост и развитие надземных органов, но повлияло и на содержание фотосинтетических пигментов в листьях растений. В большей степени это влияние сказалось на содержании хлорофиллов а и b, которое в опытных вариантах было значительно выше, чем в гербицидном эталоне (рис. 1, 2). Увеличение содержания пигментов свидетельствует о положительном влиянии индукторов устойчивости на иммунную систему культуры.
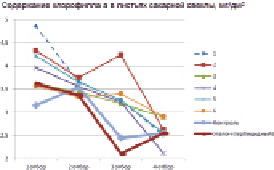
Рис. 1. Содержание хлорофилла а в листьях сахарной свеклы, мг/дм2 (2017 г.): (1 – соед. Id 20 г/га; 2 – соед. Id 40 г/га; 3 – соед Ig, 20 г/га; 4 – соед. Ig 40 г/га; 5 – соед. In 20 г/га; 6 – соед. In 40 г/га)
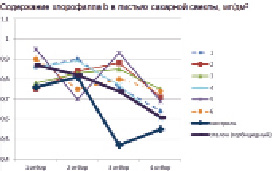
Рис. 2. Содержание хлорофилла b в листьях сахарной свеклы, мг/дм2 (2017 г.): (1 – соед. Id 20 г/га; 2 – соед. Id 40 г/га; 3 – соед Ig, 20 г/га; 4 – соед. Ig 40 г/га; 5 – соед. In 20 г/га; 6 – соед. IIIn 40 г/га)
Заключение
Таким образом, при обработке растений сахарной свеклы новыми индукторами устойчивости совместно с баковой смесью гербицидов получено существенное и достоверное повышение урожая в сравнении с гербицидным контролем.
Найденные нами новые действующие вещества могут послужить основой создания отечественных индукторов устойчивости, способных уменьшить гербицидный стресс на растения сахарной свеклы, увеличить адаптивные возможности культуры и тем самым сохранить урожай.
Работа выполнена при поддержке гранта РФФИ № 16-44-230459 р_а и администрации Краснодарского края.



