Подземные воды повышенной минерализации, приуроченные к морским побережьям, выявлены на юге Приморского края при проведении поисково-разведочных работ на углеводороды и термальные воды. Пробуренные в процессе работ скважины глубиной более 2,5 км позволили обнаружить ранее не известный в Приморье уникальный тип вод, такой как проявление слабых рассолов Речица [1].
Известно, что подземные воды являются естественной средой обитания различных микроорганизмов. Микробные сообщества являются важным биотическим фактором, активно влияющим на процессы формирования химического состава глубинных вод, минералообразования и метаморфизма горных пород. Высокая концентрация солей в подземных водах способствует сохранению в них уникальных галофильных бактерий. Проведенные ранее микробиологические исследования выявили присутствие в сероводородных подземных водах источника Усть-Качка (Пермский край) и содово-соленых озерах Забайкалья и Монголии сульфатредуцирующих, галоалкалофильных бактерий рода Desulfovibrio sp., Desulfomicrobium sp., Halanaerobium hydrogeniformans, а также микроорганизмов-гидролитиков, участвующих в разложении органического вещества [2–4]. Исследование микробных сообществ из экстремальных мест обитания представляет большой интерес, так как значительно расширяет представление о распространении, структуре, численности различных функциональных групп и разнообразии галофильных бактерий. Несмотря на многолетние наблюдения за температурой и химическим составом подземных рассолов проявления Речица [5–6], сведения о населяющих их микроорганизмах отсутствуют.
В связи с ограниченной информацией целью работы было изучить распространение, структуру и динамику численности различных эколого-трофических групп бактерий, принимающих участие в биогеохимических циклах в холодных подземных рассолах проявления Речица.
Материалы и методы исследования
Объектами исследования являлись холодные подземные воды рассолов проявления Речица, расположенные в восточной части Уссурийского залива, на побережье бухты Суходол, в пределах Партизанской впадины Южно-Приморского прогиба (рис. 1). Пробы минеральных вод отбирали, соблюдая условия стерильности из самоизливающейся скважины № 2ПР в стеклянные бутыли объемом 200 мл в трех повторностях. Отбор проб воды осуществляли в разное время года (июль 2012 г., май 2013 г., июль 2013 г., сентябрь 2013 г.). Пробы воды до лаборатории хранили в холодильнике не более суток. Нестабильные показатели химического состава (рН, температура) измерялись непосредственно на месте.
Рис. 1. Карта-схема расположения скважины подземных высокоминерализованных вод проявления Речица, Приморский край
Для выявления и культивирования бактерий использовали традиционные методы практической микробиологии [7]. Численность различных физиологических групп бактерий определяли методом предельных разведений. Учет численности вели по методу наиболее вероятных чисел (по Мак-Креди). Количество различных физиологических групп бактерий определяли на специально подобранных селективных средах [8] с добавлением в качестве основы подземных вод. Численность бактерий-азотфиксаторов учитывали на среде Эшби, аммонификаторов – определяли на среде Зенгена, количество бактерий, осуществляющих автотрофную нитрификацию, определяли на средах Сориано и Уокера (аммоний-окисляющие) и Уотсона и Менделя (нитрит-окисляющие бактерии), гетеротрофных нитрификаторов выделяли на среде следующего состава (г/л): сухой питательный бульон – 3,5; (NH2)SO4 – 0,5; вода дистиллированная – 1 л. Численность денитрифицирующих бактерий учитывали на среде Гильтая, тионовых и сульфатредуцирующих бактерий на средах Бейринка и Постгейта С с лактатом натрия, гетеротрофных железо и марганец окисляющих микроорганизмов определяли по Krumbein, 1971, количество автотрофных железоокисляющих бактерий учитывали на среде Летена, гетеротрофных железо и марганец восстанавливающих бактерий определяли на среде Бромфильда с добавкой в качестве источников окисленных форм железа и марганца FeCl3, Fe(OH3)3, MnO2 [8]. Численность сапрофитных гетеротрофных бактерий учитывали на питательной среде МПА. Микроорганизмы выращивали в термостате при температуре 25 °С.
Морфологию, размеры, подвижность, спорообразование выделенных чистых культур бактериальных клеток исследовали с использованием светового микроскопа AxioStar plus (Carl Zeiss, Германия), оснащенного фотодокументирующей системой Axiovision и фазово-контрастной приставкой (x1000). Тип клеточной стенки бактерий определяли по Граму [9]. Также оценивали способность выделенных чистых культур бактерий к росту при различных значениях температуры, рН и содержании NaCl. Для этого питательные твердые среды МПА с различным рН (5,0; 6,0; 7,0; 8,0; 9,0; 10,0) и содержанием NaCl (1 %; 3 %; 6 %; 8 %; 10 %; 15 %; 20 %; 25 %) засевали штрихом выделенные культуры и инкубировали в термостате при температуре 25 °С в течение трех дней. Оптимальные температуры роста штаммов выявляли путем посева выделенных культур штрихом на МПА с последующим инкубированием при температурах 4 °С; 20 °С; 25 °С; 35 °С; 42 °С; 50 °С. В зависимости от наличия и интенсивности роста микроорганизмов делали вывод о диапазоне роста бактерий. Идентификацию микроорганизмов до рода проводили согласно определителю бактерий Берджи [10].
Результаты исследования и их обсуждение
Результаты исследования химического состава, проведенного ранее, показали, что воды рассолов являются холодными (10,3–12,1 °С), нейтральными (6,74–7,63), по величине общей минерализации относятся к высокоминерализованным водам (50,4 г/л). Подземные рассолы имеют хлоридный натриево-кальциевый состав. Характерной особенностью прибрежных рассолов проявления Речица являются повышенные концентрации Ca (10,4 г/л), Mg (1,9 г/л) и SO4-иона (2,9 г/л). Воды рассолов значительно обогащены стронцием (171,5–206,8 мг/л), марганцем (4,93–5,37 мг/л) и железом (0,95–1,35 мг/л) [6–7].
Результаты микробиологических исследований показали, что в подземных рассолах проявления Речица во все периоды наблюдений отмечен небольшой состав эколого-трофических групп бактерий (4–5 из 13) и их низкая численность, которая варьировала в среднем от 0,8×102 до 2,6×102 кл/мл (таблица). Подобные низкие количества микроорганизмов различных физиологических групп были отмечены нами ранее в различных геохимических типах подземных вод Дальнего Востока России [11–12]. Вероятно, высокая соленость и низкая температура подземных вод способствовала выживаемости в них наиболее устойчивых к экстремальным условиям среды микроорганизмов. В структуре микробных сообществ во все сезоны исследования преобладали тионовые и сапрофитные бактерии, а также в летний период сульфатредуцирующие микроорганизмы, которые принимали участие в биогеохимических циклах углерода и серы. Численность хемолитотрофных тионовых бактерий была высока в течение всего периода исследований и изменялась от 7,4×102 до 3,6×103 кл/мл, что указывает на происходящие в подземных водах процессы окисления восстановленных соединений серы с участием микроорганизмов. Количество сульфатредуцирующих бактерий, осуществляющих восстановление сульфатов до сероводорода, было невысоко и достигало наиболее высоких значений в летний период (таблица), что, возможно, связано с низким количеством органического углерода, необходимым для развития этим микроорганизмам [13]. Численность сапрофитных бактерий в рассолах отличалась при добавлении различных концентраций соли и варьировала от 0 до 7,8×102 кл/мл, и была выше в средах с добавлением 10 % NaCl в течение всего периода исследований (таблица), что, вероятно, связано с адаптацией бактерий к определенной концентрации солей в подземных водах. При добавлении 20 % NaCl в среды, роста сапрофитных бактерий отмечено не было, что позволяет отнести выделенные микроорганизмы к умеренным галофилам, т.е. организмам, которые развиваются в средах с содержанием NaCl 5–15 % [14]. Довольно высокая численность сапрофитных бактерий, отмеченная в рассолах, свидетельствует о происходящих в водах процессах окисления органических веществ с участием микроорганизмов, что может оказывать влияние на газовый состав вод. Сапрофитные бактерии, выделенные из рассолов на среде МПА формировали колонии четырех основных типов: 1 – мелкие, плоские, светло-серые колонии диаметром 2–4 мм (рис. 2, a), 2 – плоские, матовые колонии молочного цвета диаметром 4–6 мм, 3 – светло-бежевые выпуклые, блестящие колонии с ровными краями, диаметром 3–4 мм, 4 – оранжевые плоские и выпуклые колонии диаметром 2–9 мм (рис. 2, б). Известно, что многие галофильные бактерии имеют желтую, оранжевую или пурпурную окраску. Это объясняется высоким содержанием в их тканях каротиноидов, которые защищают бактерии от повреждающего действия УФ-излучения [14]. Микроскопирование колоний показало, что выделенные бактерии были в основном представлены грамположительными крупными длинными палочками V-образной конфигурации 2,8–5,2 мкм в длину (рис. 3, а), мелкими грамположительными палочками 0,4–2,1 мкм в длину (рис. 3, б) и грамположительными достаточно крупными палочками 1,5–2,5 мкм в длину (рис. 3, в). Идентификация выделенных штаммов сапрофитных бактерий показала, что среди изолятов значительно доминировали грамположительные палочковидные бактерии рода Microbacterium sp., Halobacterium sp. и Bacillus sp.
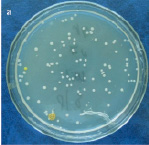
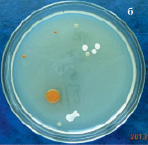
Рис. 2. Типы колоний сапрофитных бактерий, выделенных из рассолов проявления Речица в 2012–2013 гг.
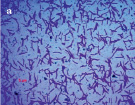
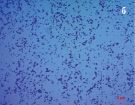
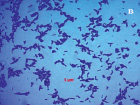
Рис. 3. Морфология выделенных сапрофитных бактерий из подземных рассолов проявления Речица
Также в рассолах были отмечены в небольшом количестве бактерии, осуществляющие гетеротрофную, автотрофную нитрификацию и денитрификацию (только в весенний период) и окисление железа и марганца (таблица), что свидетельствует об участии микроорганизмов в биогеохимических циклах N, Fe и Mn в подземных водах. В цикле железа и марганца преобладали гетеротрофные марганецвосстанавливающие бактерии (0–1,2×102 кл/мл), которые обладали способностью восстанавливать четырехвалентный марганец до двухвалентного.
Численность различных физиологических групп бактерий в подземных рассолах проявления Речица (скважина № 2 ПР)
|
Функциональные группы бактерий: (кл/мл) |
Даты отбора проб воды: |
|||
|
07.2012 |
05.2013 |
07.2013 |
09.2013 |
|
|
Цикл углерода: |
||||
|
Сапрофитные бактерии + 0 % NaCl |
0 |
0 |
0 |
0 |
|
Сапрофитные бактерии + 1 % NaCl |
0 |
1,0×102 |
0 |
0 |
|
Сапрофитные бактерии + 3 % NaCl |
1,0×102 |
2,5×102 |
1,8×102 |
0 |
|
Сапрофитные бактерии + 5 % NaCl |
2,3×102 |
3,4×102 |
3,1×102 |
2,0×102 |
|
Сапрофитные бактерии + 10 % NaCl |
5,6×102 |
6,3×102 |
7,8×102 |
4,3×102 |
|
Сапрофитные бактерии + 20 % NaCl |
0 |
0 |
0 |
0 |
|
Цикл азота: |
||||
|
Азотфиксирующие |
0 |
0 |
0 |
0 |
|
Аммонификаторы |
0 |
0 |
0 |
0 |
|
Автотрофные нитрификаторы |
0 |
0,2×102 |
0 |
0 |
|
Гетеротрофные нитрификаторы |
0 |
1,2×102 |
0 |
0 |
|
Денитрифицирующие |
0 |
0,5×102 |
0 |
0 |
|
Цикл серы: |
||||
|
Тионовые |
2,5×103 |
8,3×102 |
3,2×103 |
7,4×102 |
|
Сульфатредуцирующие |
1,2×102 |
0 |
0,7×102 |
0 |
|
Цикл железа, марганца: |
||||
|
Железоокисляющие автотрофы |
0 |
0 |
0 |
0 |
|
Железоокисляющие гетеротрофы |
0 |
0 |
0,1×102 |
0,3×102 |
|
Железовосстанавливающие |
0 |
0 |
0 |
0 |
|
Марганецокисляющие гетеротрофы |
0,3×102 |
0 |
0 |
0,5×102 |
|
Марганецвосстанавливающие |
0,5×102 |
0 |
1,2×102 |
0 |
|
Средняя численность бактерий |
1,9×102 |
1,3×102 |
2,6×102 |
0,8×102 |
На выходе подземных рассолов из скважины наблюдалось формирование микробных сообществ, основу в которых составляли зеленые микроводоросли (рис. 4), также были распространены диатомовые водоросли и различные физиологические группы бактерий с преобладанием гетеротрофных сапрофитных микроорганизмов.
Также у выделенных штаммов сапрофитных бактерий были изучены особенности физиологии роста. Исследования показали, что температурные пределы роста тестируемых изолятов составили 4,0–35 °С, с оптимумом в 25 °С, что позволяет отнести выделенные бактерии к мезофильным формам. Оптимум солености для выделенных штаммов составил 8–10 %, верхний предел роста отмечался при концентрации NaCl в среде 15 %. рН диапазон роста у выделенных изолятов составил 5,0–9,0 с оптимумом 6,0–7,0, что позволяет отнести выделенные бактерии к нейтрофильным формам.
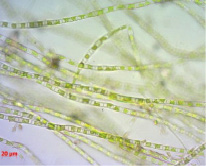
Рис. 4. Зеленые микроводоросли, формирующие основу микробного мата в подземных рассолах проявления Речица
Заключение
Проведенные исследования показали, что экстремальные условия подземных рассолов (такие как низкая температура, высокая минерализация и соленость вод, низкие концентрации органического вещества) оказывают влияние на распространение, структуру и количество различных эколого-трофических групп бактерий, что выражается в небольшом составе функциональных групп микроорганизмов и их низкой численности, снижении биоразнообразия бактерий. В структуре микробных сообществ доминировали тионовые и сапрофитные бактерии, что указывает на происходящие в подземных водах процессы окисления органических веществ и восстановленных соединений серы с участием микроорганизмов. Выделенные изоляты сапрофитных бактерий проявляли рост в широком диапазоне температур, рН, концентраций NaCl, что позволяет использовать эти микроорганизмы в биотехнологии с целью биодеградации органических загрязняющих веществ, а также как источники холодоактивных ферментов в промышленности.
Работа выполнена при поддержке гранта ДВО № 18-5-089.



