Композиционные соединения на основе оксидов металлов, принадлежащих разным семействам элементов, являются объектом длительного и интенсивного изучения, поскольку обладают рядом важных технических свойств. Особо следует отметить оксидные соединения переходных металлов, таких, например, как ванадий, способных образовывать фазы с переменной валентностью. Изучение таких материалов связано с их уникальным строением. В частности, в исследовании [1] отмечено, что в шпинели состава AlV2O4 (в этом случае ванадию приписывают формальную степень окисления +2,5) возможен фазовый переход при температуре порядка 700 K, сопровождающийся проявлением аномалий транспортных и магнитных свойств, уточняется, что это соответствует переходу зарядового порядка с формированием зарядовой фрустрации. В работе [2] для такого соединения установлено образование кластеров с зарядовым, атомным и орбитальным упорядочением. Применение соединений на основе системы Al-V-O связано, в первую очередь, с их высокой каталитической активностью в ряде процессов [3], таких как превращение метанола в формальдегид [4], поликонденсация индола [5], дегидратация глицерина в акролеин [6], крекинг н-гептана [7] и других. Известно также использование соединений системы Al-V-O в качестве источников питания на основе алюминия [8; 9], материалов литий-ионных аккумуляторов [10], для получения селективного диода «металл-изолятор-металл» [11].
Синтез материалов на основе разновалентных катионов может быть осуществлен различными способами. Следует отметить, что получение подобных материалов по технологии, аналогичной керамической, требует длительной термообработки при относительно высоких температурах. Например, в работе [12] синтез шпинели состава AlV2O4 проводили из оксидов ванадия (III) V2O3, ванадия (V) V2O5 и металлического Al в кварцевой ампуле при температуре 1100 °С в течение 150 часов. Процесс формирования шпинели может быть представлен уравнением (1)
V2O3 + V2O5 + 2Al = 2AlV2O4. (1)
С целью уменьшения энергоемкости процесса синтеза применяют ряд технологических приемов. При этом возможно использование гидротермального метода с применением в качестве органического прекурсора этанола [10], щавелевой кислоты [9], этиленгликоля [3]. Наноразмерные композиционные материалы в системе Al2O3/V2O5 могут быть получены с использованием ультразвукового воздействия [4], золь-гель методики [5]. Из приведенных примеров видно, что синтез материалов в системе Al-V-O сложен в аппаратурном обеспечении либо длителен по времени и является энергоемким.
Целью работы являлось изучение возможности синтеза композиционных материалов в системе Al-V-O с применением ряда технологических приемов, в том числе энергосберегающих, характеристика структурных особенностей и каталитической активности материалов в реакции окислительной деструкции органического красителя в присутствии пероксида водорода.
Материалы и методы исследования
Синтез материалов осуществляли по методике, элементы которой обсуждены в работе [13], с применением следующих технологических приемов.
1. Растворяли метаванадат аммония NH4VO3 в дистиллированной воде с получением раствора с концентрацией 0,3 моль/л. Добавляли 60 г лимонной кислоты C6H8O7. Наблюдали процесс растворения с выделением газообразных продуктов реакции ее восстановления. Цвет раствора последовательно изменялся на зеленый и сине-фиолетовый. После полного растворения кислоты полученный раствор переносили в сосуд из нержавеющей стали, добавляли порошок металлического алюминия и нагревали до полного разложения органической составляющей смеси (образец 1). Для изучения влияния термической обработки на фазовый состав образцы подвергали дополнительной термообработке в течение 1 часа при температурах 700 °С (образец 2), 900 °С (образец 3).
2. Растворяли метаванадат аммония NH4VO3 в дистиллированной воде с получением раствора с концентрацией 0,3 моль/л в присутствии серной кислоты. Добавляли 10 г лимонной кислоты C6H8O7. Затем вводили концентрированный раствор аммиака (40 мл) и раствор нитрата алюминия Al(NO3)3. Полученный раствор помещали в сосуд из нержавеющей стали и нагревали до полного разложения органической составляющей смеси (образец 4). Для изучения влияния термической обработки на фазовый состав образцы подвергали дополнительной термообработке в течение 1 часа при температурах 400 °С (образец 5), 700 °С (образец 6).
Фазовый состав полученных материалов изучали на дифрактометре ARL X’TRA, использовали Cu-Kα излучение. Определение площади поверхности проводили методом БЕТ на аппарате ChemiSorb 2750 в Центре коллективного пользования «Нанотехнологии» Южно-Российского государственного политехнического университета (НПИ) имени М.И. Платова.
Изучение каталитической активности синтезированных материалов проводили на модельном растворе метилового оранжевого по методике, описанной в [14]. При этом использовали раствор метилового оранжевого с концентрацией 40 мг/л. В ходе выполнения анализа 10 мл исходного раствора помещали в плоскодонную колбу, добавляли 0,0010 г катализатора и 2 мл раствора пероксида водорода с концентрацией 3 % (масс.). Определение концентрации метилового оранжевого в растворе проводили фотоколориметрическим методом с помощью прибора КФК-2-УХЛ 4,2.
Результаты исследования и их обсуждение
Рентгенограммы нескольких синтезированных образцов приведены на рис. 1, 2.
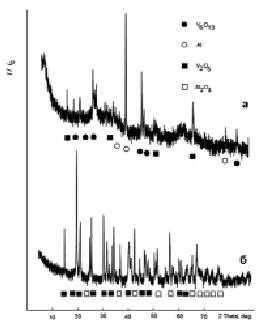
Рис. 1. Дифрактограммы образцов системы Al-V-O: а – образец 1, б – образец 3
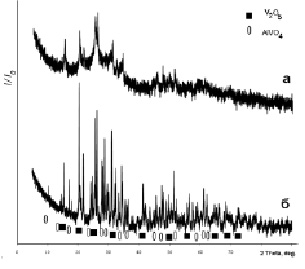
Рис. 2. Дифрактограммы образцов системы Al-V-O: а – образец 4, б – образец 6
Фазовый состав образцов может быть представлен следующим образом (таблица).
Фазовый состав образцов
|
№ образца |
Состав |
Параметры решетки |
Соотношение фаз |
Примесные фазы |
|
1 |
V2O5 |
a = 1,1516 нм, b = 0,3566 нм, c = 0,4373 нм, |
V2O5 : V6O13 = 1:4 |
– |
|
V6O13 |
a = 1,192 нм, b = 0,3679 нм, c = 1,014 нм, |
|||
|
Al |
a = 0,4056 нм |
|||
|
2 |
V2O5 |
a = 1,1516 нм, b = 0,3566 нм, c = 0,4373 нм |
V2O5:V6O13 = 3:2 |
– |
|
V6O13 |
a = 1,192 нм, b = 0,368 нм, c = 1,014 нм |
|||
|
Al |
a = 0,4050 нм |
|||
|
3 |
V2O5 |
a = 1,1516 нм, b = 0,3566 нм, c = 0,4373 нм |
V2O5:Al2O3 = 2:1 |
|
|
Al2O3 |
a = 0,4761 нм, c = 1,300 нм |
|||
|
4 |
V2O5 |
a = 1,1516 нм, b = 0,3571 нм, c = 0,4383 нм |
– |
Al2(SO4)3 |
|
5 |
V2O5 |
a = 1,1544 нм, b = 0,3571 нм, c = 0,4383 нм |
V2O5:AlVO4 = 4:1 |
Al2(SO4)3 |
|
AlVO4, |
a = 0,6532 нм, b = 0,7450 нм, c = 0,9123 нм |
|||
|
6 |
V2O5 |
a = 1,1512 нм, b = 0,3564 нм, c = 0,4368 нм |
V2O5:AlVO4 = 2:1 |
Al2(SO4)3 |
|
AlVO4 |
a = 0,6532 нм, b = 0,7450 нм, c = 0,9123 нм |
Согласно полученным результатам, формирование материалов (образцы 1-3) без дополнительной термообработки не приводит к положительному результату. В системе остается непрореагировавший металлический алюминий.
Фазообразование в изучаемой системе (образцы 1–3) может быть представлено следующим образом.
Разложение метаванадата аммония протекает с образованием оксида ванадия (V) по схеме (2):
2NH4VO3 = 2NH3 + V2O5 + H2O. (2)
При введении лимонной кислоты протекает процесс перехода оксида ванадия (V) в оксид ванадия (III)–(V). Лимонная кислота при этом выступает в качестве восстановителя (уравнение 3):
3V2O5 + 2C2H8O7 =
= V2O3·2V2O5 + 4CO2 + 8H2O. (3)
Данная реакция начинает протекать, вероятно, еще в растворе. Окраска раствора меняется с зеленого на синий, затем – на фиолетовый и снова на зеленый. При этом часть оксида V2O5 остается в неизменном виде и входит в состав продукта реакции.
Прокаливание образца при температуре 700 °С сопровождается увеличением степени окристаллизованности фаз и соотношения количества оксидных фаз V2O5:V6O13, в целом фазовый состав образца не изменяется.
При термообработке при температуре 900 °С в реакцию вступает введенный металлический алюминий и формируется композиционный материал состава V2O5 – Al2O3 (уравнение 4):
V2O3·2V2O5 + 2Al + 2,5O2 = 3V2O5 + Al2O3. (4)
Изменение технологии приводит к смене механизма реакции. Для образцов 4–6 процесс образования композиционного материала может быть представлен следующим образом. Разложение метаванадата аммония с образованием оксида ванадия (V) по реакции (2), затем взаимодействие V2O5 с нитратом алюминия в присутствии серной кислоты (уравнение 5):
V2O5 + 4Al(NO3)3 + 3H2SO4 =
= 2AlVO4 + Al2(SO4)3 + 3H2O + 6N2 + 15O2. (5)
Термообработка материала при температуре 700 °С приводит к разложению нитрата алюминия с образованием оксида (уравнение 6):
2Al(NO3)3 = Al2O3 + 6NO2 + 1,5O2, (6)
который затем взаимодействует с оксидом ванадия (V) с формированием ванадата алюминия (уравнение 7):
Al2O3 + V2O5 = 2AlVO4. (7)
Полученный порошок темно-серого цвета при последующей термообработке приобретал оранжевую окраску, характерную для оксидных соединений пятивалентного ванадия.
Следует отметить, что проведение реакции в присутствии металлического алюминия не сопровождается образованием AlVO4.
Изучение каталитической активности синтезированных материалов проводили на примере реакции окислительной деструкции органического красителя метилового оранжевого в присутствии пероксида водорода. В ходе проведенного исследования установлено, что образец 1 проявляет исключительно высокую каталитическую активность в изучаемом процессе: порядка 75 % метилового оранжевого было удалено из системы в течение первых 2 минут от начала реакции. Этот результат позволяет сделать вывод о перспективности применения синтезированных материалов в системах водоподготовки, в частности промышленных предприятий, использующих в производственных циклах органические красители.
Выводы
Изучен процесс фазообразования в сложной оксидной системе V-Al-O. Показана принципиальная возможность синтеза композиционного материала состава V2O5 – Al2O3 с применением в качестве органического восстановителя лимонной кислоты C2H8O7. Данная методика проста в аппаратурном обеспечении и позволяет получать заданное соединение при более низкой температуре термообработки, с меньшей продолжительностью по сравнению с используемыми в настоящее время технологическими приемами синтеза аналогичных материалов. Предложен механизм формирования фазового состава образцов в процессе синтеза и дополнительной термообработки при температурах 700 и 900 °С. Полученные результаты могут быть полезны для выбора материалов, перспективных для применения в системах очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.



