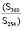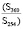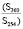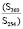Уровень и масштабы техногенного загрязнения городских лесонасаждений, особенно в промышленно развитых регионах, постоянно возрастают. Это сопровождается снижением устойчивости лесонасаждений, ростом пораженности древесного яруса насекомыми-вредителями и болезнями и постепенной деградацией древесных растений, особенно хвойных. В условиях урбанизации городские древесные насаждения в основном подвергаются воздействию аэротехногенных выбросов, особенно вблизи автомагистралей с интенсивным потоком автотранспорта. По данным ряда авторов, в составе аэротехногенных выбросов автотранспорта преобладают оксид углерода (70 %), углеводороды (19 %), оксиды азота (9 %) [1]. Они вызывают повреждение ассимиляционного аппарата городских лесонасаждений [2]. Ранее нами было обнаружено заметное содержание свинца (валовых форм) в почвах некоторых городских лесопарков г. Екатеринбурга вблизи автомагистралей, приближающееся к 1 ПДК
(30 мг/кг) [3]. Очевидно, что аэротехногенное загрязнение от автотранспорта сочетается с общим загрязнением атмосферы городов от промышленных объектов. В частности, среднегодовая концентрация S02 в атмосфере г. Екатеринбурга составляла 6,7 мкг/м3 [4]. Несмотря на значительный интерес к исследованию биохимических аспектов взаимоотношений в системе: «аэротехногенное загрязнение – сосна обыкновенная – фенольные соединения», многие аспекты остаются недостаточно изученными, а полученные результаты – противоречивыми [5, 6]. Низкомолекулярные фенольные соединения выполняют важную роль в защите древесных растений от воздействия факторов биотического и абиотического стресса [7, 8]. Одним из основных негативных последствий сорбции и аккумуляции древесными растениями химических компонентов загрязнения является оксидативный стресс, который сопровождается генерацией активных форм кислорода [9, 10]. Основным фактором снижения отрицательных последствий оксидативного стресса служит активизация клеточной биохимической системы антиоксидантной защиты, включающей как высокомолекулярные соединения (ферменты: супероксиддисмутаза, каталаза, пероксидаза и др.), так и низкомолекулярные химические соединения, особенно флавоноиды [7, 11]. Установлено, что именно ферменты выполняют основную роль в антиоксидантной защите древесных растений [7, 11]. Но и низкомолекулярные фенольные и другие химические соединения также выполняют немаловажную роль в антиоксидантной защите [7]. Известно, что в условиях техногенного загрязнения фенольные соединения обладают способностью к связыванию тяжелых металлов в устойчивые комплексы [12]. Несмотря на интенсивные исследования реакций фенольных соединений на аэротехногенное загрязнение, многие вопросы остаются недостаточно изученными. Остается неясным, как реагируют на этот фактор различные фенольные соединения в клетках хвои в условиях аэротехногенного загрязнения среды. Одни авторы отмечают возрастание содержания фенольных соединений в условиях аэротехногенного загрязнения, другие – снижение [5, 6]. Вообще, фенольные соединения очень активно реагируют на условия обитания растений и факторы внешней среды [8]. На содержание фенольных соединений в хвое заметное воздействие оказывают и условия произрастания хвойных древесных растений. При высокой густоте произрастания содержание фенольных соединений снижалось [13].
Цель исследования: изучение вклада фенольных соединений в биохимические механизмы антиоксидантной защиты и адаптации сосны к аэротехногенному загрязнению в условиях городской среды (вблизи городских магистралей с наиболее интенсивным движением). Исходя из этого основными задачами исследования было изучение методами ВЭЖХ состава и содержания химических соединений в хвое сосны обыкновенной в условиях аэротехногенного загрязнения и в контроле, а также – влияния аэротехногенного загрязнения на состав и содержание химических соединений и идентификация флавоноидов с наиболее высоким уровнем антиоксидантной активности. Особенное внимание уделено изучению флавоноидов, которые отличаются высокой антиоксидантной и антирадикальной активностью, способностью к хелатированию тяжелых металлов и выполняют важную роль в адаптации к условиям среды [6–8].
Материалы и методы исследования
Для хроматографического анализа проводился сбор хвои сосны обыкновенной 25-летнего возраста, растущей вблизи наиболее загруженных автотранспортом городских автомагистралей г. Екатеринбурга (5 м) (пр. Ленина). Контрольные пробы взяты в лесопосадках сосны 25-летнего возраста в 68 км от города (Каменск-Уральский р-н) в сходных лесорастительных условиях. Взятие каждой пробы осуществлялось от 3 деревьев одинакового возраста. Затем пробы смешивались для получения средней пробы. Сразу после сбора хвою высушивали при 60 °С и размалывали. Навеску с 2 г хвои смешивали с 20 мл 95 % этанола. Экстракцию фенольных соединений из хвои проводили в водяной бане с обратным холодильником в течение 30 мин при кипении раствора. Затем суспензию центрифугировали при 10000 g в течение 10 мин. Супернатант фильтровали через шприцевой фильтр с диаметром пор 0,2 мкм. Хроматографический анализ проводили на жидкостном хроматографе Shimadzu LC-20 со спектрофотометрическим УФ-детектором. Каждая проба анализировалась в трехкратной повторности. Общее количество проб – 18. Детектирование элюента осуществляли одновременно на двух полосах поглощения: 254 и 360 нм на хроматографической колонке PerfectSil Target ODS-3 5 мкм с обращенной фазой, размерами: 250х4,6 мм. Затем вычислялось спектральное отношение параметров абсорбции (λ360/λ254). Градиентное элюирование проводилось в диапазоне 10–50 % со скоростью 1 мл в мин при температуре 40 °С. Элюент А: ацетонитрил – 0,05 М фосфатный буферный раствор (рН = 3,0); элюент В: ацетонитрил – вода (9:1). Продолжительность хроматографического анализа – 45 мин. Из них от 0 до 30 мин проводилось градиентное элюирование в диапазоне 10–50 %, затем в течение 15 мин – при концентрации 50 %. Для идентификации фенольных соединений использовали вещества-свидетели фирмы Sigma, Aldrich, Fluka (25 соединений (рисунок)).
Результаты исследования и их обсуждение
Градиентный хроматографический анализ проб хвои сосны обыкновенной выявил от 63 до 67 химических соединений (рисунок). Как показали результаты сравнительного попарного анализа влияния аэротехногенного загрязнения от автотранспорта на состав и содержание всех химических соединений в хвое сосны, доминирующей реакцией на этот фактор было снижение их содержания. При этом качественный состав соединений не изменялся. В составе этой подгруппы было 47,17 % химических соединений. Возрастание содержания химических соединений отмечалось у 28,3 % соединений, нейтральная реакция – у 24,53 % (рисунок, таблица).
По идентифицированным химическим соединениям нами получены сходные результаты. У 56 % химических соединений их содержание также заметно снижается в условиях аэротехногенного загрязнения, по сравнению с контролем, у 32 % соединений их содержание возрастает, у 12 % – не изменяется (таблица).
Сравнительный анализ идентифицированных химических соединений показал, что в составе этой группы соединений, содержание которых снижается в условиях аэротехногенного загрязнения, в одинаковом количестве представлены флавоноиды и гидроксикоричные кислоты (по 35,7 %). В первой из них были флавоноиды: катехин, гиперозид, феникулин, мирицетин, акацетин. Все они обладают антиоксидантной активностью. Гидроксикоричные кислоты включали: феруловую кислоту, кафтаровую кислоту, 3-кофеоилхинную кислоту, 5-кофеоилхинную кислоту, кофейную кислоту (рисунок, таблица). Следующую подгруппу составляют фенолгликозиды (21,45 %): арбутин, салицин, салидрозид. Последнюю подгруппу составляют витамины (7,15 %): аскорбиновая кислота. Она, как известно, обладает высокой антиоксидантной активностью [7].
В составе подгруппы идентифицированных химических соединений, содержание которых возрастало в условиях загрязнения, нами было выявлено значительное преобладание флавоноидов (75 %). Это рутин, лютеолин, кверцетин, изорамнетин, апигенин, кемпферол. Все эти флавоноиды обладают антиоксидантной активностью. Остальные 25 % соединений – органические кислоты (галловая кислота) и фенольные соединения (гидрохинон). Наиболее интенсивное возрастание содержания в условиях аэротехногенного загрязнения из флавоноидов выявлено у апигенина (в 2,45 раза) и кемпферола (в 2,23 раза), у остальных оно также заметно возрастало (в 1,47–1,53 раза). Из других химических соединений наиболее значительно в условиях загрязнения содержание возрастало у гидрохинона (в 2,39 раза) (таблица).
Как показали результаты сравнительного анализа состава химических соединений в условиях интенсивного техногенного загрязнения, у части гидроксикоричных кислот, флавоноидов и всех фенолгликозидов содержание не изменялось. В составе неидентифицированных химических соединений преобладающей реакцией на аэротехногенное воздействие у сосны обыкновенной было также снижение содержания химических соединений (68,97 %). В этой подгруппе содержание химических соединений в условиях аэротехногенного воздействия возрастало лишь у пяти соединений, что составляло 17,23 % от их общего количества в подгруппе. Отсутствовало статистически достоверное изменение содержания химических соединений у 13,8 % (таблица). У отдельных неидентифицированных соединений их изменение содержания было двух-трехкратным.
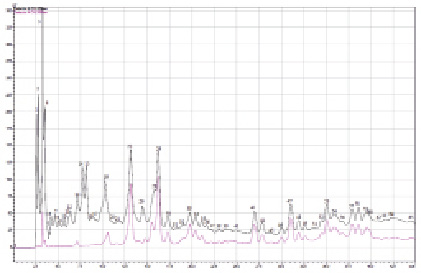
Градиентная хроматография экстракта хвои сосны обыкновенной. Контроль. По горизонтали:
Tr (время удерживания (мин)), по вертикали: абсорбция, mV: 1 – аскорбиновая кислота;
2 – арбутин; 3 – галловая кислота; 5 – кафтаровая кислота; 6 – 3 – кофеоилхинная кислота;
7 – салицин; 8 – гидрохинон; 10 – кофейная кислота; 12 – салидрозид; 13 – катехин;
17 – рутин;19 – 5 – кофеоилхинная кислота; 21 – изокверцетин; 22 – феруловая кислота;
23 – гиперозид; 24 – бензойная кислота; 26 – дигидрокверцетин; 28 – феникулин; 30 – мирицетин; 38 – лютеолин; 41 – кверцетин; 44 – изорамнетин; 45 – апигенин; 46 – кемпферол; 62 – акацетин
Влияние аэротехногенного загрязнения на содержание химических соединений
в хвое сосны обыкновенной (Pinus sylvestris L.)
|
Наименование химического соединения |
Сосна. Контроль |
Сосна. Загрязнение |
|||||||
|
№ пика |
Tr |
λ
|
Абсорбция (mv) |
Tr |
λ
|
Абсорбция (mv) |
TSt |
P |
|
|
Аскорбиновая кислота |
1 |
2,51 |
0,007 |
180,0 ± 25,35 |
2,51 |
0,007 |
120,87 ± 16,6 |
2,83 |
0,05 |
|
Арбутин |
2 |
2,89 |
0,013 |
210,5 ± 9,81 |
2,76 |
0,009 |
178,26 ± 7,01 |
3,75 |
0,05 |
|
Галловая к-та |
3 |
3,31 |
0,18 |
286,5 ± 8,16 |
3,23 |
0,137 |
308,26 ± 8,12 |
3,64 |
0,05 |
|
Кафтаровая к-та |
5 |
4,05 |
0,095 |
41,33 ± 2,83 |
4,05 |
0,095 |
27,28 ± 2,12 |
5,62 |
0,03 |
|
3-кофеоилхинная к-та |
6 |
4,25 |
0,044 |
32,69 ± 1,98 |
4,25 |
0,08 |
23,83 ± 1,55 |
4,97 |
0,038 |
|
Салицин |
7 |
4,68 |
0,024 |
44,6 ± 6,18 |
4,55 |
0,021 |
25,48 ± 2,91 |
3,96 |
0,051 |
|
Гидрохинон |
8 |
5,0 |
0,029 |
35,0 ± 3,53 |
5,15 |
0,0046 |
83,74 ± 11,73 |
5,62 |
0,03 |
|
НС* |
9 |
5,25 |
0,034 |
29,35 ± 1,86 |
5,50 |
0,046 |
23,36 ± 1,48 |
4,52 |
0,05 |
|
Кофейная к-та |
10 |
5,75 |
0,37 |
28,16 ± 2,97 |
5,75 |
0,39 |
13,89 ± 1,27 |
6,24 |
0,024 |
|
Салидрозид |
12 |
6,2 |
0,029 |
38,65 ± 4,38 |
6,25 |
0,236 |
18,09 ± 1,84 |
6,11 |
0,025 |
|
НС* |
6,45 |
0,023 |
47,5 ± 3,24 |
6,65 |
0,0109 |
36,83 ± 1,91 |
3,95 |
0,05 |
|
|
Катехин |
13 |
7,12 |
0,105 |
67,85 ± 8,06 |
7,35 |
0,024 |
25,52 ± 2,54 |
7,08 |
0,019 |
|
НС* |
14 |
7,74 |
0,013 |
109,1 ± 11,59 |
7,75 |
0,03 |
57,41 ± 5,79 |
5,64 |
0,03 |
|
НС* |
15 |
8,13 |
0,013 |
110,5 ± 10,04 |
8,21 |
0,0107 |
59,86 ± 6,08 |
6,1 |
0,025 |
|
Рутин |
17 |
9,25 |
0,103 |
29,32 ± 3,05 |
9,28 |
0,228 |
44,76 ± 5,21 |
3,98 |
0,05 |
|
5-Кофеоилхинная к-та |
19 |
10,25 |
0,44 |
62,86 ± 7,01 |
9,81 |
0,308 |
41,66 ± 4,22 |
3,97 |
0,05 |
|
НС* |
20 |
11,0 |
0,04 |
25,0 ± 2,20 |
10,72 |
0,041 |
18,88 ± 0,82 |
3,87 |
0,051 |
|
Изокверцетин** |
21 |
11,75 |
0,98 |
3,47 ± 0,24 |
11,71 |
0,77 |
3,13 ± 0,19 |
1,54 |
0,26 |
|
Окончание таблицы |
|||||||||
|
Наименование химического соединения |
Сосна. Контроль |
Сосна. Загрязнение |
|||||||
|
№ пика |
Tr |
λ
|
Абсорбция (mv) |
Tr |
λ
|
Абсорбция (mv) |
TSt |
P |
|
|
Феруловая к-та |
22 |
11,99 |
0,209 |
22,60 ± 2,82 |
11,77 |
0,21 |
13,67 ± 1,41 |
3,99 |
0,05 |
|
Гиперозид |
23 |
13,0 |
0,717 |
109,18 ± 12,86 |
12,56 |
0,671 |
63,27 ± 7,35 |
4,38 |
0,048 |
|
Бензойная к-та** |
24 |
13,55 |
0,194 |
31,0 ± 2,26 |
13,0 |
0,09 |
27,69 ± 1,97 |
1,55 |
0,25 |
|
Дигидрокверцетин** |
26 |
14,5 |
0,421 |
24,5 ± 1,55 |
14,28 |
0,411 |
22,38 ± 1,27 |
1,49 |
0,27 |
|
Феникулин |
28 |
15,75 |
0,525 |
51,59 ± 5,65 |
15,07 |
0,835 |
33,22 ± 1,69 |
4,39 |
0,047 |
|
НС* |
29 |
16,25 |
0,838 |
118,95 ± 10,18 |
15,77 |
0,680 |
74,78 ± 5,79 |
5,32 |
0,033 |
|
Мирицетин |
30 |
17,3 |
0,914 |
21,73 ± 2,40 |
16,87 |
0,89 |
11,19 ± 1,13 |
5,60 |
0,03 |
|
НС* |
33 |
18,32 |
0,323 |
3,25 ± 0,424 |
18,56 |
0,324 |
9,72 ± 1,273 |
6,82 |
0,021 |
|
НС** |
34 |
19,0 |
1,018 |
8,5 ± 0,56 |
19,0 |
0,925 |
8,67 ± 0,57 |
0,30 |
0,79 |
|
НС** |
35 |
19,8 |
1,11 |
27,0 ± 1,98 |
19,5 |
0,925 |
23,43 ± 1,56 |
2,00 |
0,18 |
|
НС** |
36 |
20,48 |
0,905 |
21,0 ± 2,83 |
20,12 |
0,767 |
20,98 ± 2,69 |
0,07 |
0,99 |
|
НС* |
21,11 |
0,755 |
15,7 ± 1,69 |
20,88 |
0,617 |
8,39 ± 0,84 |
5,45 |
0,032 |
|
|
НС* |
37 |
21,62 |
0,20 |
10,0 ± 1,13 |
21,5 |
0,176 |
5,94 ± 0,565 |
4,54 |
0,045 |
|
Лютеолин |
38 |
23,0 |
0,724 |
3,8 ± 0,282 |
22,85 |
0,525 |
5,59 ± 0,233 |
6,38 |
0,023 |
|
НС* |
39 |
23,25 |
0,545 |
5,5 ± 0,495 |
23,46 |
0,428 |
10,14 ± 0,91 |
6,29 |
0,024 |
|
НС** |
40 |
24,21 |
1,05 |
5,25 ± 0,424 |
24,21 |
1,05 |
5,43 ± 0,422 |
0,42 |
0,712 |
|
Кверцетин |
41 |
24,9 |
0,92 |
4,17 ± 0,354 |
24,7 |
0,82 |
6,39 ± 0,438 |
5,57 |
0,03 |
|
НС* |
43 |
27,0 |
0,872 |
32,75 ± 0,42 |
26,85 |
0,814 |
50,69 ± 6,15 |
3,96 |
0,05 |
|
Изорамнетин |
44 |
27,9 |
0,768 |
15,87 ± 1,66 |
27,73 |
0,75 |
24,33 ± 2,14 |
3,98 |
0,05 |
|
Апигенин |
45 |
28,8 |
0,80 |
2,5 ± 0,212 |
28,75 |
0,82 |
6,137 ± 0,56 |
8,51 |
0,013 |
|
Кемпферол |
46 |
30,0 |
0,878 |
10,25 ± 0,15 |
29,85 |
0,857 |
22,83 ± 0,32 |
8,51 |
0,0004 |
|
НС* |
48 |
31,0 |
0,828 |
43,5 ± 2,16 |
30,87 |
0,823 |
34,42 ± 1,85 |
3,89 |
0,05 |
|
НС* |
49 |
31,95 |
0,857 |
17,5 ± 1,34 |
31,9 |
0,80 |
12,88 ± 0,82 |
3,97 |
0,05 |
|
НС** |
51 |
32,65 |
0,983 |
9,0 ± 0,565 |
32,51 |
0,821 |
10,3 ± 0,636 |
2,15 |
0,163 |
|
НС* |
53 |
34,0 |
1,00 |
5,75 ± 0,705 |
33,9 |
0,37 |
9,61 ± 1,13 |
0,05 |
4,09 |
|
НС** |
34,61 |
0,83 |
15,5 ± 1,13 |
34,49 |
0,45 |
16,95 ± 1,27 |
1,20 |
0,35 |
|
|
НС** |
54 |
35,11 |
0,818 |
39,0 ± 3,535 |
35,0 |
0,683 |
43,004 ± 3,8 |
1,08 |
0,390 |
|
НС* |
35,81 |
0,898 |
24,5 ± 2,121 |
35,91 |
0,75 |
35,62 ± 2,82 |
4,44 |
0,047 |
|
|
НС** |
36,13 |
0,892 |
23,55 ± 2,82 |
36,25 |
0,674 |
22,92 ± 2,54 |
0,23 |
0,836 |
|
|
НС** |
55 |
36,75 |
0,991 |
11,6 ± 1,131 |
36,75 |
0,705 |
9,61 ± 0,988 |
1,87 |
0,202 |
|
НС* |
56 |
38,0 |
0,849 |
29,8 ± 2,828 |
38,7 |
0,756 |
109,0 ± 9,89 |
10,8 |
0,008 |
|
НС* |
57 |
39,62 |
0,9 |
24,0 ± 2,828 |
39,42 |
0,707 |
60,09 ± 7,07 |
6,68 |
0,021 |
|
НС** |
59 |
40,81 |
0,355 |
8,6 ± 0,848 |
40,85 |
0,888 |
10,73 ± 1,13 |
2,13 |
0,166 |
|
Акацетин |
62 |
42,5 |
0,351 |
10,4 ± 0,848 |
42,75 |
0,988 |
6,87 ± 0,565 |
4,89 |
0,0392 |
|
НС* |
63 |
44,5 |
0,85 |
5,0 ± 0,424 |
44,5 |
1,05 |
3,35 ± 0,283 |
4,57 |
0,0445 |
Примечание: НС* – неидентифицированное химическое соединение, НС** – различия статистически недостоверны.
Таким образом, в целом реакция разных химических соединений в клетках хвои сосны в условиях аэротехногенного загрязнения была различной. Доминирующей реакцией было снижение содержания этих соединений. Это противоречит полученным нами ранее результатам исследования [14]. Это может быть обусловлено как тем, что в год предыдущего исследования наблюдалось воздействие фактора абиотического стресса (майской засухи), которая могла повлиять на реакцию химических соединений в хвое сосны, так и тем, что в данном исследовании количество идентифицированных химических соединений было значительно больше, чем в предыдущем. Кроме того, важным фактором, результатов экспериментов ряда других авторов, было исследование содержания фенольных соединений вблизи крупных промышленных предприятий, продуцирующих значительное количество аэротехногенных выбросов (особенно соединений серы, негативно влияющих на хвойные древесные растения), а не аэротехногенных выбросов автотранспорта, где эти соединения почти отсутствуют, что и повлияло на характер реакции фенольных соединений в хвое. Кроме того, анализ уровня, типа и характера реакций различных растений на содержание свинца в почве показал, что у разных групп растений существуют разные стратегии отношения к воздействию этого фактора и разные уровни, характер и направление реакций полифенолов [15]. Учитывая это, сравнение реакций фенольных соединений у разных по стратегии отклика групп растений, вероятно, не всегда целесообразно.
Выводы
1. В целом результаты показали, что аэротехногенное загрязнение вызывает разнонаправленные реакции низкомолекулярных химических соединений в клетках хвои сосны обыкновенной, но преобладает реакция снижения содержания химических соединений в хвое.
2. У флавоноидов доминирующей реакцией в хвое сосны обыкновенной в условиях аэротехногенного загрязнения вблизи автомагистралей является возрастание их содержания (у 75 %). Это, очевидно, обусловлено высоким уровнем антиоксидантной активности флавоноидов и уровнем стрессовой реакции на воздействие факторов среды, а также – сформировавшимся в динамике эволюции вида уровнем, типом и характером реакции на стресс.
3. Идентифицированы флавоноиды с наиболее высоким уровнем антиоксидантной активности.
4. Учитывая то, что одним из основных негативных последствий аккумуляции клетками хвои сосны обыкновенной химических компонентов загрязнения является оксидативный стресс, а главным фактором снижения отрицательных последствий – активизация клеточной биохимической системы антиоксидантной защиты, включающей и фенольные соединения, можно предполагать, что их вклад в борьбу с антиоксидантным стрессом является существенным, особенно у флавоноидов. Это служит важным компонентом механизма биохимической адаптации сосны обыкновенной к аэротехногенному загрязнению в условиях урбанизации.