К основным недостаткам традиционных способов размножения лилий относят сравнительно невысокий выход качественного посадочного материала и большую инфицированность растений болезнями.
Метод клонального микроразмножения растений in vitro широко применяется для быстрого тиражирования ценных генотипов растений, он является обязательной частью в технологической цепочке по получению оздоровленного посадочного материала любой культуры. Оздоровление путем стерилизации и дальнейшее введение в культуру in vitro растений, полученных из естественных условий произрастания – процесс достаточно трудоемкий и длительный. Основная задача при выполнении работ такого типа должна быть направлена на получение стерильных растительных эксплантов, освобожденных от любого вида инфекции, присутствующей на поверхности и внутри растений, с максимально возможным количеством получаемых стерильных растений-регенерантов.
Введение в культуру in vitro растений лилии осуществляется методом вычленения экспланта из чешуек луковицы. Вариантов и методов стерилизации растительного материала существует достаточно много. В литературных источниках встречаются рекомендации применения для этих целей различных стерилизующих растворов и детергентов (в различных концентрациях, с разной экспозицией в зависимости от применяемого вещества и исходного вводимого в стерильную культуру растительного материала).
Цель проводимых нами исследований заключалась в усовершенствовании и оптимизации способов и приемов введения в стерильную культуру in vitro садовых лилий с целью последующего клонального микроразмножения культуры.
Материалы и методы исследования
Экспериментальные исследования проводились в лаборатории биотехнологии растений ФГБОУ ВО «Костромская ГСХА». В качестве объектов наших исследований служили луковицы азиатской лилии сорта Марлен. Все исследования выполняли в соответствии с общепринятыми методиками [1–3].
Для выполнения работ использовали луковицы лилий, прошедших после осенней уборки период покоя в течение 2 месяцев при температуре + 4 – 6 °С. Для очистки исходного материала от загрязнений и удаления внешней инфекции луковицы предварительно отмывали водопроводной водой с добавлением коммерческого препарата Доместос хлор. Дальнейшую стерилизацию подготовленных луковиц проводили в стерильных условиях ламинар-бокса по следующей схеме (табл. 1).
После проведения поверхностной стерилизации чешуи луковиц разрезали на сегменты, для чего базальную часть каждой чешуйки с помощью скальпеля разрезали поперечно на три сегмента: нижний, средний, верхний. Из каждого сегмента вырезали экспланты величиной 0,3–0,5 см, которые затем помещали на питательную среду внешней поверхностью вниз. Для культивирования эксплантов за основу брали питательную среду, состоящую из минеральных солей по прописи Мурасиге – Скуга. В качестве регуляторов роста использовали цитокинин 6-бензиламинопурин (6 – БАП) в концентрации, рекомендованной для клонального микроразмножения большинства культур – 0,5 мг/л [3–5]. Первую пересадку на свежую питательную среду микрорастений-регенерантов проводили через 6 недель культивирования.
Результаты исследования и их обсуждение
В результате проведения серии исследовательских работ было подтверждено, что успех введения в культуру тканей в большей степени определяется эффективностью стерилизации. Как показал сравнительный анализ, действие различных сочетаний стерилизующих агентов было отличным в зависимости от используемого варианта стерилизации (табл. 2). В нашем случае наиболее удачным вариантом стерилизации исходного материала лилий было сочетание этилового спирта и раствора гипохлорита натрия (вариант стерилизации № 2 – см. табл. 1). Проведение стерилизации данным способом обеспечивало достаточную стерильность материала – количество стерильных эксплантов, образующих почки и микропобеги, достигало 80,0 %. Однако до 15,0 % растительного материала не удавалось освободить от грибной и бактериальной инфекции, 5,0 % введенного в стерильную культуру материала не имели видимых признаков инфицированности, но были нежизнеспособными, т.е дальнейшая регенерация на них не отмечалась.
Таблица 1
Схема стерилизации исходного растительного материала
|
Вариант стерилизации |
Стерилизующий агент |
Концентрация, % |
Экспозиция, мин/сек |
|
1 |
Этиловый спирт |
70,0 |
10 с |
|
Пероксид водорода |
3,0 |
25 мин |
|
|
2 |
Этиловый спирт |
70,0 |
10 с |
|
Гипохлорит натрия |
20,0 |
7 мин |
|
|
3 |
Этиловый спирт |
70,0 |
10 с |
|
Гипохлорит натрия |
20,0 |
10 мин |
|
|
Тетрациклин, ампициллин |
5,0 |
7 мин |
Таблица 2
Жизнеспособность выделенных эксплантов лилий в условиях in vitro, %
|
Вариант стерилизации |
Стерилизующий агент |
Выход стерильных эксплантов |
Число инфицированных эксплантов |
Число нежизнеспособных эксплантов |
|
1 |
Этиловый спирт |
2,0 |
90,0 |
8,0 |
|
Пероксид водорода |
||||
|
2 |
Этиловый спирт |
80,0 |
15,0 |
5,0 |
|
Гипохлорит натрия |
||||
|
3 |
Этиловый спирт |
72,0 |
8,0 |
20,0 |
|
Гипохлорит натрия |
||||
|
Тетрациклин, ампициллин |
Совместное применение этилового спирта, растворов гипохлорита натрия, растворов антибиотиков тетрациклина и ампициллина (вариант стерилизации № 3 – см. табл. 1) обеспечивало стерилизующий эффект растительного материала несколько ниже по сравнению с предыдущим вариантом стерилизации – 72,0 %. Несмотря на то, что антибиотики губительно действуют на микроорганизмы, в нашем случае они оказывали токсическое влияние непосредственно и на сами экспланты. Число нежизнеспособных эксплантов составляло 20,0 %, число инфицированных эксплантов – 8,0 %.
Среди всех изученных стерилизующих агентов 3,0 % раствор пероксида водорода показал наименьший стерилизующий эффект, инфицированность эксплантов составляла 90,0 %, которая состояла в основном из грибной микрофлоры и введенные побеги через 5–7 суток погибали – 8,0 %. Количество полученных стерильных эксплантов на данном варианте не превышало 2,0 % (вариант стерилизации № 1– см. табл. 1).
Инфицированность и нежизнеспособность эксплантов отмечалась, независимо от изначального их месторасположения в чешуе луковицы.
Таким образом, было установлено, что наилучшим вариантом для стерилизации чешуй луковиц в наших исследованиях оказался вариант № 2, т.е. сочетание 70,0 %-ного этанола с экспозицией 10 с и использование в качестве основного стерилизующего агента 20,0 % гипохлорита натрия с экспозицией 7 мин.
Начало развития адвентивных микропобегов наблюдали через 2 недели после введения в культуру на всех вариантах опыта, более активная регенерация которых отмечалась на эксплантах, вырезанных из нижней базальной части чешуи по сравнению с сегментами, вырезанными из средней и верхней частей – 98,0 %, (табл. 3).
Таблица 3
Регенерация растений лилий после введения в стерильную культуру in vitro, %
|
Расположение экспланта в чешуе |
Процент регенерированных растений |
|
нижнее |
98,0 |
|
среднее |
77,0 |
|
верхнее |
54,0 |
На протяжении этапа «собственно микроразмножение» растений из биометрических показателей проводили учет прироста растений в высоту (рис. 1). Через месяц после начала активной регенерации высота растений варьировала от 3,5 до 6,0 см, каждый последующие месяц высота растений увеличивалась в среднем на 2 см и через 3 месяца составляла в среднем 7,5–9,0 см.
Наглядно поэтапное развитие растений-регенерантов лилий после введения эксплантов в стерильную культуру, а также на этапе «собственно микроразмножение» представлено на рис. 2, 3.
Для последующего формирования микролуковичек использовали питательную среду Мурасиге и Скуга, содержащую в своем составе кроме цитокинина 6 – БАП (0,5 мг/л) также ауксин НУК (нафтилуксусную кислоту) в концентрации 0,5 мг/л.
Более высокие значения основных анализируемых показателей развития растений-регенерантов, а именно, значения коэффициента размножения – 5,0 шт. микролуковичек/эксплант и размера образовавшихся луковичек – в среднем 2,8 мм также были отмечены на эксплантах вырезанных с нижней части чешуи по сравнению с эксплантами со средних и верхних сегментов чешуй (табл. 4).
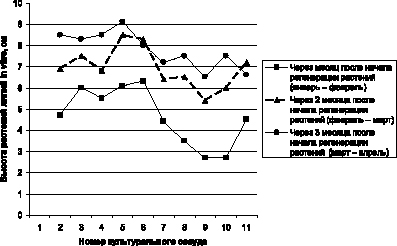
Рис. 1. Динамика увеличения высоты растений-регенерантов лилий на этапе «собственно микроразмножение», см

Рис. 2. Регенерация растений лилий на эксплантах (через 2 недели после начала регенерации)

Рис. 3. Микрорастения лилий, регенерированные из эксплантов (через 1,5 месяца после начала регенерации)
Таблица 4
Показатели развития растений-регенерантов лилий после введения в стерильную культуру in vitro
|
Расположение экспланта в чешуе |
Коэффициент размножения, шт. микролуковичек/эксплант |
Средний размер луковичек, мм |
|
нижнее |
5,0 |
5,5 |
|
среднее |
2,5 |
4,3 |
|
верхнее |
2,0 |
1,8 |
|
НСР05 |
1,07 |
0,83 |
Таким образом, было установлено, что при наличии достаточного количества исходного донорского материала для введения в стерильную культуру предпочтительней использовать только базальную часть чешуй луковиц размером, не превышающим 1,0–1,5 см.
Наглядно конгломерат растений-регенерантов лилий с формирующимися микролуковицами представлен на рис. 4.

Рис. 4. Формирование микролуковиц на растениях лилий сорта Марлен
Устойчиво растущая стерильная культура лилий in vitro представлена на рис. 5.

Рис. 5. Устойчиво растущая стерильная культура in vitro лилий сорта Марлен
Заключение
В результате проведенных исследований было установлено, что для введения в стерильную культуру лилий, путем вычленения эксплантов из чешуй луковиц наиболее эффективно применение сочетания 70,0 %-ного этанола с экспозицией 10 с и 20,0 %-ного гипохлорита натрия – 7 мин, что обеспечивало более высокий выход стерильных жизнеспособных растений – 80,0 % по сравнению с другими испытуемыми вариантами. Также было подтверждено, что вычленять экспланты предпочтительней из нижней части чешуи луковицы, что в свою очередь позволяет получать до 98,0 % успешно регенерированных растений с более качественными биометрическими показателями, а именно размером микролуковичек in vitro 5,5 мм и коэффициентом размножения – 5,0 шт./эксплант.
Таким образом, применение метода клонального микроразмножения может оказаться весьма полезным и перспективным направлением в размножении ценных сортов и гибридов лилий, особенно если в качестве исходного донорского материала имеется ограниченное количество луковиц. Кроме того, постоянное поддержание растений в стерильной культуре in vitro может служить своеобразным банком для сохранения и поддержания генофонда наиболее ценных сортов и гибридов культуры.



