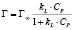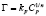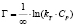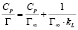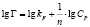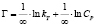Загрязнение природных вод промышленными стоками является актуальной проблемой в наши дни, оно негативно влияет на экологию биосферы. В роли загрязнителей вод выступают сбросы гальванических производств, которые потребляют огромное количество воды для промывки обрабатываемых деталей [1]. В сточных и промывных водах данных предприятий содержатся ионы тяжелых металлов, обладающие биологической активностью, мутагенными и токсическими свойствами, приводящими к отравлению живых организмов и человека.
К тяжелым металлам, содержащимся в воде, относится кадмий. Повышенная концентрация ионов кадмия в питьевой и водопроводной воде приводит к таким проблемам со здоровьем, как анемия, поражение легких, печени и почек, ослабление костей, кардиопатия, эмфизема легких, остеопороз и повышение дефицита цинка и селена [2]. По этим самым причинам удаление ионов кадмия относится к основным задачам водоочистки.
Возникает потребность извлечения ионов кадмия из водных объектов с использованием эффективных методов. Одним из них, используемым на практике, является адсорбционный. В XXI в. стали активно применять природные адсорбенты со слоистой структурой алюмосиликатов для извлечения тяжелых металлов [3, 4]. Эти адсорбенты экономичны, стоят недорого, механически устойчивы, обладают высокими сорбционными характеристиками.
Целью данной работы является исследование способности природного и модифицированного каолина поглощать ионы кадмия из водных растворов.
Материалы и методы исследования
В работе в качестве адсорбента использовали природный и модифицированный каолин. Рентгеноструктурным анализом (РСА) при помощи сканирующего растрового микроскопа JEOLJSM 6510 LV определяли химический состав каолина, который представлен в табл. 1. Точность установления элементного состава ∓2%. Потери при прокаливании каолина составляют 5,51%.
Таблица 1
Химический состав каолина
|
Содержание |
SiO2 |
Al2O3 |
Fe2O3 |
Na2O |
K2O |
CaO |
TiO2 |
|
% масс. |
49,22 |
46,87 |
1,21 |
0,13 |
0,42 |
0,86 |
0,97 |
Согласно ГОСТ 9169-75 по содержанию оксида алюминия каолин относится к высокоосновным глинам.
Фазовый состав каолина определяли с использованием рентгенофазового анализа, представленного на рис. 1. Рентгенофазовый анализ выполнен на дифрактометре Bruker D2 Phaser с линейным детектором Lynxeye (CuKa – излучение, Ni – фильтр).
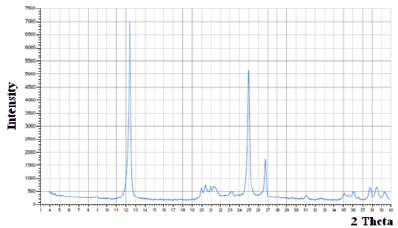
Рис. 1. Рентгенограмма каолина
Согласно полученным данным рентгенофазового анализа можно выделить две фазы: каолинит – 98% и хлорит – 2%.
Каолин относится к классу алюмосиликатов [5]. Основным минералом природного каолина является каолинит. Кристаллическая решетка неподвижная, состоит из двухслойных пакетов [5], один слой состоит из октаэдров, второй слой – из кремнекислородных тетраэдров. Между слоями находятся катионы щелочных металлов Na+, K+ и щелочноземельных металлов Ca2+, Mg2+ [5], которые являются источником катионообменной способности каолина. Расстояние между пакетами постоянно и составляет 0,4 нм, каолинит не набухает в воде.
На рис. 2 представлен снимок нативной формы каолина.

Рис. 2. Электронно-микроскопический снимок природной (нативной) формы каолина
Адсорбцию ионов кадмия на каолине изучали в нитратных растворах в статических условиях. Для улучшения адсорбционных свойств каолина провели его модифицирование. Химическую модификацию осуществляли переводом нативной формы каолина 2М растворами соляной кислоты HCl и гидроксида натрия NaOH. Содержание ионов кадмия в растворах варьировали от 0,02 до 0,15 ммоль/мл при температуре 298 К. Концентрацию ионов кадмия в растворе определяли комплексонометрическим титрованием.
Результаты исследования и их обсуждение
На рис. 3 представлена зависимость удельной адсорбции ионов кадмия от равновесной концентрации на каолине в нативной и модифицированных Н- и ОН-формах. Формы кривых имеют выпуклый характер, что указывает на высокое сродство ионов кадмия к каолину. На кривых отсутствуют перегибы, значит, все молекулы исходного вещества находятся в диссоциированном состоянии. С увеличением концентрации ионов кадмия в исходном растворе величина адсорбции возрастает. Величина адсорбции в зависимости от формы каолина имеет значения: нативная – 0,89 ммоль/мл; Н-форма – 0,96 ммоль/мл; ОН-форма – 1,26 ммоль/мл. Анализ полученных результатов показывает, что величина адсорбции изменяется в ряду:
нативная > H-форма > OH-форма.
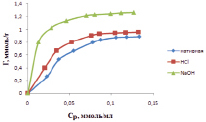
Рис. 3. Изотермы адсорбции ионов кадмия при температуре 298 К
Процесс адсорбции на каолине объясняется тем, что в кристаллах обмен ионами происходит только на внешней поверхности. Адсорбционные свойства природных алюмосиликатов находятся в прямой зависимости от величины удельной поверхности [6].
На рис. 4 представлен ИК спектр каолина для подтверждения процесса адсорбции. Полосы поглощения в области 3600–3800 см–1 соответствуют валентным колебаниям ОН-групп [7]. Присутствующий пик при 730–780 см–1 соответствует наличию связей Аl-О, интенсивный пик при 830–1050 см–1 отвечает валентным колебаниям Si-О- Si связей [7].
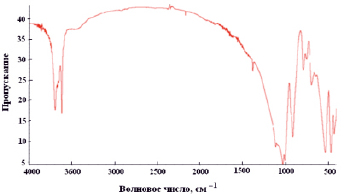
Рис. 4. ИК – спектр нативного (природного) каолина
Изотермы адсорбции по классификации БЭТ [8] соответствуют мономолекулярному типу. Для количественного описания адсорбционного равновесия использовали несколько моделей, приведенных в табл. 2.
Таблица 2
|
Модель |
Ленгмюра |
Фрейндлиха |
Темкина |
|
Уравнение |
|
|
|
|
Уравнение в линейной форме |
|
|
|
Примечание. Здесь Г – величина адсорбированного кадмия (ммоль/г), kL и Г∞; kF и n; kT и ∞ – константы Ленгмюра, Фрейндлиха и Темкина соответственно.
На рис. 5 представлены изотермы в координатах линейной формы уравнений Ленгмюра, Фрейндлиха и Темкина. Результаты обработки линейных изотерм адсорбции ионов кадмия приведены в табл. 3. По значению коэффициентов корреляции модель Ленгмюра описывает экспериментальные данные лучше, чем другие модели. Результаты расчета подтверждают, что при модифицировании каолина гидроксидом натрия повышается его предельная адсорбция до 1,35 ммоль/мл.
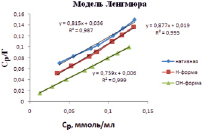
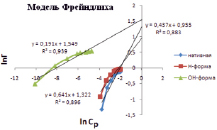
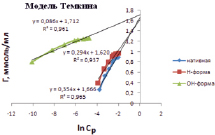
Рис. 5. Изотермы адсорбции Ленгмюра, Фрейндлиха и Темкина в линейных координатах ионов кадмия на каолине
Таблица 3
Экспериментально полученные константы Ленгмюра, Фрейндлиха, Темкина
|
Форма каолина |
Ленгмюра |
Фрейндлиха |
Темкина |
||||||
|
Г∞,
|
kL,
|
R2 |
ln kF |
1/n |
R2 |
ln kT |
1/α |
R2 |
|
|
Нативная |
1,23 |
22,63 |
0,987 |
1,55 |
0,19 |
0,936 |
4,44 |
0,35 |
0,961 |
|
Н-форма |
1,14 |
46,15 |
0,995 |
0,96 |
0,44 |
0,883 |
5,51 |
0,29 |
0,937 |
|
ОН-форма |
1,35 |
123,2 |
0,999 |
1,32 |
0,64 |
0,896 |
19,9 |
0,09 |
0,965 |
Заключение
Установлено, что модифицирование каолина соляной кислотой и гидроксидом натрия приводит к увеличению адсорбционных характеристик адсорбента по отношению к ионам кадмия. Химический, фазовый состав, установленная поглотительная способность каолина свидетельствуют о перспективности его применения для извлечения ионов кадмия из природных и промышленных сточных вод.