Получение органических комплексов, в основе которых атом бора, – актуальное направление в технологических процессах. Синтез и изучение комплексных соединений бора в системах «органический реагент – водный раствор» позволит расширить ассортимент органо-неорганических комплексов, применяемых в качестве соединений, обладающих биоцидными свойствами [1]. В данной работе анализируются органо-неорганические комплексы на основе борной, лимонной и аминоуксусной кислот (дилимонноборная кислота и диглициноборная кислота), которые имеют в своем составе тетракоординированный бор, а также соли этих кислот (дицитратоборат глициния и диглициноборат меди (II)).
Комплексные соединения синтезировали из метастабильных систем с последующим медленным охлаждением, во время которого происходила кристаллизация конечного продукта. Рассматриваемые соединения являются кристаллическими формами, хорошо растворимыми в воде и плохо растворимыми в органических растворителях. Анализ полученных кристаллических комплексов методом ИК-спектроскопии позволил получить информацию об особенностях структурных единиц, самой структуре, составе, взаимодействии элементов, составляющих комплексное соединение.
Цель исследования: аналитическое изучение применения метода ИК-спектроскопии для идентификации разнолигандных соединений на основе теракоординированного бора, а также изучение влияния внешней сферы на координационные связи в рассматриваемых комплексах.
Материалы и методы исследования
При синтезе комплексных соединений использовали реагенты: кислота борная «х.ч.», соотношение основного компонента составило 99 %, L-α-глицин (аминоуксусная кислота) марки «ч.», кислота лимонная безводная мелкодисперсная гранулированная «ч.д.а.» E 330, оксид меди (II) порошкообразный (CuO), «ч.д.а.». Методика синтеза дилимонноборной кислоты основана на создании метастабильной системы из исходных компонентов. Данное условие базируется на создании пересыщенных растворов соответствующих кислот, которые берутся в соотношениях: 0,05 моль (3,09 г) кислоты борной и 0,1 моль (21,03 г) кислоты лимонной. Возможность получения индукционного периода кристаллизации базируется на растворении борной кислоты и следом лимонной кислоты в минимальном объеме дистиллированной воды (не более 30 мл) при постоянном перемешивании и температуре 50–60 °С. Следующий этап – медленное охлаждение, которое привело к выпадению кристаллов дилимонноборной кислоты. Кристаллы тщательно промывали этиловым спиртом и сушили в эксикаторе. Для формирования кристаллов соли данной кислоты исходное соединение растворяли в 20 мл дистиллированной воды на водяной бане при 60 °С и порционно вносили в раствор при постоянном перемешивании системы 0,1 моль (7,5 г) L-α-глицина. Молярное соотношение должно быть 1:2:1 соответственно. Сформированный кристаллический осадок дицитратобората глициния должен находиться в маточном растворе несколько дней, затем с использованием воронки Бюхнера разделяться и промываться диэтиловым эфиром. Методика формирования кристаллов комплексных соединений – диглициноборной кислоты (получена с использованием борной и аминоуксусной кислот) и соли диглицинобората меди (II) аналогична предыдущей и так же включает в себя использование метастабильных систем. Соотношение исходных компонентов при синтезе диглицинобората меди (II) составляло в мольных долях отношение 1:2:1 соответственно. ИК-спектры записаны с применением спектрометра Фурье Nicolet IR200 (Thermo Scientific), в котором использовался элемент НПВО – нарушенное полное внутреннее отражение (ATR) из ZnSe с углом падения 45 °. Прибор имеет разрешение 4 см-1, произведено не менее 20 сканирований, при этом использовался частотный интервал в области 420–4000 см–1.
Результаты исследования и их обсуждение
Строение и свойства молекул дилимонноборной кислоты и ее соли дицитратобората глициния подробно описаны в работе [2].
Механизм синтеза исследуемых комплексных соединений представлен на рис. 1.
H3BO3 + 2(HOOCCH2)2C(OH)COOH → H[B (C6H6O7)2] · H2O + 2H2O (а)
H[B(C6H6O7)2] · H2O + H2NCH2COOH → H3NCH2COOH + [B(C6H6O7)2] – · H2O (б)
Рис. 1. Синтез комплексных соединений: а) образование дилимонноборной кислоты; б) получение дицитратобората глициния
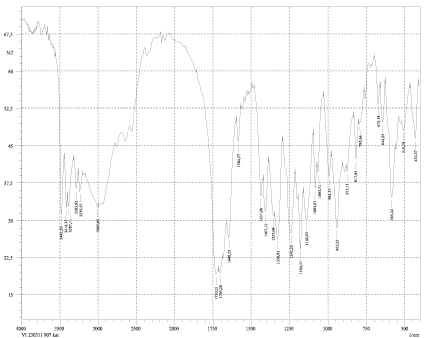
Рис. 2. Спектр дилимонноборной кислоты
Используя метод ИК-спектроскопии, были выделены индивидуальные пики, характерные как для дилимонноборной кислоты, так и для дицитратобората глициния. Наличие характеристических полос спектра дилимонноборной кислоты показано на рис. 2. Для бора, имеющего координационное число 4, пик при 943 см–1 характеризует валентные связи В–О. Наличие на спектре этой четкой полосы позволяет предположить, что в структуре дилимонноборной кислоты присутствует борокислородный тетраэдр [3]. В области 1700–1730 см-1 наблюдаются полосы поглощения, характерные для свободных карбонильных групп. Полоса поглощения в интервале 1180–1140 см-1 соответствует ионизированной группе С–О, в которой атом углерода находится в sp2-гибридизации.
На спектре имеется пик 1360 см-1, подтверждающий валентные колебания в карбоксилатной группе О–С=О. Наличие ассоциированной группы О–Н доказывается пиками 3010–3482 см-1, однако данные спектральные полосы выражены довольно слабо. Пики в области 510–585 см-1 характеризуют ковалентную связь C–C. Присутствие на спектре полос поглощения в диапазоне 1355–1437 см-1 доказывает наличие деформационных колебаний связи CH2. Наличие депротонированной α-гидроксильной группы у лимонной кислоты В–О–С характеризуется пиком в интервале 1378–1437 см–1. Образование дицитратоборатного аниона происходит с учетом бидентатной координации бора, как комплексообразователя, с двумя молекулами кислоты лимонной через α-гидроксильную группу, с одной стороны, и атомы кислорода центральных карбоксильных групп, с другой [4]. Анализируя спектральные характеристики дицитратобората глициния, можно сделать вывод, что аналогично предыдущему комплексу, наличие полос поглощения в области 908–981, 1124 и 1234 см-1 указывает на наличие валентных колебаний связи В–О в борокислородном тетраэдре (рис. 3) [3]. Особенностью ИК-спектров поглощения дицитратобората глициния является наличие выраженного сдвига в область высокочастотных колебаний по сравнению с дилимонноборной кислотой, что указывает на более прочный характер связи внутри комплексного иона [5]. В спектре соединения присутствуют полосы поглощения 1720–1780 см-1 из-за валентных колебаний –С=О карбонильной группы, взаимодействующей с атомом бора. Сравнительный анализ показывает, что данные пики валентных колебаний так же сдвинуты в высокочастотную область поглощения по сравнению с аналогичными в дилимонноборной кислоте. Сравнивая данные спектрального анализа дилимонноборной кислоты и дицитратобората глициния, можно сделать предварительный вывод, что влияние ионов глицина, образующих внешнюю сферу, выражается в смещении пиков в сторону боле высокочастотных колебаний.
Подобное смещение полос в спектральной характеристике исследуемого соединения по сравнению с исходным веществом в коротковолновую область составляет примерно 35 см-1, что объясняется формированием связи C–O–B. Полосы поглощения в области от 2980 см-1 и до 1410–1430 см-1 совпадают с характеристиками валентных колебаний связей О–Н в карбоксильной группе и деформационных колебаний связи С–Н соответственно. Связь C–O дает появление пиков в областях 1060 и 1130 см-1. Наличие пика при 1320 см-1 применимо к присутствию валентных колебаний в связи C–N именно в глициновом фрагменте NH3+. Деформационные колебания связи N–H дают пик при 1510 см-1, а значение 3570 см-1 позволяет характеризовать колебания связи N–H в NH3+. Соответственно, цвиттер-ионная структура аминокислоты характеризуется наличием полос поглощения в районе 1610–1550 см-1. Слабые широкие полосы поглощения, наблюдаемые в коротковолновой части ИК-спектра вещества, объясняются наличием кристаллизационной молекулы воды, включенной в состав катиона глицина [6]. Таким образом, можно сделать вывод, что исследуемый нами дицитратоборатный анион сохраняет борокислородный тетраэдр образованный путем бидентатной координации атома бора во всех изучаемых соединениях. Данные ИК-спектроскопии подтверждают наличие в комплексных соединениях дицитратоборатного аниона, в котором бор находится в состоянии тетракоординации.
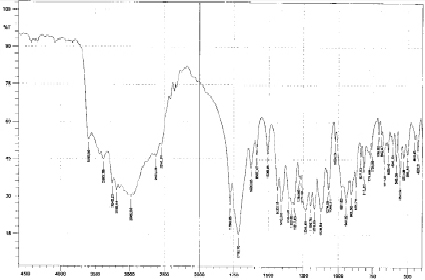
Рис. 3. Спектр дицитратобората глициния
Сравнительное исследование ИК-спектров поглощения диглициноборной кислоты и ее соли – диглицинобората меди (II) позволило показать влияние внешней сферы комплексных соединений на структуру молекулы и прочность связей комплексообразователя и лигандов. Механизм синтеза представлен на схеме (рис. 4).
На спектре диглициноборной кислоты наблюдается пик в области 3176 см-1, что характеризует наличие валентных колебаний гидроксогрупп (рис. 5). Индивидуальный пик в области 1575 см-1 определяет наличие карбонильной группы в карбоксиле глицина. На ИК-спектре диглициноборной кислоты появляется новый пик, отсутствующий у предыдущих комплексных соединений в области 1500 см-1.
Согласно данным [4] наличие данной полосы поглощения свидетельствует о возникновении координации с борокислотным каркасом. На спектре соединения необходимо выделить еще одну полосу, отвечающую за связь В–N. Для данной группы характерны пики в области 1128 см-1 и 1155 см-1. Наличие пиков диглициноборной кислоты в районе 1033, 1112, 1132 и 1195 см-1 доказывает образование боразотной координации. Характеристический пик в области 910 см-1 показывает наличие координационной связи В–О во внутренней сфере соединения. Проведя спектральный анализ полос поглощения диглицинобората меди (II) в области 1195 см-1, можно утверждать, что и в этом соединении бор, как комплексообразователь, находится в тетракоординированном состоянии. Спектральная характеристика связи B–O борокислородном тетраэдре лежит в области 893 см-1, что дает возможность характеризовать валентные колебания данной группы (рис. 6).
H3BO3 + 2NH2–CH2–COOH → H[B(HNCH2COO) 2] +3H2O (а)
2 H[B(HNCH2COO) 2] + CuO → Cu[B(HNCH2COO) 2]2 + H2O (б)
Рис. 4. Синтез комплексных соединений: а) образование диглициноборной кислоты; б) получение диглицинобората меди (II)
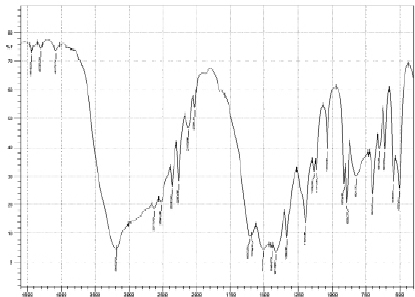
Рис. 5. Спектр диглициноборной кислоты
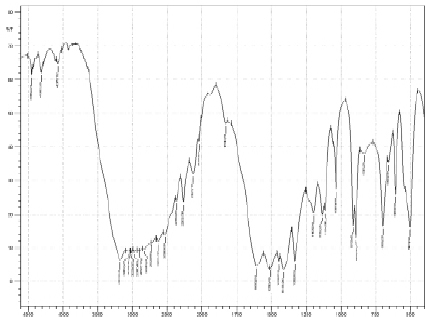
Рис. 6. Спектр диглицинобората меди (II)
Наличие полос в диапазоне 1400–1450 см-1 подтверждает валентные колебания карбонильной группы –C=O. Максимум при 3173 см-1 на ИК-спектре предполагает наличие валентных колебаний связи О–Н. Доказательством наличия двухвалентной меди во внешней сфере рассматриваемого комплекса будет присутствие полосы при 1610 см-1. При анализе спектров диглицинобората меди наблюдается выраженное смещение полос поглощения в область низкочастотных значений, что можно объяснить влиянием катиона двухвалентной меди, находящейся во внешней сфере соединения [7].
Выводы
Получены комплексные соединения: дилимонноборная кислота (на основе борной и лимонной кислот), диглициноборная кислота (на основе борной и аминоуксусной кислот), а также соли этих соединений – дицитратоборат глициния и диглициноборат меди (II). Методика синтеза комплексных соединений на основе борной кислоты основывается на обязательном получении метастабильных систем в процессе кристаллизации.
Анализ ИК-спектров изучаемых соединений показал, что атом бора, образующий внутреннюю сферу всех полученных нами комплексов, находится в тетракоординированном состоянии.
На структуру связей центрального атома с лигандами влияет боразотная координация, т.е. введение аминокислоты усиливает прочность связи, что выражается на ИК-спектрах сдвигом полос поглощения в высокочастотную область.
Показано влияние внешней сферы на прочность связей в борокислородном тетраэдре на примере дилимонноборной кислоты и дицитратобората глициния. Наличие аминокислоты в качестве катиона во внешней сфере ослабляет прочность связи в борокислородном тетраэдре, что выражается на ИК-спектрах сдвигом области поглощения в низкочастотный интервал. Анализ диглициноборной кислоты и диглицинобората меди (II) показал также ослабление прочности связи в боразотной координации внутренней сферы комплексных соединений.



