Обеспечение водой промышленных предприятий, в том числе нефтегазовых, является одной из важных производственных задач. Все тяжелые металлы в избыточном количестве, к которым относится и железо, обладают токсическим действием [1]. В воду тяжелые металлы попадают в результате выбросов различных промышленных предприятий, а также при коррозии оборудования. Ионы таких металлов способны вступать в многочисленные химические и биологические реакции. Многие из них обладают переменной степенью окисления, поэтому участвуют в окислительно-восстановительных процессах. Они способны мигрировать в различные среды жизни и ухудшать их санитарное состояние [2]. В связи с этим актуальна проблема извлечения тяжелых металлов из сточных вод перед их сбросом в природные водоемы. В настоящее время для очистки сточных вод промышленных предприятий применяют различные методы, в том числе и дорогостоящие электрохимические. Такие методы являются энергоемкими и сложными в применении. Предпочтение необходимо отдавать методам очистки с использованием недорогого местного сырья или отходов промышленного производства, не уступающим по своей эффективности вышеуказанным [3, 4]. Сорбционный метод извлечения тяжелых металлов является одним из перспективных и эффективных способов очистки [5, 6]. В недрах Тюменского края можно найти большие запасы природных минералов различного состава. В связи с этим вполне актуальны исследования сорбционной способности местных минералов-сорбентов [7]. В Тюменском индустриальном университете на кафедре общей и специальной химии строительного института проводятся исследования по изучению сорбционной активности природных минералов по отношению к тяжелым металлам [8–10].
Цель исследования: изучение основных закономерностей сорбционного извлечения железа (III) из модельных растворов монтмориллонитом и его химически измененными формами с возможным применением адсорбента для решения экологических проблем.
Материалы и методы исследования
Монтмориллониты – это глинистые минералы, которые состоят из очень маленьких частиц в форме гексагональных чешуек. При увлажнении водой такие минералы проявляют пластические свойства. Структура глинистых минералов разбухает или сжимается в зависимости от степени гидратации. Разбухающие монтмориллониты построены из двойных силикатных слоев. Вода в структуре монтмориллонита располагается между силикатными слоями. Содержание этой воды зависит от содержания влаги в образце. В структуре монтмориллонита кроме воды имеются обменные катионы, которые расположены между силикатными слоями. Несовершенство структуры глинистых минералов указывает на их способность легко поглощать или выделять воду, а также на их ионообменные свойства [11].
Для установления химического состава исследуемого минерала методом рентгеноструктурного анализа использовали cканирующий электронный микроскоп (SEM). Химический состав представлен на рис. 1. Точность определения ±2 %.
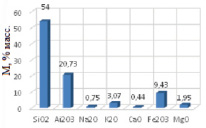
Рис. 1. Химический состав природного монтмориллонита
По результатам рентгеноструктурного анализа монтмориллонит содержит 54 % диоксида кремния и 20,73 % оксида алюминия, что указывает на полукислый характер исследуемого минерала. Суммарное содержание оксидов натрия и калия составило 3,82 %.
Методика исследования эффективности очистки от катионов железа на монтмориллоните. Крупные куски минерала измельчали, проводили разделение на фракции с помощью различных сит и для исследования брали ту часть, которая содержала частицы размером 1–2 мм. Метод проведения сорбции использовали статический. Концентрацию модельных растворов варьировали от 0,04 моль/л до 0,2 моль/л. Готовили модельные растворы различной концентрации методом разбавления исходного раствора. Исходный раствор с концентрацией 1 моль/л получали, растворяя навеску FeCl3∙6H2O (квалификация «х.ч.») в бидистиллированной воде. Исследуемый минерал массой 1 г помещали в колбу с притертой пробкой, добавляли 50 мл модельного раствора и оставляли на 7 суток для установления равновесия. По истечению установленного времени сорбент отделяли от раствора на фильтре «синяя лента» и проводили анализ на содержание ионов железа. Для определения начального и равновесного содержания ионов железа в растворах использовали метод объемного комплексонометрического титрования [12].
Для проведения химической активации природного минерала к навескам монтмориллонита массой 1 г добавляли растворы HCl, NaOH и NaCl с концентрацией 2 М. Таким образом, были получены: Н-форма, OH-форма и Na-форма сорбента соответственно. Исследования проводили при температуре 25 °С.
Результаты исследования и их обсуждение
При исследовании ионообменных свойств природного минерала и его активационных форм, полученных после применения веществ-модификаторов, необходимо рассчитать величину адсорбции (Г) и построить изотермы адсорбции. На основе экспериментальных данных, полученных в ходе комплексонометрического титрования, вычисляли величину адсорбции по уравнению
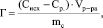 (1)
(1)
где Сисх – исходная концентрация катионов железа (III) в растворе, ммоль/мл; Ср – равновесная концентрация катионов железа (III) в растворе после сорбции, ммоль/мл; V – объем модельного раствора, мл; mс – масса исследуемого минерала-сорбента, г.
По расчетным данным строили изотермы адсорбции, т.е. графическую зависимость величин адсорбции от концентрации адсорбата при постоянной температуре, которые характеризуют сорбционные свойства минерала-сорбента. На рис. 2 приведены полученные изотермы на природном монтмориллоните и на его активационных формах.
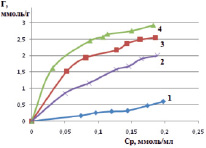
Рис. 2. Графическая зависимость катионов железа от равновесной концентрации на различных формах монтмориллонита: 1 – природная, 2 – Н-форма, 3 – OH-форма, 4 – Na-форма
По внешнему виду, согласно классификации теории БЭТ, представленные изотермы напоминают изотерму IV-a типа [13], вид которой характерен для сорбентов со смешанной структурой. Выпуклые участки изотермы обычно указывают на присутствие в сорбенте микропор. Из графических зависимостей видно, что активационные формы монтмориллонита имеют большую сорбционную способность, чем природная форма минерала.
Для исследования эффективности очистки модельных растворов от катионов железа (III) определяли отношение остаточного содержания ионов в растворе к исходной концентрации, принятой за 100 % [14].
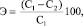
где С1 и С2 – концентрация ионов металла в растворе (мг/дм3) до и после процесса очистки соответственно.
Результаты представлены в виде графической зависимости эффективности очистки модельных растворов от времени контакта сорбента и сорбтива на рис. 3.
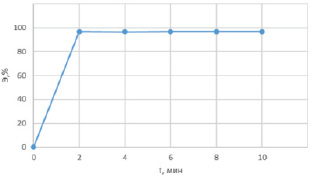
Рис. 3. График зависимости эффективности очистки от времени взаимодействия с сорбентом
Полученные результаты показывают, что на 2-й минуте контакта ионов железа с поверхностью минерала эффективность очистки составляет ~97 %, затем наблюдается процесс десорбции, который завершается на 4-й минуте. Равновесное состояние достигается при эффективности извлечения ионов железа ~96 %.
Кроме того, величиной, которая характеризует эффективность сорбционной очистки, является кратность извлечения ионов. Такая величина определяется как отношение исходной концентрации исследуемых ионов к равновесной (С1/Сравн). Это отношение показывает, во сколько раз снижается концентрация извлекаемых ионов в водных растворах в результате сорбции. Кратность извлечения ионов железа (III) составила 3,56; 3,43 и 4,22 на ОН-, Н- и Na-формах глинистого минерала соответственно.
Для исследования кинетики сорбционного процесса была рассчитана энергия активации. Значение энергии активации определяет режим протекания процесса очистки водных растворов. Для определения этой величины необходимо первоначально рассчитать константу скорости реакции. Константа скорости рассчитывается по «рабочей» формуле константы скорости 1-го порядка:
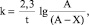 (2)
(2)
где t – время появления характерной желто-зеленой окраски (мин), х – количество трилона Б, добавленное к данному моменту времени (мл), А – общее количество трилона Б, добавленное на протяжении всего опыта (мл).
Константа скорости химической реакции зависит только от температуры и природы реагирующих веществ. В табл. 1 занесены средние константы скорости для каждой из температур соответствующей формы исследуемого минерала.
Таблица 1
Значения констант скоростей процесса сорбции железа (III) различными формами монтмориллонита при разных температурах
|
Формы сорбента |
Константа скорости (К × 104 , с-1) |
||
|
298 К |
318 К |
333 К |
|
|
Без добавок |
0,15 |
0,21 |
0,33 |
|
ОН-форма |
0,24 |
0,91 |
1,3 |
|
Na-форма |
0,19 |
0,82 |
1,16 |
|
Н-форма |
0,18 |
0,79 |
1,12 |
С ростом температуры модельных растворов константа скорости сорбционного извлечения ионов Fe3+ увеличивается для всех форм исследуемого минерала.
Энергия активации может быть определена из графической зависимости (ln k от 1/T), в соответствии с уравнением Аррениуса. Энергия активации определяется как тангенс угла наклона прямой к оси Х, умноженный на R (универсальная газовая постоянная) (рис. 4).
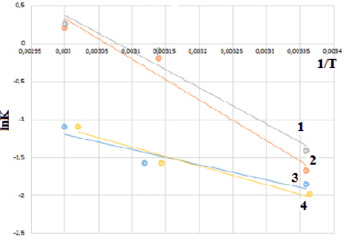
Рис. 4. Зависимость lnk от 1/Т для процесса сорбции: 1 – модифицированного сорбента гидроксидом натрия, 2 – модифицированного сорбента хлоридом натрия, 3 – модифицированного сорбента соляной кислотой, 4 – немодифицированного сорбента
В табл. 2 представлены рассчитанные величины энергии активации для каждой исследуемой формы сорбента.
Таблица 2
Энергия активации для сорбционного извлечения Fe3+ различными формами минерала
|
Форма минерала |
Энергия активации (Ea, кДж × моль-1) |
|
Без добавок |
11,97 |
|
ОН-форма |
23,45 |
|
Na-форма |
22,57 |
|
Н-форма |
20,075 |
Рассчитанные величины энергии активации находятся в том интервале значений, который характеризует диффузионную стадию сорбционного процесса [15]. Полученные значения энергии активации подтверждают смешанно-диффузионный характер сорбционного извлечения ионов Fe3+, где наибольшая роль принадлежит диффузия внутри зерна исследуемого сорбента.
Заключение
Полученные результаты показали, что сорбция железа (III) из модельных растворов протекает по смешанно-диффузионному механизму. Для увеличения сорбционной активности природного минерала необходимо проводить его химическую трансформацию. Наибольшим сродством по отношению к ионам железа (III) обладает солевая форма монтмориллонита. Химическая модификация природного материала является эффективным способом повышения сорбционной способности природного минерала. Согласно полученным результатам исследования можно рекомендовать природный минерал монтмориллонит для извлечения ионов железа (III) из водных растворов.



